Artificial Nanoscale Erythrocytes from Clinically Relevant Compounds for Enhancing Cancer Immunotherapy
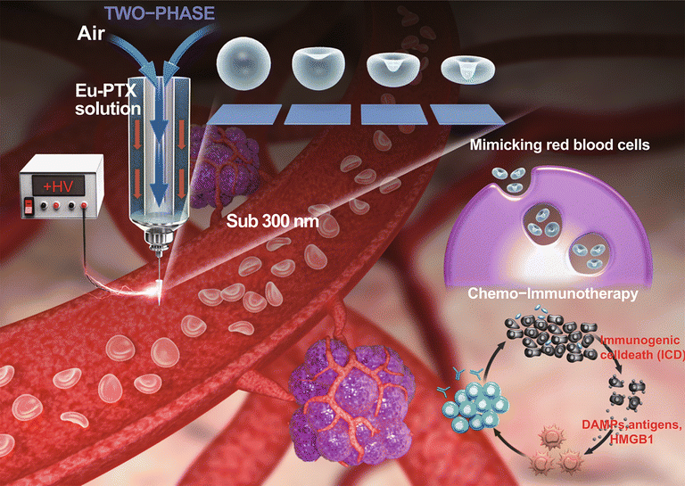
采用气泡压缩法生成Eu-FBCP/PTX的凹面结构。所设计的两相电喷雾成功地制备了凹形结构,这意味着干燥Eu溶质的气泡压制可以克服粘性力和表面张力(最好形成球形)而产生各向异性形状。用Cy5.5标记的纳米系统孵育MC-38和B16BL/6肿瘤细胞,来检测Eu-FBCP/Cy5.5和Eu-s/Cy5.5之间的细胞摄取差异。结果显示,Cy5.5标记的Eu(RL)纳米系统在MC-38和B16BL/6细胞中的细胞摄取量均显著低于Eu-FBCP/Cy5.5或Eu-s/Cy5.5的细胞摄取量。Eu-FBCP/PTX的粒径平均为320.8nm。Eu-FBCP/PTX纳米系统在48小时内的分散具有时间依赖的缓释特性(匹配HIGUCHI模型)。
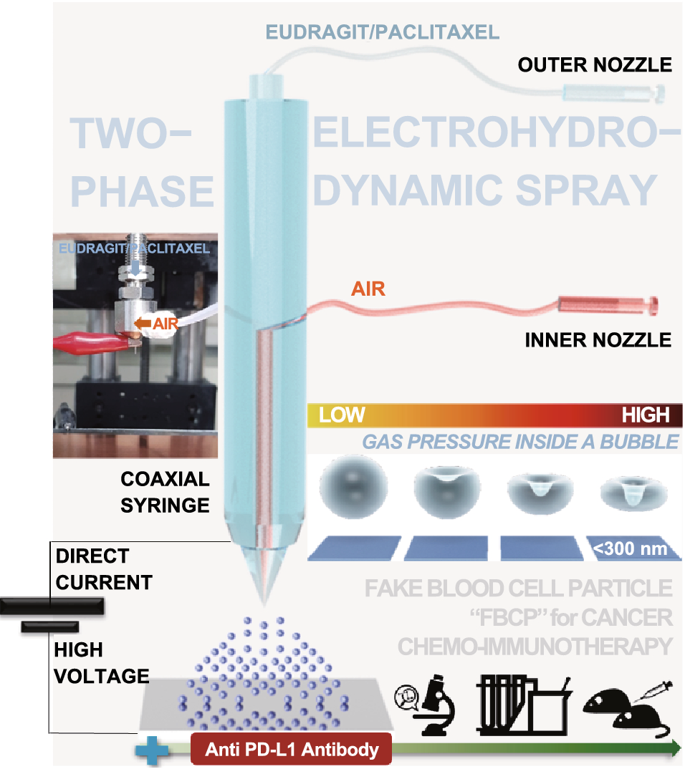
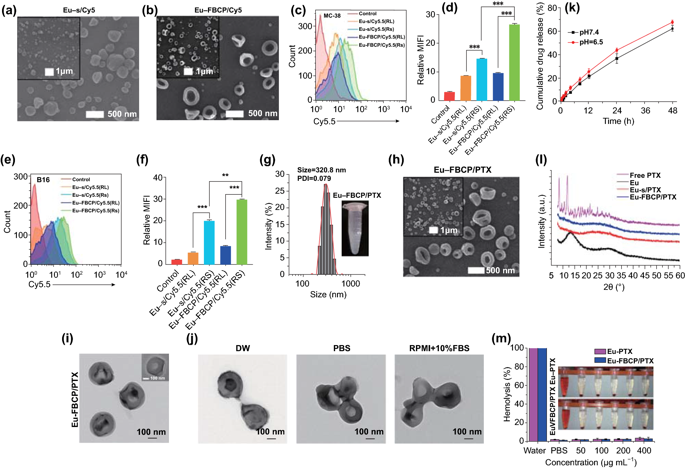
图2. PTX不存在时Eu-FBCP和Eu-s的表征。a,b Eu-s/Cy5.5和Eu-FBCP/Cy5.5的高、低倍扫描电镜图像。通过控制乙醇溶液中Eu的浓度,在不向内喷嘴喷射空气的情况下,制备了尺寸相近的Eu-s/Cy5.5。c-f FACS结果(n=3;荧光曲线和平均荧光强度[MFI])用于比较电喷雾中添加Cy5.5后Eu-FBCP和Eu-s之间MC-38(c,d)或B16(e,f)细胞的摄取,以检查Eu-FBCP因凹形而产生更好的摄取。该分析包括Eu-RL,以确认Eu-RS和Eu-RL之间的吸收差异,为选择Eu-RS提供依据。g Eu-FBCP/PTX在PBS(嵌入数字图像)中的DLS尺寸分布和PDI。h,i Eu-FBCP/PTX的高、低倍扫描电镜(h)和透射电镜(i)图像。j Eu-FBCP/PTX在DW、PBS或RPMI+10%FBS中分散8h后的典型TEM图像研究不同介质的水动力稳定性。k在pH6.5或pH7.4(n=3)条件下,从Eu-FBCP/PTX中释放PTX 48小时。i Eu-FBCP/PTX和Eu-s/PTX以及游离PTX和Eu(RS;电喷雾前)的XRD谱图,考察并比较Eu和PTX的掺入情况。m 用不同浓度的Eu-FBCP/PTX或Eu-s/PTX(50-400μg mL-1)培养红细胞8小时后溶血结果(n=3;**p<0.01 and **p< 0.001)。
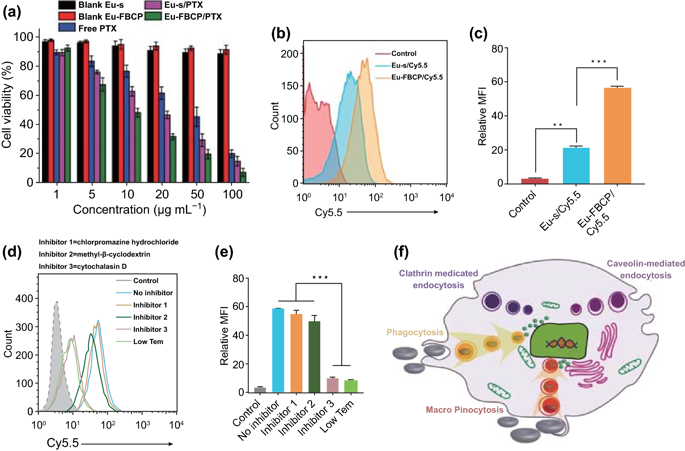
II 体外细胞活力与细胞摄取
MTT结果显示,Eu-FBCP和Eu-s(在没有PTX的情况下)均表现出高细胞活性(>95%),而游离PTX诱导剂量依赖性细胞毒性,显示出28.4μg mL-1的最大半数抑制浓度(IC50)。Eu-s/PTX,Eu-FBCP/PTX的最大半数抑制浓度分别为15.9和9.7μg mL-1,均显著低于游离的PTX。研究显示,Eu-FBCP/Cy5.5的细胞摄取较Eu-s/Cy5.5增加了3倍且Eu-FBCP/Cy5.5主要通过吞噬和大胞饮途径进入细胞。
III 细胞周期与凋亡
Eu-FBCP/PTX诱导85.4%的细胞凋亡(早期和晚期:Q2+Q3),比Eu-s/PTX诱导的细胞凋亡率高16.8%。线粒体膜电位 (ΔΨm)的丧失是Cyt c从线粒体向胞浆转运的重要标志,是凋亡程序的开始。Eu-FBCP/PTX纳米系统较其它药物组有更强的线粒体损伤效果。
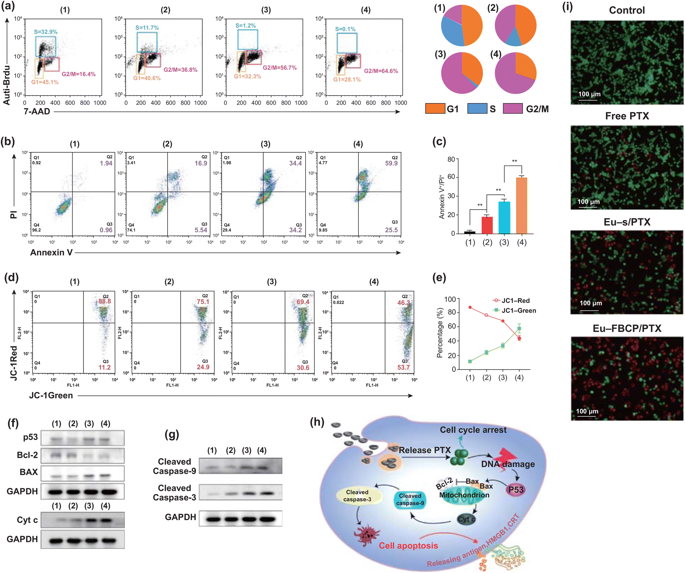
图4. 不同组别的MC-38细胞的体外细胞周期和凋亡分析(1:对照,2:游离PTX,3:Eu-s/PTX,4:Eu-FBCP/PTX)。a 不同处理(1-4)的细胞周期分析结果。Brdu和PI用于计算细胞周期中每个阶段(G1、S或G2/M)的细胞分数。b,c 使用Annexin V-FITC/PI试剂盒(n=3)对24小时治疗(1-4)的凋亡情况和量化数据进行分析。d,e 处理24小时后,细胞的 FACS曲线和JC-1染色的量化数据显示(1-4)细胞(n=3)线粒体膜电位的变化。f,g p53、Bcl-2、Bax、Cyt-c、裂解caspase-9和裂解caspase-3在治疗细胞(1-4)中的代表性表达。h 基于表达(f, g)的治疗细胞(1-4)凋亡的可能机制示意图。i 处理后活/死细胞实验的代表性显微镜AO/PI染色细胞图像(1-4)。
IV 免疫原性细胞死亡诱导的免疫反应
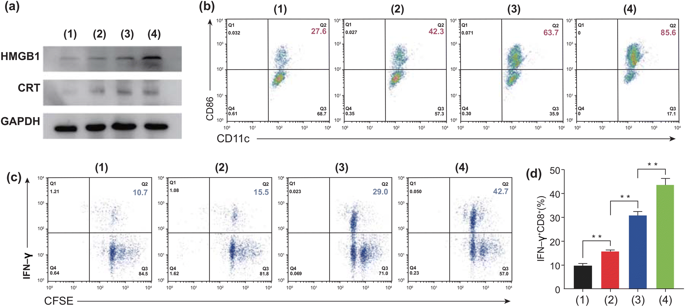
图5. 不同方法处理后,对MC-38细胞进行体外生物测定,以检测ICD诱导的的DC细胞成熟和CD8+T细胞活化。1:对照组,2:游离PTX,3:Eu-s/PTX和4:Eu-FBCP/PTX)。a 治疗组(1-4)HMGB1和CRT的代表性表达,显示ICD的诱导。b 处理细胞后(1–4)CD11c+–CD86+(作为DC成熟的指标)通过产生的TAA来识别DC的成熟。c CFSE-IFN-γ检测CD8+T细胞的增殖和活化。d 处理细胞后(1-4)活化的IFN-γ+CD8+T细胞。
V 体内分布
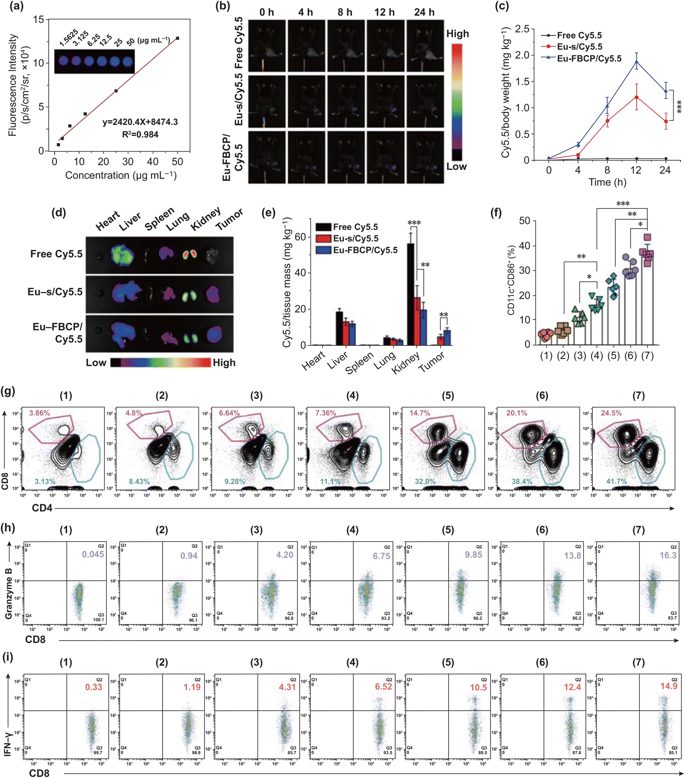
图6. Eu-FBCP/Cy5.5(或Eu-s/Cy5.5)的体内生物分布及不同处理(1:PBS,2:游离PTX,3:Eu-s/PTX,4:Eu-FBCP/PTX,5:aPL,6:Eu-s/PTX+aPL,7:Eu-FBCP/PTX+aPL)的抗肿瘤免疫反应。a 体内处理后,使用动物成像系统获得浓度范围为1.5625至50.0000微克/毫升的荧光Cy5.5的校准曲线。b 荧光时间影像(0、4、8、12和24小时)检测Eu-FBCP/Cy5.5和Eu-s/Cy5.5以及游离Cy5.5在静脉注射后的肿瘤蓄积情况。c 不同时间点的Cy5.5在肿瘤中的分布。d,e 静脉注射24小时后小鼠主要器官和肿瘤的典型荧光图像和量化数据。f 不同处理方法静脉注射树突状细胞瘤内成熟(1-7)(n =6; *p< 0.05,**p< 0.01, and ***p< 0.001)。g 药物处理后CD4+–CD8+T细胞浸润到肿瘤微环境中(1-7)。g,i 药物处理后肿瘤内浸润CD8+T细胞CD8+–颗粒酶B+和CD8+–IFN-γ+水平图(1-7)。
VI 体内抗肿瘤免疫治疗
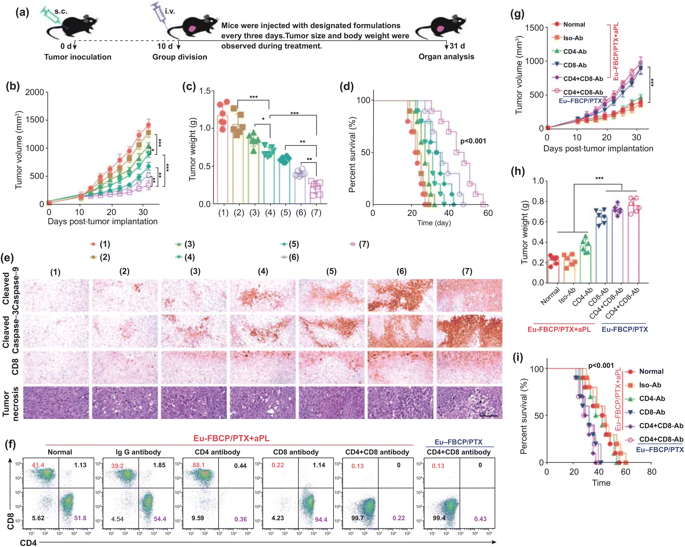
图7. Eu-FBCP/PTX和Eu-s/PTX在aPL缺乏(诱导化学ICD)和存在(增强免疫抗肿瘤活性)情况下的体内抗肿瘤作用(*p< 0.05, **p<0.01, and ***p <0.001)。a 不同处理(1:PBS、2:游离PTX、3:Eu-s/PTX、4:Eu-FBCP/PTX、5:aPL、6:Eu-s/PTX+aPL和7:Eu-FBCP/PTX+aPL)体内抗肿瘤研究的实验时间表示意图。b, c从治疗小鼠(1-7;每组6只)收集的肿瘤大小和肿瘤最终重量的时间分布。d治疗小鼠的存活曲线(1-7;每组10只)。e在从治疗小鼠(1-7只,每组6只)获得的肿瘤切片中,切割的caspase-9、切割的caspase-3、CD8+和肿瘤坏死因子的组织病理学和免疫组化表达。f用PBS(正常)、IgG抗体(Iso-Ab)、CD4抗体(CD4-Ab)、CD8抗体(CD8-Ab)和CD8+CD4抗体(CD4+CD8-Ab)预处理后免疫细胞生成,构建免疫组化MC-38荷瘤小鼠模型。g, h单独用Eu-FBCP/PTX+aPL或Eu-FBCP/PTX治疗的免疫组化小鼠(每组6只)的肿瘤大小和最终肿瘤重量的时间分布。i单独用Eu-FBCP/PTX+aPL或Eu-FBCP/PTX治疗的免疫复合小鼠的存活曲线(每组10只)。
 Jeong Hoon Byeon
Jeong Hoon Byeon
助理教授
Yeungnam University
气溶胶自组装“Byeon-Roberts方法”、纳米超声火焰(NSUF)合成和气相光跟踪器制造。这些技术分别用于制备生物功能纳米材料、钙钛矿基纳米复合材料和量子/荧光纳米点。
▍主要研究成果
发表99篇国际期刊文章,有20项申请专利和62项注册韩国专利,3项(美国)注册专利和4项(美国)+17项(PCT)申请专利。
 Jong Oh Kim
Jong Oh Kim
教授
Yeungnam Univeristy
纳米药物,纳米颗粒,药物递送系统,抗肿瘤。
 Jungho Hwang
Jungho Hwang
Yonsei University
热能工程,可再生能源技术和环境保护,能量转换,气溶胶科学与技术等。
撰稿:《纳微快报》编辑部
E-mail:editorial_office@nmletters.org
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 人工纳米红细胞:提高化疗免疫疗效的药物递送载体
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用