研究背景
细胞分离被广泛应用于临床治疗和生物研究领域,包括再生医学、癌症治疗和艾滋病发病机制等。为了模拟生物免疫识别过程,人们亟需开发出具有更好特异性和稳定性的自动分离系统。化学自驱动的人造纳米机器人由于形状多变、易于操控和生物相容性好的特点,在药物运输和水质修复等各个领域都显示出了巨大的潜力。然而,针对这些微米到毫米级的生物大分子/生命体的特定分离,只有少数功能化微型机器人能实现在移动过程中识别和携带目标细胞,但较长距离内操纵重物的功能尚未实现。此外,现有的工作更侧重于对单细胞操纵,但从混合体系中自主运输和富集目标细胞的工作也仍需开展。这些关键科学问题的开展将对纳米机器人在生物医学和临床应用中的进一步开发和利用具有重要的意义。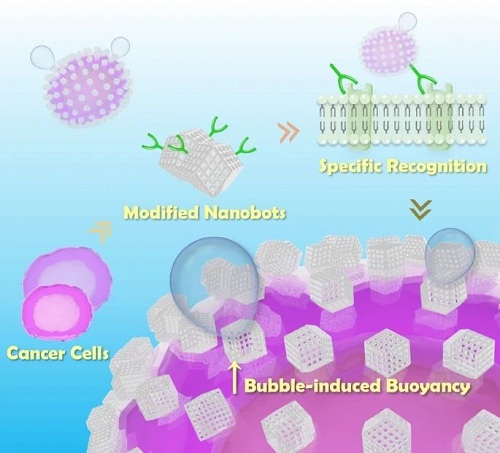
Biocatalytic Buoyancy-Driven Nanobots for Autonomous Cell Recognition and Enrichment
1. 开发了一种生物催化浮力自驱动的金属有机框架(MOF)纳米机器人。
内容简介
自驱动纳米潜水器是生物和环境技术领域的下一代纳米装置候选者。然而,目前的纳米潜水器产生的能量有限,只能完成短距离和短时间内的移动,很难满足活细胞的实际运输需求。新南威尔士大学梁康等开发了一种基于可生物降解的MOF纳米机器人,通过生物催化作为驱动浮力,可实现对目标细胞“发现并获取”的高效、长距离、定向垂直运输。利用细胞表面癌胚抗原的抗体标志物对纳米机器人进行表面功能化处理,赋予纳米机器人对特异细胞的靶向能力,以识别和分离癌细胞。进一步证明,自驱动纳米机器人可以完全自主运输并识别细胞,所分离出的细胞可以轻松地用定制玻璃柱收集,且分离后恢复其全部代谢功能。所开发的利用简便合成法得到的纳米机器人将在细胞识别、分离和富集方面具有重要意义。
图文导读
I 生物催化浮力驱动纳米机器人系统
本工作开发了一种生物催化浮力驱动的纳米机器人系统,该系统具有特异性抗体功能,可从混合细胞系中高效、自主地识别和富集细胞。沸石咪唑框架-8(ZIF-8)是一种具有沸石拓扑结构的典型金属有机框架(MOFs)材料,因其良好的生物兼容性作为纳米机器人基质。通过简单的生物矿化过程将生物活性酶过氧化氢酶(CAT)构筑其中(CAT-ZIF-8)。为了赋予ZIF-8纳米机器人特异性识别能力,单克隆抗癌胚胎抗原(CEA)被还原成半片段,并通过Zn-S键自发合修饰在纳米机器人表面。将制备的anti-CEA-CAT-ZIF-8纳米机器人与PF-127和BSA溶液进一步孵育,以防止非特异性结合,通过添加H₂O₂产生O₂气泡从而作为自驱动浮力。考虑到潜在的工作环境,ZIF-8基质在弱酸性条件下或在生物相容性金属螯合剂(如EDTA)的存在下很容易降解,便于细胞回收。为了简化纳米机器人的自主细胞“寻找和拾取”过程,设计了一个带有两个开关的定制玻璃柱(图1)。该纳米机器人系统利用了长距离持续气泡阻力的优势,首次将浮力驱动纳米机器人应用于细胞分离,并在混合细胞体系中表现出卓越的目标细胞识别和运输能力。

图1. anti-CEA-CAT-ZIF-8纳米机器人合成示意图及其利用定制玻璃柱自主“寻找和获取”细胞的过程。
II Anti-CEA-CAT-ZIF-8纳米机器人的特性和运动分析
图2a所展示的是anti-CEA-CAT-ZIF-8纳米机器人的TEM图,其直径约为500 nm的菱形十二面体,与标准ZIF-8纳米晶体相似。如图2b所示,通过流式细胞仪测量了合成的CEA-CAT-ZIF-8的荧光信号已增强,表明已经封装成功。图2c所展示的是标准梯形图定位条带位置结果,全抗体的条带主要在130至100 kDa之间,半抗片段的条带主要在70 kDa之间。上述结果证实了功能性半抗体片段已经成功连接在纳米机器人表面。为了评估anti-CEA-CAT-ZIF-8纳米机器人的细胞结合能力,将FITC标记的纳米机器人与MCF-7细胞孵育。共焦激光扫描荧光显微镜和SEM图像进一步验证了anti-CEA-CAT-ZIF-8与MCF-7细胞的结合(图2e–i)。用高速相机记录并分析了纳米机器人-细胞杂交体的垂直运动(图2j)。结果表明,anti-CEA-CAT-ZIF-8与MCF-7的上升速度与H₂O₂燃料的浓度呈正相关(图2k和l)。根据这些结果,可以确定纳米机器人获得了足够的浮力。

图2. Anti-CEA-CAT-ZIF-8纳米机器人的特征和运动分析。(a)anti-CEA-CAT-ZIF-8纳米机器人的TEM图像(标尺为500 nm);(b)纯ZIF-8和anti-CEA-CAT-ZIF-8的流式细胞术结果直方图;(c)还原型和非还原型CEA抗体的SDS-PAGE分析:使用标准梯形图定位条带位置;(d)纯ZIF-8、anti-CEA-CAT-ZIF-8、含第一抗体的anti-CEA-CAT-ZIF-8,以及含有第一和第二抗体的anti-CEA-CAT-ZIF-8的流式细胞术结果;(e–h)共焦激光扫描荧光显微镜图像:细胞核用Hoechst(蓝色)染色,细胞膜用BioTracker 655红色细胞质膜染料(品红色)染色,anti-CEA-CAT-ZIF-8用FITC(绿色)标记;(i)anti-CEA-CAT-ZIF-8与MCF-7细胞的代表性SEM图像(标尺为5 μm):细胞用蓝色伪影,anti-CEA-CAT-ZIF-8用绿色伪影;纳米机器人细胞的(k)移动距离和(l)上升速度:误差条代表三个独立记录的轨迹的标准偏差,每次至少分析了50个粒子。
III Anti-CEA-CAT-ZIF-8纳米机器人对粘附细胞的识别和自主分离作用
首先,使用粘附细胞评估了anti-CEA-CAT-ZIF-8纳米机器人在细胞识别和自主分离方面的性能(图3a)。将CEA阳性的MCF-7细胞系和CEA阴性的L929细胞系以相同的初始细胞数种在12孔板的玻璃载玻片上,培养过夜。用Hoechst(蓝色)对MCF-7进行染色处理,以流式细胞仪区分MCF-7和L929。随后将两种细胞系转移到同一孔中,与FITC标记的anti-CEA-CAT-ZIF-8纳米机器人一起持续振荡孵育,2小时后将细胞从玻璃载玻片上剥离并用流式细胞仪进行分析(图3b和c)。将蓝色荧光强度较高的绿色轮廓视为MCF-7,根据流式细胞术结果显示符合预期,大多数MCF-7细胞都与纳米机器人结合在一起。而在L929细胞群中FITC的荧光强度几乎没有变化。这表明anti-CEA-CAT-ZIF-8纳米机器人与L929细胞的结合可忽略不计。为了实现细胞的自主运输/分离,采用一种定制玻璃柱(图3d)将混合细胞样本从玻璃载玻片上分离,然后转移到玻璃柱的细胞装载部分,并在工作区与H₂O₂进行(1.6 mM)分离(图3a)。打开底部开关,纳米机器人在H₂O₂燃料存在下通过生物催化气泡的形成实现上升运动,在15分钟内自主将抗体结合的靶细胞带到顶部细胞收集区。最后关闭顶部开关,将漂浮在收集区的细胞实现分离(具体可见自主分离视频)。
纳米机器人分离后回收细胞的荧光显微镜图像显示,与分离前的1:1细胞混合物相比,MCF-7细胞占优势(图3e和f)。图3g所展示的是采用流式细胞仪对细胞分离效率定性评估结果,与MCF-7:L929比例为1:1的起始细胞混合物相比,纳米机器人回收细胞的比例增加到2.45:1,显示具有出色的细胞分离效率。值得注意的是,MCF-7细胞的回收率达到了99%以上。总之,研究结果证明纳米机器人具有杰出的细胞识别和分离效率。

图3. (a)纳米机器人识别和分离附着细胞实验示意图;(b)MCF-7和(c)L929与1 μL FITC标记的anti-CEA-CAT-ZIF-8的光谱偏移,纯细胞的峰值显示为红色;(d)根据1、1.5和2 μL的anti-CAT-ZIF-8流动计算出的纳米机器人相关细胞堆叠柱状图;(e)对照组和(f)隔离细胞样本的荧光图像:MCF-7(伪影红色)和L929(伪影黄色)分别用Hoechst和钙蓝蛋白AM染色(标尺为200 μm);(g)流式细胞仪分离细胞样本的点阵图。
IV Anti-CEA-CAT-ZIF-8 纳米机器人对悬浮细胞的识别与自主分离作用
针对未来临床诊断的悬浮细胞条件需求,该工作直接利用悬浮细胞研究了纳米机器人细胞分离性能,进一步挖掘其在细胞分离中的实用性和自主潜力。细胞识别和分离悬浮细胞的过程如图4a所示。与粘附状态的细胞不同,细胞悬浮液中过量的纳米机器人无法被冲洗掉,因此确定纳米机器人的添加量至关重要。与L929细胞(15.1%)相比,MCF-7细胞与纳米机器人结合的比例(40%)更高,这表明anti-CEA-CAT-ZIF-8与MCF-7有特异性结合能力(图4b和c)。从光谱中收集了两种细胞株与anti-CEA-CAT-ZIF-8的相关比率,并用叠加图显示在图4d中,这表明MCF-7的靶向特异性随着anti-CEA-CAT-ZIF-8用量的减少而增加,在以下自主细胞分离实验中选择添加1 μL的anti-CEA-CAT-ZIF-8纳米机器人。纳米机器人分离后回收细胞的荧光显微镜图像显示,与分离前的起始细胞混合物相比,MCF-7细胞明显增多(图4e和f)。图4g结果表明,纳米机器人在混合细胞群中(MCF-7与L929的比例为1.83:1)成功分离并浓缩了CEA阳性的MCF-7细胞。

图4. (a)纳米机器人自主识别和分离悬浮细胞的示意图;(b)MCF-7和(c)L929与1 μL FITC标记的anti-CEA-CAT-ZIF-8光谱偏移,纯细胞的峰值显示为红色;(d)根据1、1.5和2 μL的anti-CEA-CAT-ZIF-8流动结果计算出的纳米机器人相关细胞堆叠柱状图;(e)对照组和(f)隔离细胞样本的荧光图像,MCF-7(伪影红色)和L929(伪影黄色)分别用Hoechst和钙蓝蛋白AM染色(标尺为200 μm);(g)流式细胞仪分离细胞样本的点阵图。
V 挑战与未来展望
在这项工作中,开发了一种抗体功能化的生物催化MOF纳米机器人,其动力输出十分出色,并且实现从混合细胞群中对特异性细胞进行识别和自主运输。在水环境中,H₂O₂通过生物催化产生的O₂气泡会被疏水性纳米机器人基质优先截留,从而产生足够的浮力,有效推动抗体结合的细胞向上移动。与传统的磁珠不同,纳米机器人可以被降解,回收的细胞可以保持完整的增殖能力。纳米机器人未来可以选用其他生物兼容性更强的化学燃料,如通过葡萄糖氧化酶-催化酶耦合级联反应的葡萄糖,或通过脲酶生物催化反应的尿素。总之,纳米机器人辅助细胞识别和分离的简便性和多功能性为生物医学提供了一种新型工具,凸显了其在临床和商业上的巨大潜力。
作者简介

(1)生物纳米界面先进材料在生物医学中的应用研究;(2)多孔纳米颗粒微纳结构的刺激响应变化以及在生物催化、生物分子传递和生物传感中的应用研究。
 郭忠
郭忠 梁康
梁康(1)生物纳米界面先进材料在生物医学中的应用研究;(2)多孔纳米颗粒微纳结构的刺激响应变化以及在生物催化、生物分子传递和生物传感中的应用研究。
现任澳大利亚新南威尔士大学(UNSW)化学工程系与生物医学工程系卓越高级研究员、国家卫生和医学研究理事会职业发展研究员、维多利亚研究员、墨尔本大学、莫纳什大学荣誉研究员、UNSW微纳生物界面系统研究组组长。在仿生学智能纳米生物材料的构建机理以及在多种生物界面上的构建等方面具有丰富的研究经验。在本领域已发表顶级SCI收录论文100余篇,其中多篇论文被收录在Science, Science Advances, Nature Communications, Chem, Materials Today, Advanced Materials, Advanced Functional Materials, ACS Nano, Angewante Chemie, Chemical Science等期刊。
关于我们
 Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 新南威尔士大学梁康等:生物催化浮力自驱动纳米机器人实现细胞自主识别与富集
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用