研究背景
膀胱癌是一种常见的泌尿系统恶性肿瘤,标准治疗包括经尿道膀胱肿瘤切除术(TURBT)、膀胱内化疗和非肌肉侵袭性膀胱癌症免疫疗法(NMIBC),以及肌肉侵袭性癌症根治性膀胱切除术和化疗。目前的疗法面临着几个挑战:单纯TURBT或膀胱切除术通常不足以预防复发,而膀胱内治疗则存在药物滞留不良、全身毒性和对膀胱组织渗透有限的问题。丝裂霉素C和卡介苗免疫疗法等化疗药物虽然有效,但会引起严重的副作用,并可能导致耐药性。光热疗法(PTT)已成为治疗晚期肿瘤的一种替代方案。PTT利用光敏剂(PS)将激光能量转化为热量,诱导高温介导的细胞死亡。这种不依赖氧气的机制可能会克服PDT与缺氧相关的局限性。因此,开发可同时诱导光动力疗法(PDT)和PTT效应用于膀胱癌症治疗的双模态PS,引起了科学家们的广泛研究。
PS通常表现出近红外(NIR)吸收,具有近红外荧光(FL)成像能力,有助于在微观尺度上区分癌组织和正常组织,提高手术中的肿瘤切除的准确性。虽然FL成像因其高灵敏度而显示出术中或离体成像应用的前景,但其在体内的实用性受到生物组织中相对较低的穿透深度和强烈的光散射的限制。而光声(PA)成像将光吸收转化为声信号,具有高分辨率、深层组织可视化,克服了传统光学成像的许多局限性。此外,PA成像可以通过利用内源性吸收剂(如氧/脱氧血红蛋白)的差异光学吸收特性来提供功能性生物信息,如血氧水平、血红蛋白浓度和代谢活动。因此,将PA成像与PDT相结合,可以实时、无创地监测血氧饱和度,从而优化治疗计划并改善治疗结果。然而,PA成像中的视场(FOV)高度依赖于超声(US)换能器,通常将其限制在局部区域。此外,与FL成像相比,PA成像的灵敏度较低。因此,整合PA和FL成像为全面的癌症诊断和治疗监测提供了一种强大的方法,将功能信息与药物积累细节相结合,从而协同克服每种技术的局限性。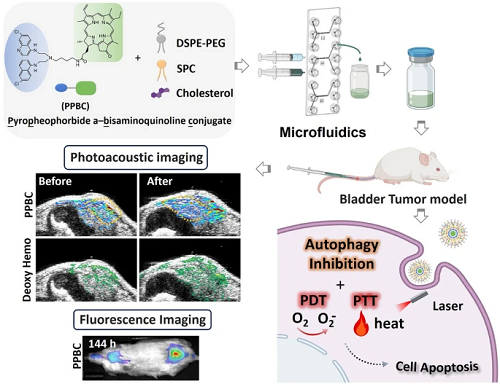
Multifunctional and Scalable Nanoparticles for Bimodal Image-Guided Phototherapy in Bladder Cancer Treatment
Menghuan Tang, Sohaib Mahri, Ya-Ping Shiau, Tasneem Mukarrama, Rodolfo Villa, Qiufang Zong, Kelsey Jane Racacho, Yangxiong Li, Yunyoung Lee, Yanyu Huang, Zhaoqing Cong, Jinhwan Kim*, Yuanpei Li*, Tzu-Yin Lin*
Nano-Micro Letters (2025)17: 222
https://doi.org/10.1007/s40820-025-01717-0
本文亮点
1. 焦脱镁叶绿酸a-双氨基喹啉共轭脂质纳米粒(PPBC LNPs)由脂质基赋形剂配制,并使用微流体组装而成,具有优异的生物相容性和稳定性,具有较好的临床应用前景。
2. PPBC LNPs具有卓越的光声和荧光成像能力,能够实现高分辨率、深层组织穿透和高灵敏度成像,用于跟踪药物生物分布和光疗疗效。
内容简介
合理设计能够将治疗效果与药物分布和肿瘤状态的实时监测相结合的多功能纳米平台是癌症纳米医学中一种很有前途的方法。加州大学戴维斯分校Yuanpei Li等人构建了焦绿酸a–双氨基喹啉结合脂质纳米颗粒(PPBC-LNP),该纳米颗粒可以作为图像引导光疗法的双模态系统用于癌症膀胱的治疗。PPBC-LNP不仅在光激活时表现出强大的光动力和光热效应,而且表现出强烈的自噬阻断作用,有效诱导膀胱癌症细胞死亡。此外,PPBC LNPs具有卓越的光声(PA)和荧光(FL)成像能力,能够实现高分辨率、深组织穿透和高灵敏度的成像,用于跟踪药物生物分布和光疗疗效。具体而言,PA成像证实了PPBC LNPs在肿瘤内的有效积累,并预测了光动力疗法的治疗结果,而FL成像证实了它们在肿瘤部位的长期保留长达6天。PPBC LNPs显著抑制膀胱肿瘤生长,仅需两剂纳米颗粒和激光治疗,几个肿瘤就完全消融。此外,PPBC LNPs用脂质赋形剂配制,并使用微流体技术组装,以提高生物相容性、稳定性和可扩展性,显示出临床转化的潜力。这种多功能纳米颗粒代表了在膀胱癌症治疗中进一步发展的一种有前景的候选物。
图文导读
I PPBC LNPs的制备和表征及其光诊断特性
通过将焦脱镁叶绿酸和双氨基喹啉偶联合成PPBC单体,其结构通过NMR光谱得到证实(图1a)。SPC、DSPE-PEG2000和胆固醇被掺入纳米粒子(NP)中,以提高其在体内的稳定性和生物相容性。随后,利用微流体平台合成LNP,可以精确控制混合条件并实现大规模生产(图1b)。如图1c所示,10 mL min⁻1的总流速(TFR)和2:8的流速比(FRR)(乙醇/水)制备出最理想的NP。在这些条件下,PPBC LNPs的平均流体动力学直径为48.1 nm,多分散指数(PDI)为0.20。进一步优化组分比表明,PPBC:SPC:DSPE-PEG2000:胆固醇的配方为1:2:2:1,制备了平均粒径为125 nm的均匀NP,PDI < 0.2 (图1d)。
重构的LNPs的平均粒径为107 nm,呈典型的球形形态,粒径分布窄,PDI为0.15,近中性电荷为1.72 mV(图1e,f)。PPBC表现出高封装效率 > 98%. 此外,冻干的PPBC LNPs粉末 + 4 在°C下保持6个月不影响其稳定性,而重组的PPBC LNPs在 + 4 °C(图1g)。这些发现突出了PPBC LNPs进一步扩大规模和临床应用的潜力。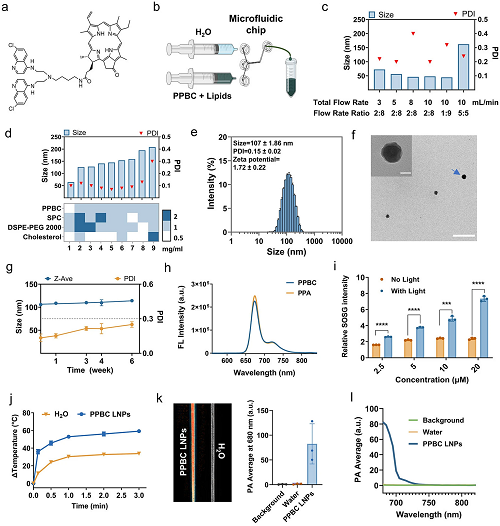
图1. (a)PPBC的化学结构。(b)用于合成PPBC LNPs的微流体系统示意图。(c)通过改变TFR、FRR优化PPBC LNPs尺寸和PDI。(d)脂质成分浓度比(n=3)。(e)代表性DLS数据。(f)重构PPBC LNP的TEM图像;比例尺:50纳米(插入)、400纳米。(g)重组PPBC LNPs在+4 °C下的稳定性。(h)PPBC和PPA的荧光(FL)光谱(激发,412nm)。(i)使用SOSG作为ROS指示剂测量的PPBC LNPs的光动力效应(1O₂产生)。(j)PPBC LNPs的光诱导高温(n=3)。(k)PPBC LNPs在水溶液中产生PA信号。(l)PPBC LNPs在680-820nm处的光谱PA振幅。
鉴于PPBC的卟啉衍生结构,研究了PPBC LNPs的光散射特性。荧光光谱显示,PPBC表现出与PPA相同的特征发射波长,表明PPBC LNPs保持了PPA的光学性质(图1h)。为了评估PPBC LNPs的光疗效果,在体外研究了活性氧(ROS)的产生和光诱导热疗。如图1i所示,单线态氧(1O₂)传感器绿色(SOSG)的荧光强度在光照下以剂量依赖的方式增加,而在没有光照的情况下保持不变,这证实了PPBC LNPs的ROS产生是由光有效触发的。PPBC LNP产生的高温在光照射下达到59 °C(图1j),该温度足以在2分钟内对癌症细胞造成不可逆的损伤。PPBC LNPs溶液的温度升高与激光功率、溶液浓度和暴露时间相关,表明其具有发热能力。此外,研究发现PPBC LNPs表现出优异的热光稳定性,能够承受连续几个加热和冷却循环,而不会显著损失发热能力。PPBC LNP的光转换效率(η)计算为32.7%。这些结果表明,PPBC LNPs表现出强大的PDT和PTT特性,表明它们具有有效光疗的潜力。鉴于PPBC LNPs在近红外区域的强光吸收,评估了其作为光声(PA)成像造影剂的潜力。与水和背景对照相比,PPBC LNPs溶液在680 nm激光激发下显示出显著增强的PA对比度(图1k)。此外,近红外范围内的PA信号光谱与PPBC LNPs的光吸收光谱紧密对齐,证明了它们在近红外区域内作为PA造影剂的有效性(图1l)。
II 细胞摄取和抗溶酶体/自噬作用
为了评估细胞摄取,用PPBC-LNP处理T24人膀胱癌症细胞,并在处理后2、4、8和24 h获取荧光图像。如图2a、b所示,PPBC-LNP被膀胱癌症细胞迅速内化,并表现出时间和剂量依赖性积累。为了进一步阐明PPBC LNPs的细胞摄取机制,测试了各种内吞抑制剂对其内化的影响。T24细胞用不同的摄取抑制剂预处理,包括氯丙嗪(CPZ,网格蛋白介导的内吞抑制剂)、金雀异黄素(caveolae介导的外吞抑制剂)和阿米洛利(macropinocytis抑制剂)。值得注意的是,在低温下孵育和暴露于染料木素显著抑制了PPBC LNPs的细胞摄取,而其他抑制剂没有显示出显著的效果(图2c,d)。这一发现表明,PPBC LNPs在T24细胞中的内化是一个能量依赖性过程,主要通过小窝介导的内吞作用发生。随后,监测了用不同浓度的PPBC LNPs处理的细胞的PA信号。在含有PPBC LNPs摄取细胞的组织模拟成像体模中,清楚地观察到强烈的PA信号(图2g),信号强度以浓度依赖的方式增加(图2e)。这些结果进一步强调了PPBC LNPs不仅作为PDT的光敏剂,而且作为PA和FL成像的有效成像造影剂的潜力。
由于PPBC被设计为光敏剂和自噬抑制剂的结合物,因此假设它会在溶酶体中积累并进一步导致自噬抑制。为了验证这一点,使用CLSM研究了PPBC LNPs与溶酶体的共定位。如图2f、h所示,随着时间的推移,PPBC LNPs的信号与LysoTracker的信号越来越重叠,在孵育8 h后达到0.73的Pearson相关系数,表明PPBC LNP在溶酶体中有效积累。为了进一步评估PPBC LNPs对溶酶体完整性的影响,用葡聚糖AF 488处理细胞,葡聚糖AF 488是一种通常局限于完整溶酶体内的荧光标记物。在T24和UPPL细胞中,PPBC LNPs处理诱导了葡聚糖AF 488的弥漫性细胞质分布,表明溶酶体膜的通透性(LMP)(图2i)。值得注意的是,在相同浓度下,自噬抑制剂氯喹(CQ)与PPBC LNPs相比表现出较弱的LMP。接下来,使用蛋白质印迹分析检测了关键自噬标志物微管相关蛋白1轻链3(LC3B)和多价体1(SQSTM1/p62)的水平。自噬抑制通常表现为LC3B-II和p62水平同时升高。与对照组相比,用PPBC LNPs处理的细胞显示出LC3B-II的剂量依赖性升高。有趣的是,PPBC LNPs诱导了高分子量(HMW)-p62物种的显著产生,而单-p62水平相应降低(图2j)。先前的研究表明,药物或自噬相关基因缺陷引起的氧化还原应激可以诱导HMW-p62的产生,表明p62寡聚化和自噬受损。因此,HMW-p62的形成似乎归因于PPBC LNPs诱导的自噬抑制和适度的氧化还原应激。这种自噬抑制特征是PPBC的一个关键属性,特别是考虑到传统的PDT已被证明可以激活自噬,这可能会导致治疗耐药性。通过抑制自噬,PPBC具有克服这种耐药性机制的巨大潜力,从而提高光敏剂在膀胱癌症治疗中的疗效。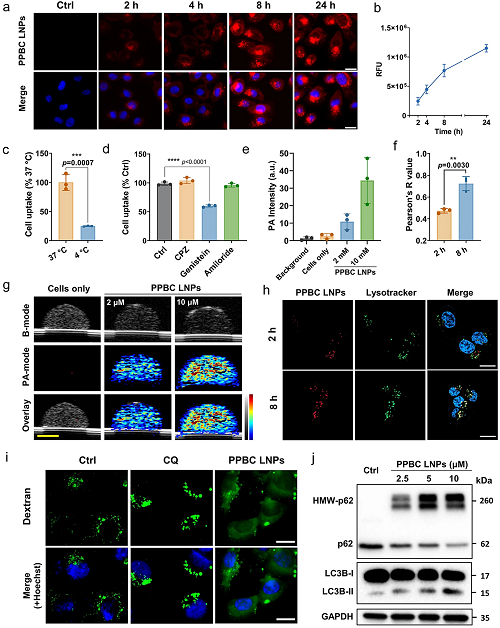
图2. (a)T24膀胱癌症细胞对PPBC LNP的摄取随时间的增加而增加;比例尺:50 μm。(b)PPBC LNPs的时间依赖性和(c)能量依赖性细胞摄取。(d)不同的内吞抑制剂对T24细胞摄取PPBC LNPs的影响。用金雀异黄素(20 μM)处理显著抑制了摄取,金雀异色素是一种小窝介导的内吞作用抑制剂。(e)g图中所示的PA信号的相应量化。(f)h图中共定位的Pearson’s相关系数(Pearson’s R)。(g)680 nm下PPBC LNPs标记的T24细胞的US/PA图像;比例尺:2 mm。(h)PPBC LNPs与溶酶体的共定位分析;细胞核用Hoechst 33342染色;比例尺:20 μm。(i)负载右旋糖酐AF 488的T24细胞暴露于氯喹(CQ,10 μM)或PPBC LNPs(10 μM)24 h的代表性图像;细胞核用Hoechst 33342染色;比例尺:20 μm。(j)处理12 h的T24细胞中自噬相关蛋白(p62,LC3B)的免疫印迹。
III 光疗效果的体外评估
在人和小鼠膀胱癌细胞系中探索了PPBC LNPs介导的光疗效果。如图3a、b所示,PPBC LNPs即使在没有光照的情况下也表现出强烈的细胞毒性,这主要是由于其固有的自噬阻断特性。重要的是,光治疗显著增强了PPBC LNPs的抗癌作用。在T24细胞中,光处理组的IC₅₀值为0.28 μM,比非光处理组(2.1 μM)低七倍。此外,PPBC LNPs的细胞毒性遵循光剂量依赖性趋势。值得注意的是,PPBC LNPs对正常细胞的毒性较低(IMR-90),IC₅₀约为25μM。众所周知,PDT依赖于产生ROS,特别是1O₂,以诱导癌症细胞死亡。为了检测细胞内ROS水平,使用2’,7′-二氯荧光素二乙酸酯(DCF-DA)作为指示剂。如图3c所示,在PPBC LNPs介导的光疗后,ROS水平显著升高,而与对照组相比,单独使用PPBC LNPs治疗的变化很小。鉴于线粒体是细胞中ROS的主要来源,还测量了线粒体ROS(MitoROS)水平。与总体ROS产生一致,在光处理组中观察到明显的MitoROS的爆发。PDT诱导的氧化应激会损伤线粒体,导致线粒体功能障碍。线粒体功能障碍的一个标志是线粒体膜去极化,这反映在线粒体膜电位(MMP)的降低或丧失。为了评估MMP,使用四甲基罗丹明乙酯(TMRE),这是一种由于MMP的负电荷而在线粒体中选择性积累的染料。具有高MMP的健康线粒体可以吸引并保留更多的TMRE,从而产生强烈的荧光信号。在所有组中,只有PPBC-LNP加光治疗组显示出可忽略的TMRE信号,这表明膀胱癌症细胞中MMP的损失和线粒体损伤(图3d)。
线粒体是参与介导细胞Ca2⁺稳态的关键细胞器,调节各种细胞信号通路,如代谢、细胞分裂和细胞死亡。Ca2⁺通过MMP驱动的线粒体钙单转运蛋白(MCU)进入线粒体。当MMP受损时,MCU往往会失调,导致不受控制的Ca2⁺内流和过载。由于PPBC LNPs介导的光疗导致MMP去极化,随后使用Fluo-4 AM测量细胞内Ca2⁺水平,使用Rhod-2 AM检测线粒体Ca2⁺水平。如图3e、f所示,与对照组相比,光照的PPBC LNPs组中细胞质和线粒体中Ca2⁺超载,而仅PPBC LNP组没有引起Ca2⁺内流的显著变化。这些发现与之前的结果一致,其中PPBC LNPs加上光表现出增强的线粒体损伤,而单独使用PPBC LNP对线粒体的影响有限。
为了进一步了解PPBC LNPs介导的细胞毒性,评估了凋亡指标、caspase-3/7活性。在光处理组和非光处理组中,观察到caspase -3/7活性的剂量依赖性增加,光处理显著引发了T24细胞中caspase -3/7活性的激增(图3g)。为了进一步证实PPBC LNPs介导的光疗诱导的细胞凋亡,采用了Annexin V/Zombie Red(ZR)染色。流式细胞术分析显示,即使在0.2 μM的低浓度下,在两种膀胱癌症细胞系中,与所有其他组相比,PPBC-LNP结合光诱导的细胞凋亡水平最高(图3h)。
随后,进一步评估了下游凋亡标志物聚ADP核糖聚合酶(PARP)、半胱氨酸天冬氨酸蛋白酶-3的底物和DNA损伤标志物组蛋白H2A.X。蛋白质印迹分析显示,切割的PARP和组蛋白H2A水平显著增加,呈剂量依赖性。X在PPBC LNPs介导的光疗后,证实了细胞凋亡和广泛的DNA损伤的诱导(图3i,j)。这些发现进一步证实了PPBC-LNP介导的光疗法对膀胱癌症细胞的凋亡诱导作用。综上所述, PPBC LNPs介导的光疗导致线粒体功能障碍,并进一步诱导膀胱癌中胱天蛋白酶3/7依赖性凋亡,导致细胞死亡。
图3. 在光照或不光照的情况下暴露于PPBC LNPs的(a)T24和(b)UPPL膀胱癌症细胞的生存曲线(n = 3). (c)不同处理组的细胞中ROS和MitoROS产生的流式细胞术分析。(d)以TMRE为指标的MMP分析;细胞核用Hoechst 33342染色;比例尺:20 μm。暴露于PPBC LNPs(有或没有光照)的T24细胞的(e)细胞内和(f)线粒体中钙(Ca2⁺)的内流。(g)经PPBC LNPs(0.5 μM)介导的光疗后,T24细胞中caspase -3/7活性增加。(h)不同处理组的膀胱癌症细胞的凋亡测定(0.2 μM)。用PPBC LNPs加光照的(i)T24和(j)UPPL细胞中凋亡和DNA损伤相关蛋白(PARP、切割的PARP、组蛋白H2A.X)的免疫印迹。L:在光照下,30 mW cm⁻2(633 nm LED阵列)持续30秒。
IV 癌症异种移植模型中的双PA和NIR-FL成像
接下来,在携带原位膀胱肿瘤的小鼠中研究了PPBC LNPs的PA和FL成像能力。首先,在尾静脉注射PPBC LNPs(10 mg kg⁻1)前后进行US/PA成像。US/PA成像在这种原位模型中特别有利,因为超声提供了详细的解剖背景,而PA成像检测来自造影剂PPBC LNP的信号。此外,通过扫过近红外波长,这种方法可以同时检测来自PPBC LNPs的PA信号和来自血红蛋白的内源性信号,区分其氧化和脱氧状态。通过光谱分解PPBC LNPs、脱氧血红蛋白和氧合血红蛋白的不同PA信号模式,监测了纳米粒子的积累,并评估了TME内的关键功能标志物,如氧饱和度。随着时间的推移使用相同的小鼠(图4a)在US成像提供的解剖背景下得到。注射前的US/PA图像有助于从B型超声和脱氧血红蛋白和氧合血红蛋白中识别膀胱区域内的肿瘤肿块,但图像中没有PPBC LNP信号。尾静脉注射PPBC LNPs后,监测到信号逐渐增加,持续24 h,然后在48 h时信号减弱,表明PPBC LNP在肿瘤块内动态积聚(图4b)。值得注意的是,通过US/PA成像观察到,激光治疗后血液信号(脱氧血红蛋白和氧合血红蛋白)发生了显著变化。具体而言,脱氧血红蛋白信号在PPBC LNPs积聚的区域大幅增加,表明有效PDT的氧气消耗主要来自血液(图4c)。此外,定量测量表明,注射PPBC LNP后,总血红蛋白水平基本保持不变(图4e),但光治疗显著降低了总氧饱和度(图4d)。这进一步表明,ROS的产生主要是通过消耗血红蛋白中的氧气,而不是通过肿瘤微环境中总血红蛋白含量的变化。这种实时、无创的功能性超声/PA成像技术的应用增强了我们对缺氧和代谢因素在推动肿瘤进展和调节治疗反应中的作用的理解。
同时,使用Lago X成像系统通过FL成像监测PPBC LNPs的生物分布,通过荧光素酶转染的T24细胞的生物发光追踪肿瘤。如图4f,g所示,FL成像显示PPBC LNPs在注射后24 h在肿瘤部位出现峰值积聚,这与PA成像结果一致。值得注意的是,FL信号持续长达6天,表明FL成像的高灵敏度。同时表明PPBC LNPs在肿瘤中的保留时间延长。这种延长的保留尤为重要,因为它表明通过自噬抑制具有持续治疗作用的潜力。此外,当与激光治疗相结合时,光疗的延长注射后窗口为治疗计划提供了更大的灵活性,可能会提高患者的依从性和便利性。主要器官和肿瘤的体外FL成像显示,静脉注射24 h后,PPBC LNPs在肿瘤中大量积聚,与其他报道的基于PPA的NP相比,肿瘤积聚增强。在肺、肝和肾中也检测到明显的信号,这可能是由于PPBC LNPs的尺寸约为100 nm,分别可能促进卟啉衍生物的肺积聚和肾清除模式。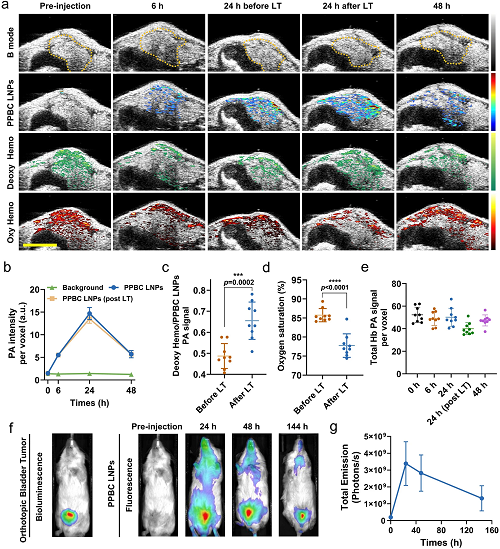
图4. (a)不同时间点监测PPBC LNPs、脱氧血红蛋白和氧合血红蛋白的体内PA信号模式(n = 3); 比例尺:5 mm。LT:激光治疗。(b)来自肿瘤内PPBC LNPs的PA信号的定量分析,如图所示(黄色虚线圆圈)。a图中LT前后24 h肿瘤内的(c)脱氧血红蛋白信号和(d)氧饱和度的定量分析。LT:激光治疗。(e)a图中肿瘤内总血红蛋白PA信号的定量分析。(f)不同时间点(n=3)小鼠体内PPBC LNPs(静脉注射10 mg kg⁻1)原位T24肿瘤的生物发光和的荧光生物分布图像。(g)f图中肿瘤部位荧光信号的定量分析。
V 光疗效果的体内评估
为了评估肿瘤部位的光敏效应,首先分析了PPBC LNPs介导的光疗产生的ROS和热量。基于荧光成像的定量分析显示,肿瘤中的ROS水平显著升高(图5b)。此外,PPBC LNPs表现出强烈的光热效应,显著提高了肿瘤部位的温度(图5c)。这些结果表明,PPBC LNPs在体内光疗方面具有巨大的潜力。
接下来,评估了PPBC LNPs介导的光疗的抗肿瘤疗效。携带皮下膀胱肿瘤的小鼠在第1天和第8天接受PPBC LNPs(静脉注射10 mg kg⁻1)。根据PA和FL成像结果,PPBC LNPs在注射后24 h在肿瘤部位显示峰值积聚。因此,每次给药后24 h,肿瘤暴露于激光照射(680 nm,0.6 W cm⁻2)3 min(图5a)。如图5d、e所示,与对照组相比,用PPBC LNPs和激光治疗的膀胱肿瘤的生长受到显著抑制,五分之三的肿瘤在两个治疗周期后完全消融,这表明PPBC LNPs介导的光疗具有强效作用。此外,治疗显示出良好的安全性,整个治疗期间体重稳定就是证明(图5f)。为了进一步研究组织水平的变化,在治疗结束时收集了肿瘤,并分析了特定蛋白质的表达。如图5g所示,与对照组相比,用PPBC LNPs和激光治疗的肿瘤显示出明显的组织损伤(H&E),Ki-67(细胞增殖标志物)表达降低,切割的半胱氨酸天冬氨酸蛋白酶-3(凋亡标志物)、LC3B和p62水平(自噬抑制标志物)升高,表明肿瘤部位的增殖减少,凋亡和自噬抑制增强。主要器官的组织病理学评估显示没有异常,进一步证实了治疗的生物相容性。这些结果表明,PPBC LNPs可以通过抑制自噬和诱导凋亡来有效抑制甚至消融肿瘤,突出了它们在体内强大的自噬抑制和光疗作用。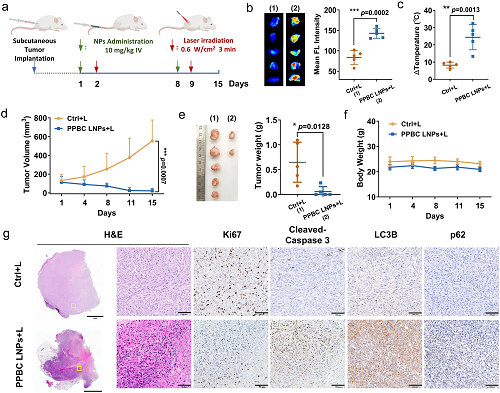
图5. (a)皮下膀胱肿瘤(UPPL)模型的治疗时间表。在第1天和第8天注射PPBC LNPs(静脉注射10 mg kg⁻1)。然后在每次注射后24 h用激光(680 nm,0.6 W cm⁻2,3 min)治疗肿瘤(n = 5). (b)使用DCF-DA作为ROS指示剂,在光照后对肿瘤部位的ROS产生进行体外成像和定量分析(n = 5). (c)激光照射下PPBC LNPs在肿瘤部位的光热效应(n = 5)。 (d)治疗期间肿瘤体积变化(n = 5)。 (e)治疗结束时的肿瘤重量。(f)治疗期间体重变化。(g)皮下肿瘤组织的H&E染色和IHC-Ki67、切割的caspase-3、LC3B和p62染色,H&E:苏木精和曙红;IHC:免疫组织化学,比例尺:2mm(4×);0.1毫米(20×)。
为了更好地评估PPBC-LNP对膀胱癌症的治疗效果,使用原位膀胱癌症小鼠模型,用400微米光纤照射整个膀胱(图6a)。与图5中的数据一致,PPBC可以在原位膀胱癌症部位特异性积累,并观察到PPBC-LNP介导的光疗法显著增加ROS的产生(图6b)。将患有原位膀胱肿瘤的小鼠分为两组,用或不用PPBC LNPs(静脉注射10 mg kg⁻1)治疗,然后在给药后24 h进行激光治疗。在第5天,通过测量萤光素酶活性来监测肿瘤生长。生物发光成像显示,对照组的肿瘤信号急剧增加,表明原位膀胱肿瘤呈侵袭性生长(图6c)。相比之下,用PPBC LNPs加激光治疗的组显示出显著降低的生物发光信号(图6d)。值得注意的是,一只小鼠的肿瘤信号完全缺失,表明治疗后肿瘤完全消融。与异种移植物模型相似,组织学检查显示原位膀胱癌明显坏死和碎裂。IHC分析证实,PPBC LNP介导的光处理导致膀胱肿瘤组织中细胞增殖减少(Ki67减少)、凋亡增加(切割的胱天蛋白酶3增加)和自噬抑制(LC3b和p62增加)(图6e)。主要器官无明显毒性(图S14)。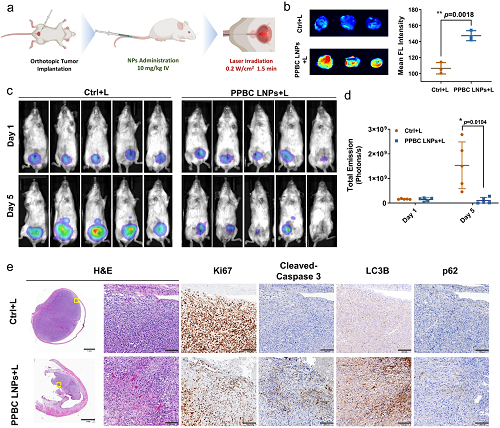
图6. (a)原位膀胱肿瘤(T24)模型的治疗图示。第1天静脉注射PPBC LNPs(10 mg kg⁻1)。然后在注射后24和48 h用激光(680 nm,0.2 W cm⁻2,1.5 min)治疗肿瘤。(b)在光照后(注射后24 h),使用DCF-DA作为ROS指示剂对肿瘤部位的ROS产生进行体外成像和定量分析(n = 3)。用或不用PPBC LNPs治疗24 h,然后进行激光治疗的小鼠肿瘤区域的(c)代表性生物发光图像和(d)定量数据(n = 5)。(e)原位肿瘤组织的H&E染色和IHC-Ki67、切割的caspase-3、LC3B和p62染色,H&e:苏木精和曙红;IHC:免疫组织化学,比例尺:1mm(4×);0.1毫米(20×)。
VI 总结
PPBC LNP作为一种自给自足的纳米平台的独特设计,具有强大的光疗效果、自噬抑制特性和双模态成像能力,为癌症膀胱治疗带来了巨大的前景。其生产的可扩展性及其多功能治疗和成像能力支持了其临床开发的潜力,值得在更大的动物模型中进一步研究,这是我们即将进行的研究的一部分,并最终转化为人类患者。
作者简介

关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 JCR IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 加州大学戴维斯分校Yuanpei Li等:多功能可量产纳米颗粒用于膀胱癌双模态光疗
 Nano-Micro Letters
Nano-Micro Letters 韩国延世大学Yong Min Lee等:规整微孔结构促进SiOₓ/人工石墨复合电极中高效锂离子传输
韩国延世大学Yong Min Lee等:规整微孔结构促进SiOₓ/人工石墨复合电极中高效锂离子传输 拜年了!Nano-Micro Letters祝您马年新春快乐!
拜年了!Nano-Micro Letters祝您马年新春快乐! 南科大曾林/韩美胜等综述:水凝胶电解质赋能锌离子电池的新进展
南科大曾林/韩美胜等综述:水凝胶电解质赋能锌离子电池的新进展 韩国忠南大学Sangbaek Park等:核壳MOF限域锂离子溶剂化构筑高温长效锂金属电池
韩国忠南大学Sangbaek Park等:核壳MOF限域锂离子溶剂化构筑高温长效锂金属电池