研究背景
随着抗生素的滥用,细菌耐药性(特别是耐甲氧西林金黄色葡萄球菌,MRSA)已演变为全球性的公共卫生危机。细菌为了在抗生素压力下生存,往往会启动复杂的补偿性突变机制,通过改变代谢途径或重塑细胞壁来抵消药物影响,这使得传统治疗日益艰难。纳米酶作为一种新兴的抗菌策略,虽能通过产生活性氧(ROS)造成细菌氧化损伤,但单一的杀菌模式容易诱发细菌的适应性抵抗,且受限于细菌内部高表达的抗氧化系统(如GSH)。因此,开发一种能够突破细菌抗氧化防线、有效杀死细菌机制(如类铜死亡),并能从根源上切断细菌耐药补偿通路的综合治疗策略,是当前抗菌研究的重要方向。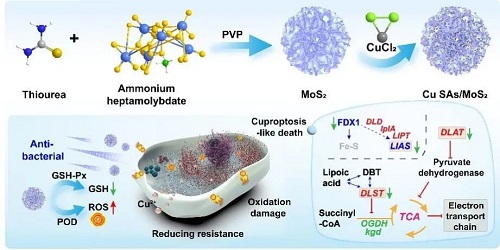
Copper Single‑Atoms Loaded on Molybdenum Disulphide Drive Bacterial Cuproptosis‑Like Death and Interrupt Drug‑Resistance Compensation Pathways
Wenqi Wang, Xiaolong Wei, Bolong Xu, Hengshuo Gui, Yan Yan*, Huiyu Liu*, Xianwen Wang*
Nano-Micro Letters (2026)18: 111
https://doi.org/10.1007/s40820-025-01955-2
本文亮点
1. 双酶活性级联增强:Cu SAs/MoS₂通过原子级工程调控,实现了POD-like与GPX-like活性的协同倍增,诱发高通量ROS产生,精准实施细菌内部的氧化打击。
2. 膜屏障突防与类铜死亡增效:激发的“ROS风暴”导致细菌膜通透性发生不可逆改变,协同促进Cu²⁺的跨膜转运与胞内累积,通过正反馈回路显著增强细菌类铜死亡效能。
3. 多靶点代谢重编程与耐药敏化:该纳米系统通过双重抑制能量代谢与细胞壁(肽聚糖)合成,以此瘫痪细菌的生存适应机制,有效克服细菌的耐药性。
内容简介
安徽医科大学王咸文教授团队与北京化工大学刘惠玉教授和安徽工业大学闫岩教授合作,报道了一种通过溶液浸渍法合成的铜单原子负载二硫化钼纳米酶(Cu SAs/MoS₂)。该研究提出了一种基于类铜死亡的抗耐药菌策略:首先,利用原子级分散的Cu位点显著增强过氧化物酶(POD)和谷胱甘肽过氧化物酶(GSH-Px)活性,引发细菌胞内“ROS风暴”并耗竭抗氧化剂GSH;其次,ROS诱导的膜通透性增加促进了Cu²⁺的大量内流,触发细菌类铜死亡,导致代谢核心蛋白寡聚化失活;最关键的是,该纳米酶能特异性下调细胞壁合成前体的生物合成,直接阻断了耐药菌的细胞壁重塑补偿通路。这种多机制协同作用不仅高效杀灭了MRSA,且在连续21代的传代实验中未诱发细菌耐药性,并在烧伤感染模型中展现出卓越的促愈合能力。
图文导读
I 单原子结构构建与催化机理溯源
为了构建高效的催化中心,研究人员首先通过水热法合成了花状MoS₂纳米片,随后利用溶液浸渍法将铜源引入,成功制备了Cu SAs/MoS₂纳米酶。球差校正扫描透射电子显微镜(AC-HAADF-STEM)清晰地展示了铜以孤立原子的形式均匀分布在MoS₂载体上,且未出现金属团聚现象。进一步的X射线吸收精细结构(XAFS)光谱分析证实,Cu原子呈现出独特的Cu-S₃配位结构。这种原子级别的精细调控为后续的高效催化奠定了结构基础。
在催化机理层面,密度泛函理论(DFT)计算揭示了Cu单原子掺杂的独特优势。计算结果表明,Cu位点的引入优化了材料表面的电子结构,显著增强了对底物H₂O₂的吸附能力(吸附能降低至-0.67 eV)。更为关键的是,Cu掺杂将催化反应决速步(即·OH的解吸过程)的活化能降低了17%。这一理论预测与实验结果高度吻合:Cu SAs/MoS₂表现出卓越的类POD活性和类GSH-Px活性,不仅能高效催化H₂O₂产生羟基自由基(•OH),还能快速消耗细菌体内的谷胱甘肽(GSH),从而打破细菌的氧化还原稳态,为后续的杀菌过程扫清障碍。
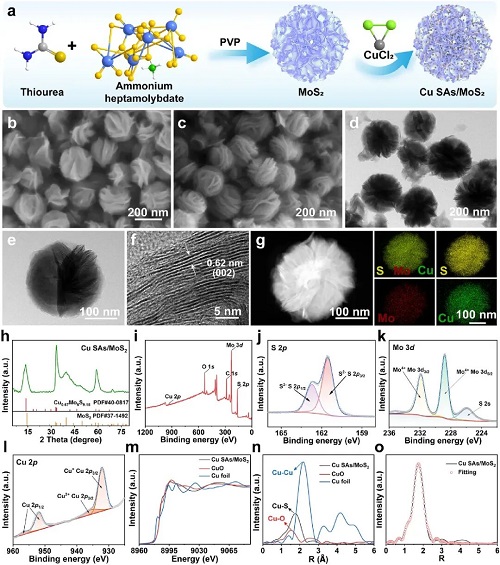
图1. Cu SAs/MoS₂的表征。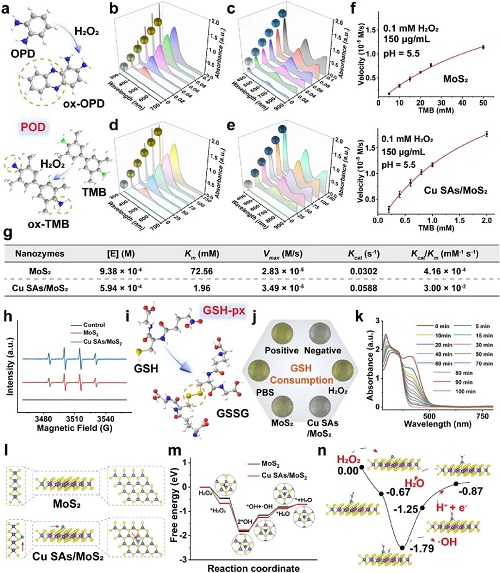
图2. Cu SAs/MoS₂的酶样活性及密度泛函理论计算。
II ROS风暴驱动的“类铜死亡”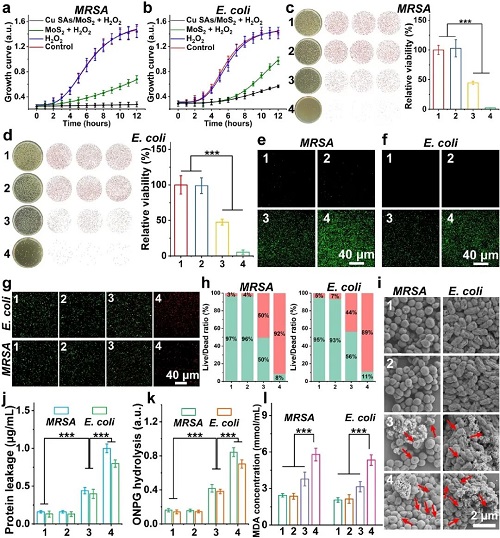
图3. Cu SAs/MoS₂的体外抗菌能力。
本研究深入剖析了Cu SAs/MoS₂的独特的杀菌机制,发现其并非简单的氧化损伤,而是由ROS辅助触发的“类铜死亡”。转录组学和代谢组学联合分析显示,纳米酶产生的高浓度ROS首先破坏了细菌细胞膜的通透性,充当了“开路先锋”,导致大量Cu²⁺涌入胞内。这些过载的Cu²⁺成为了致命毒素,它们特异性地结合TCA循环中的硫辛酰化蛋白(如DLAT、DLST、LIAS),诱导这些关键代谢酶发生异常寡聚化并导致其表达下调。同时,铜离子还破坏了铁硫簇蛋白(FDX1)的稳定性,阻断了电子传递链。这种由氧化损伤和蛋白质毒性应激共同驱动的程序性死亡模式共同诱导细菌死亡。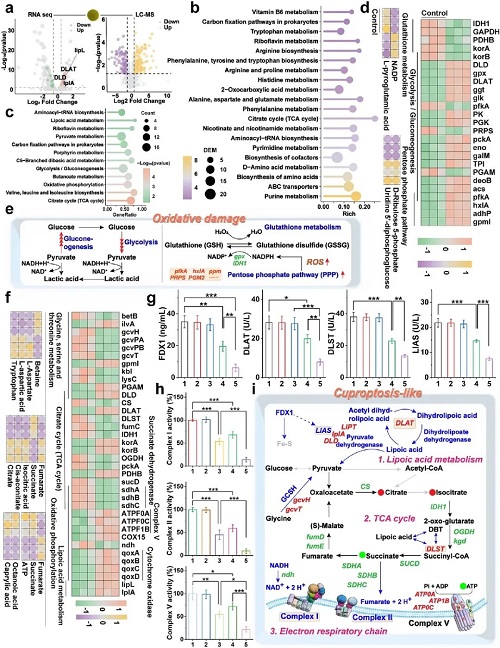
图4. Cu SAs/MoS₂诱导耐药细菌的氧化损伤与类铜死亡。
III 阻断补偿通路:根源上遏制耐药性进化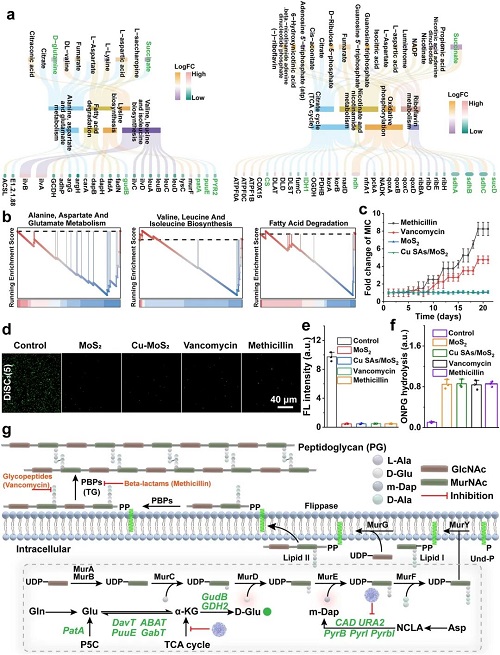
图5. Cu SAs/MoS₂抑制细菌产生耐药性的机制研究。
针对细菌容易产生耐药性的痛点,研究团队发现Cu SAs/MoS₂具有阻断细菌“耐药补偿通路”的特殊能力。细菌在遭受外界压力时,通常会通过代谢补偿来重塑细胞壁以维持生存。然而,多组学分析表明,该纳米酶显著下调了丙氨酸、天冬氨酸和谷氨酸代谢通路中关键基因(如GudB、GDH₂)的表达,直接导致肽聚糖合成的关键前体——D-谷氨酸(D-Glu)和m-二氨基庚二酸(m-DAP)的生物合成受阻。这使得细菌无法通过细胞壁重塑来产生耐药性。实验证实,即使在连续21代的药物压力下,MRSA也无法对Cu SAs/MoS₂产生耐药性,而对照组的万古霉素耐药性则提高了8倍。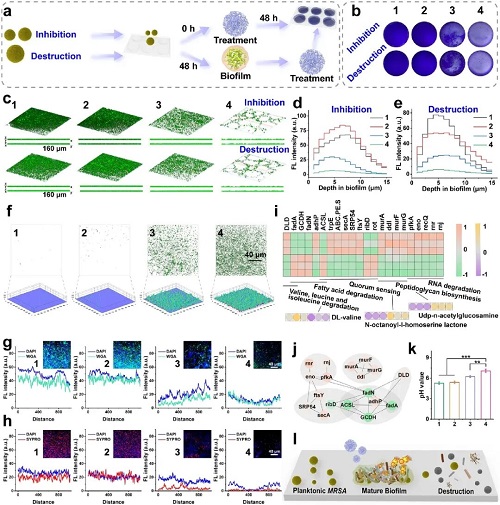
图6. 体外抗生物膜能力。
IV 抗生物膜与免疫调节促进伤口愈合
在创面感染应用潜力评估中,Cu SAs/MoS₂展现出强大的抗生物膜与促愈合性能。体外实验显示,它能有效渗透并破坏成熟的MRSA生物膜,通过下调群体感应(Quorum Sensing)相关基因(如trpE, secA),瓦解细菌间的通讯网络。在小鼠MRSA感染烧伤模型中,该治疗策略不仅高效清除了深层组织感染,还通过改变免疫微环境,使巨噬细胞从促炎的M1型向修复型的M2型极化。这显著降低了炎症因子(IL-6, iNOS)水平,同时上调了血管内皮生长因子(VEGF)和胶原蛋白的表达,加速了血管新生和上皮再形成,最终实现了高质量的皮肤组织修复。此外,该材料在体内表现出优异的生物安全性,未引起铜离子蓄积或脏器损伤。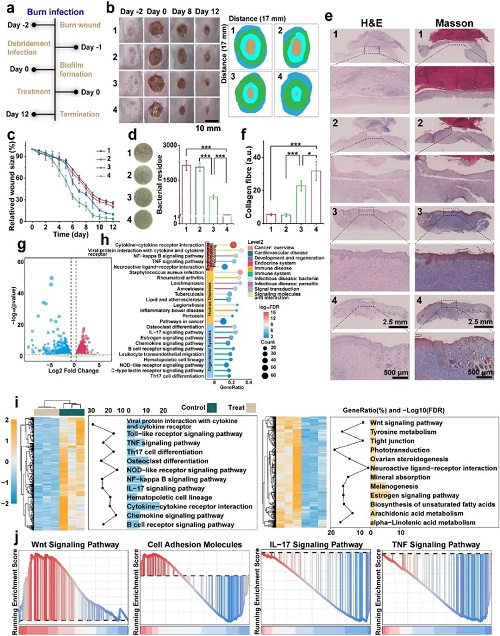
图7. Cu SAs/MoS₂在体内展现抗菌功效并改善伤口愈合效果。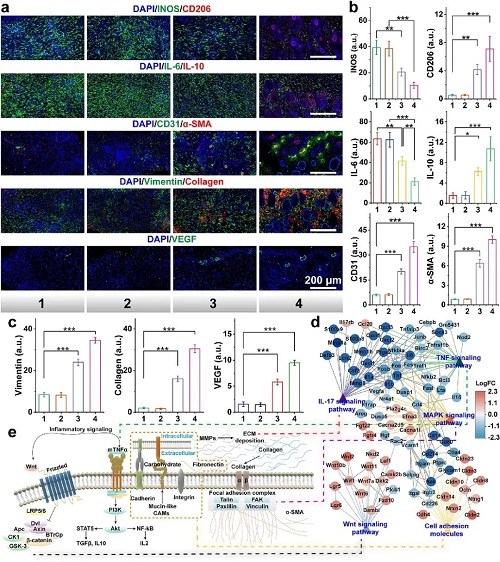
图8. Cu SAs/MoS₂促进伤口愈合的研究。
V 总结
这项工作巧妙地设计了一种多功能的铜单原子/二硫化钼纳米酶,为解决日益严峻的耐药菌感染问题提供了全新的视角。研究人员不仅仅利用了纳米酶的催化产ROS能力,更深入挖掘了铜在诱导细菌“类铜死亡”中的独特生物学效应。该研究的核心突破在于揭示了“氧化损伤-铜离子内流-类铜死亡”这一级联杀菌机制,并证实了该材料能够通过抑制细胞壁合成前体的代谢,精准切断细菌的耐药补偿通路。这种“多管齐下”的策略,既克服了单一疗法效率低的缺陷,又从根本上遏制了耐药性的进化。结合其在破坏生物膜和免疫调节促愈合方面的优异表现,Cu SAs/MoS₂作为一种极具临床转化潜力的纳米药物,为治疗难治性细菌感染创面提供了强有力的理论支持和技术方案。
作者简介



关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化
 Nano-Micro Letters
Nano-Micro Letters 浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池
浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池 江南大学刘天西、王子成等:阻抗/隔热双梯度结构聚酰亚胺纤维构筑及其多频谱兼容隐身
江南大学刘天西、王子成等:阻抗/隔热双梯度结构聚酰亚胺纤维构筑及其多频谱兼容隐身 哈工大周伟等综述:脉冲动态电解水助力传质增强、微环境调控与制氢优化
哈工大周伟等综述:脉冲动态电解水助力传质增强、微环境调控与制氢优化 天津大学姜忠义/张润楠&新加坡国立大学张岁等: “门-通道”结构COF支架膜用于高效锂镁分离
天津大学姜忠义/张润楠&新加坡国立大学张岁等: “门-通道”结构COF支架膜用于高效锂镁分离