研究背景
近期肿瘤免疫治疗的进展正在改变肿瘤学领域,其通过激活持久的全身免疫反应来消除恶性肿瘤并抑制转移。然而,免疫抑制性的肿瘤微环境(TME)降低了肿瘤的免疫原性,导致治疗响应率不理想并削弱了疗效。最新研究表明,铁死亡这种受调控的细胞死亡机制有望作为增强肿瘤免疫原性、激活抗肿瘤免疫并选择性清除恶性细胞的策略。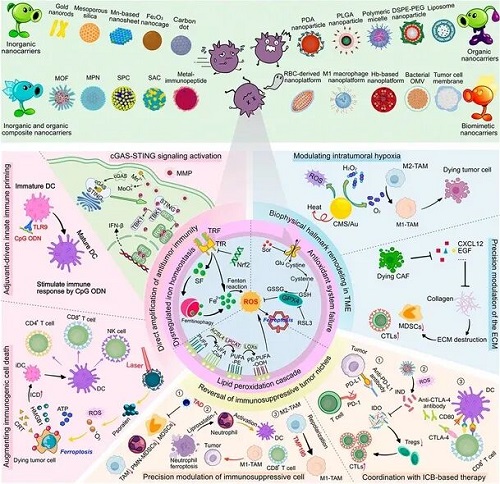
Synergistic Ferroptosis–Immunotherapy Nanoplatforms: Multidimensional Engineering for Tumor Microenvironment Remodeling and Therapeutic Optimization
Xiao Wei*, Yanqiu Jiang, Feiyang Chenwu, Zhi Li, Jie Wan, Zhengxi Li, Lele Zhang, Jing Wang, Mingzhu Song*
Nano-Micro Letters (2026)18: 56
https://doi.org/10.1007/s40820-025-01862-6
本文亮点
1. 首次系统整合:本研究首次全面概述了纳米颗粒介导的铁死亡–免疫治疗策略在抗肿瘤中的协同潜力,突破了以往仅关注铁死亡诱导或单一纳米治疗手段的研究局限。
2. 多维纳米平台设计:建立了功能化纳米平台的先进设计原则,包括合理的材料选择、结构构型、理化调控、多功能整合及人工智能辅助设计,以克服肿瘤微环境屏障并优化铁死亡–免疫治疗的疗效。
3. 转化关注与人工智能整合:对铁死亡–免疫治疗纳米平台在临床前及临床开发中的转化障碍进行了深入分析,提出可行解决方案,同时开创性地将人工智能整合到未来纳米平台设计和肿瘤免疫治疗方向中。
内容简介
新兴的铁死亡–免疫治疗策略通过将功能化纳米平台与铁死亡诱导剂及免疫调节治疗手段相结合,在管理原发性、复发性及转移性肿瘤方面展现出显著潜力。从机制上看,铁死亡诱导不仅能够直接消灭肿瘤细胞,还能促进免疫原性细胞死亡(ICD),引发损伤相关分子模式(DAMPs)释放,从而激活部分抗肿瘤免疫。然而,单独的铁死亡治疗由于肿瘤固有免疫原性低、免疫抑制性微环境限制以及肿瘤微环境(TME)相关的生理屏障(如缺氧、致密细胞外基质)等内在限制,无法启动强有力的系统性抗肿瘤免疫反应。为应对这些挑战,已经开发出协同策略以增强免疫细胞浸润并重建免疫监视,包括:(1) 直接增强抗肿瘤免疫;(2) 破坏免疫抑制性肿瘤微环境;(3) 重塑TME的生物物理特征。合理的纳米载体设计已成为克服生物传递屏障、优化治疗疗效的关键工具。与以往仅针对铁死亡或纳米技术的肿瘤治疗研究不同,成都大学魏枭、宋明珠等人首次系统阐述了纳米颗粒在铁死亡–免疫治疗联合策略中的协同潜力。研究提出了多维纳米平台设计原则,包括材料选择、结构构型、理化调控、多功能整合以及人工智能辅助设计,为疗效优化提供科学依据。此外,还分析了铁死亡–免疫治疗纳米平台在临床前和临床阶段的转化挑战,提出可操作的解决方案,并展望了未来肿瘤免疫治疗的发展方向。总体而言,本研究为先进纳米材料设计原则与治疗优化策略提供了系统性见解,为加速肿瘤免疫治疗的临床转化提供了路线图。
图文导读
I 铁死亡–免疫治疗纳米载体的精密设计:多维度视角
当前铁死亡–免疫治疗的进展集中在构建具有精确靶向性和可调药物释放特性的功能化纳米平台。优化抗癌纳米治疗的关键考虑因素包括:(1) 根据个体化治疗需求定制纳米载体类型和组分;(2) 战略性调控理化参数(粒径、表面电荷、形态、两亲性)以控制稳定性、体内分布和细胞摄取;(3) 在统一系统中整合多功能,包括肿瘤靶向配体、微环境响应型释放机制和成像模态(如 MRI/荧光);(4) 人工智能辅助的智能设计,包括辅助纳米材料筛选、预测体内过程和评估纳米颗粒疗效。本节系统讨论了纳米载体的结构工程(如纳米载体分类及其优势/局限)和功能协同如何增强铁死亡诱导、分子成像精度、主动靶向效率及刺激响应行为。通过建立这些设计框架,旨在加速临床可转化的铁死亡–免疫治疗纳米药物的合理开发。
II 纳米策略驱动的铁死亡–免疫治疗协同调控机制
铁死亡–免疫治疗联合策略在肿瘤治疗中表现出协同效应,不仅可消除原发病灶,还能激活系统性免疫以抑制转移和复发。本节从纳米生物医学视角分析增强抗肿瘤免疫的关键策略,包括:(1)直接免疫激活;(2)免疫抑制性肿瘤微环境逆转;(3)肿瘤微环境关键物理特性重塑。
2.1 抗肿瘤免疫的直接增强
2.1.1 增强免疫原性细胞死亡
当前的化疗通过采用细胞毒性试剂来靶向增殖过程,其机制包括DNA片段化、细胞骨架抑制以及ATP合成阻断。蒽环类和DNA损伤剂已知可触发ICD,其特征为CRT外翻和HMGB1释放,从而促进DC成熟及后续T细胞激活。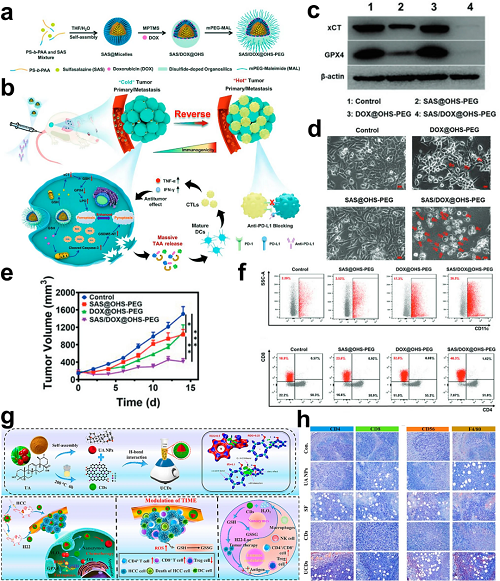
图1. a SAS/DOX@OHS-PEG纳米调控剂的合成过程。b SAS/DOX@OHS-PEG纳米调控剂通过诱导铁死亡–焦亡来增强“冷”肿瘤免疫治疗并抑制肺转移的示意图。c 4T1细胞处理后的xCT和GPX4表达的Western blot分析。d 4T1细胞在不同处理后的形貌变化(比例尺:50 μm),显示具有典型的大泡性细胞肿胀(红色箭头)。e 不同处理组的肿瘤生长动力学。f 流式细胞术分析肿瘤中CD11c⁺ DC浸润以及脾脏CD3⁺ T细胞中的CD4⁺/CD8⁺ T细胞群体。g UCDs的设计及其增强肿瘤富集、诱导铁死亡及实现联合治疗的功能特性。h H22肿瘤中CD4⁺、CD8⁺、CD56⁺和F4/80⁺细胞的免疫组织化学分析。
放射治疗通过电离辐射诱导的生物大分子损伤和氧化应激升高来施加局部细胞毒性作用。新兴证据表明其能够诱导ICD,并有潜力重塑免疫抑制性的TME,从而实现全身性抗肿瘤免疫或与免疫治疗产生协同作用。将铁死亡诱导与放射治疗整合于纳米治疗系统中可放大ICD介导的免疫激活。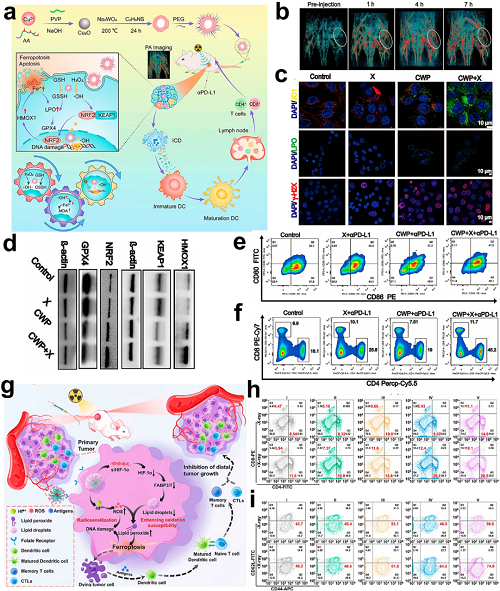
图2. a CWP的合成及其作用机制:多功能CWP介导的增敏通过PA成像引导的放射-免疫治疗增强乳腺癌治疗效果。b CWP注射(20 mg/kg)后肿瘤负荷裸鼠的体内光声成像。c CWP ± X射线处理4T1细胞的荧光成像:线粒体损伤(JC-1)、脂质过氧化(LPO)以及DNA损伤(γ-H2AX),并通过DAPI共染进行可视化。d 4T1细胞在不同处理条件下KEAP1、NRF2、HMOX1和GPX4表达的Western blot分析。e 淋巴结中DC成熟(CD80⁺/CD86⁺)的流式细胞术评估。f 脾脏T细胞亚群的流式细胞术分析:CTLs(CD3⁺CD4⁻CD8⁺)和辅助性T细胞(CD3⁺CD4⁺CD8⁻)。g TCPP@Hf-TK-PEG-PAMAM-FA@siHIF-1α纳米组装体的设计及其低剂量放射激活的铁死亡–免疫治疗机制。h CD4⁺/CD8⁺ T细胞浸润及i 远处肿瘤中CD8a⁺CD44⁺CD62L⁻效应记忆T细胞的定量流式细胞术分析。
SDT通过在富氧环境中经由声敏剂活化并在超声触发下产生ROS来诱导癌细胞死亡。先前研究表明SDT具有同时促进ICD和激活抗肿瘤免疫的双重能力。基于这些发现,构建了一种由H₂O₂和超声驱动的介孔锰基纳米马达(CSID@NMs),其利用TME中过量的H₂O₂通过Mn2⁺介导的类Fenton反应进行反应。该过程同时产生用于CDT的·OH以及用于增强SDT效能的氧气,从而形成协同的铁死亡诱导机制。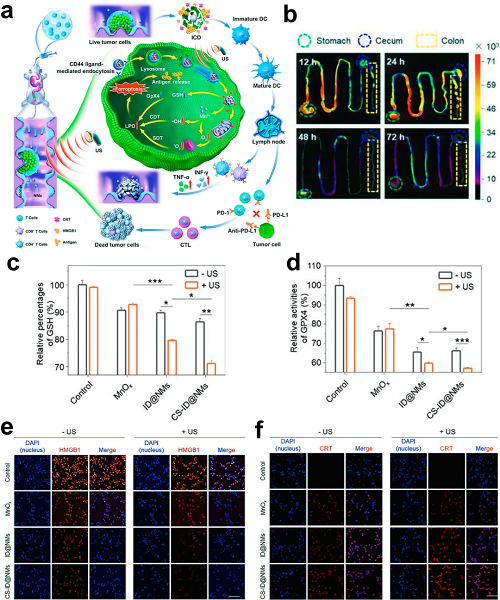
图3. a CS-ID@NMs多功能纳米马达的示意图,展示其黏液穿透、深部肿瘤靶向、抗肿瘤效应及免疫激活能力。b 给药后12–72 h胃肠道(GITs)的离体荧光成像。c 不同处理组细胞内GSH含量定量分析。d 不同处理条件下肿瘤细胞中GPX4活性水平。e HMGB1释放和f 细胞表面CRT外翻的CLSM图像(比例尺:100 μm)。
PTT利用近红外激光诱导的热效应,通过吸光材料消融肿瘤。PTT引起的快速坏死产生TAAs,并通过ICD激活和DAMPs释放增强DC成熟。PDT作为另一种光学疗法,利用可见光下的光敏剂将氧转化为细胞毒性ROS,同时诱导肿瘤ICD。将PTT和PDT整合于统一的纳米治疗平台显示出对ICD诱导的协同增强作用。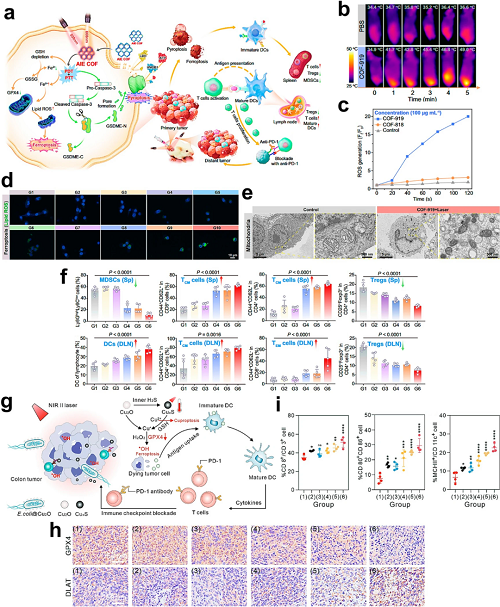
图4. a 在COFs中整合平面/扭曲基元以实现焦亡–铁死亡启动的癌症免疫治疗。b 对照组与COF-919在不同照射后时间点的体内热成像。c 细胞内ROS生成分析。d 使用BODIPY581/591-C11探针(绿色)对4T1细胞脂质过氧化的共聚焦成像。e 正常细胞与COF-919处理细胞的线粒体超微结构生物TEM观察。f 定量免疫细胞分析:DLNs中的DCs;脾脏/DLNs中的TCM/TEM细胞;脾脏中的Tregs和MDSCs。g E. coli@Cu₂O纳米杂化体的设计,用于TME可激活的NIR-II PTT增强铁死亡/铜死亡免疫治疗。h 处理肿瘤中GPX4和DLAT表达的免疫组织化学检测。i 肿瘤引流淋巴结中脾脏CTLs(CD3⁺CD8⁺CD4⁻)、DC成熟(CD11c⁺CD80⁺CD86⁺)及活化DCs(CD11c⁺MHCII⁺)的比较分析。
此外,Ji等构建了一种肿瘤细胞膜包覆的Cu-MOF纳米颗粒(M/A@MOF@CM),共负载米托蒽醌(MTO)和阿昔替尼(AXB),用于协同化疗、PTT和CDT。该多模态平台通过全方位肿瘤靶向同时触发铜死亡、铁死亡和凋亡,促进DAMPs释放和ICD诱导,同时通过抑制VEGF通路抑制Tregs和MDSCs,有效清除原发/继发4T1肿瘤及肺转移。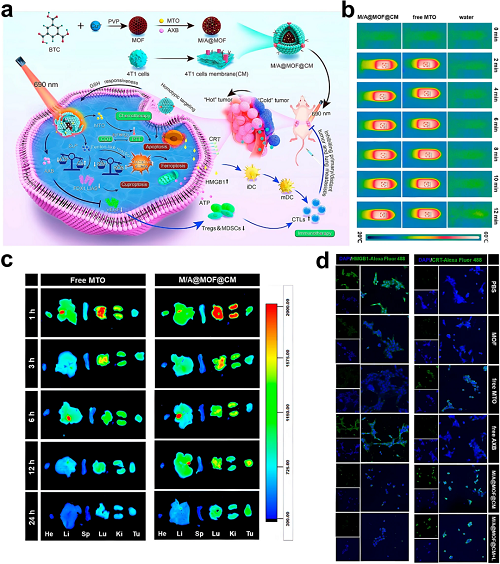
图5. a M/A@MOF@CM纳米平台的合成方案及其在小鼠癌症模型中的治疗机制。b 水、游离MTO和M/A@MOF@CM在0.82 W cm⁻2照射12分钟下的热成像对比。c 静脉注射游离MTO与M/A@MOF@CM后肿瘤/器官的离体荧光追踪。d HMGB1易位及CRT外翻的共聚焦显微成像可视化。
Sal通过协调上调铁调节蛋白2(IRP2)和TfR1,同时下调铁蛋白,增强细胞内铁水平,从而促进铁死亡。该机制性协同使Sal与其他铁死亡诱导剂联合治疗成为增强铁死亡细胞死亡的策略。丁酸结合的PLGA纳米颗粒BU-NP@Sor/Sal通过双重机制体现了这一策略:索拉非尼(Sor)诱导system Xc⁻抑制和GSH耗竭,而Sal提升细胞内铁水平,形成协同的铁死亡–ICD轴,从而增强抗肿瘤免疫并抑制远处肿瘤生长。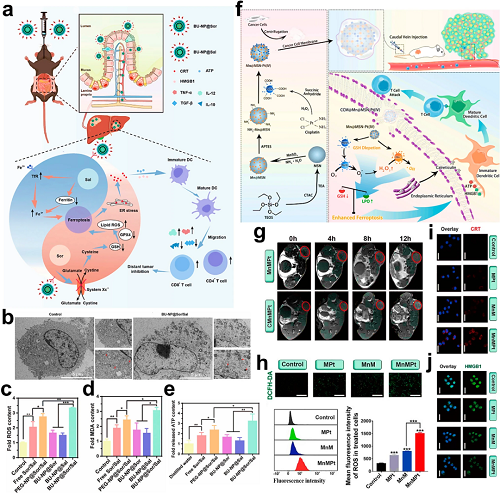
图6. a M/A@MOF@CM纳米平台的合成方案及其在小鼠癌症模型中的治疗机制。b 水、游离MTO和M/A@MOF@CM在0.82 W cm⁻2照射12分钟下的热成像对比。c 静脉注射游离MTO与M/A@MOF@CM后肿瘤/器官的离体荧光追踪。d HMGB1易位及CRT外翻的共聚焦显微成像可视化。
PTT诱导的高温可增强Fenton反应动力学以提升ROS生成,同时加速GSH耗竭,从而削弱LPO清除并协同促进铁死亡和ICD。基于这一机制,先前研究开发了一种没食子酸-阿司匹林-Fe(II)配位聚合物纳米纤维(GAFs),其中PTT介导的温度升高放大了铁死亡信号以激活抗肿瘤免疫。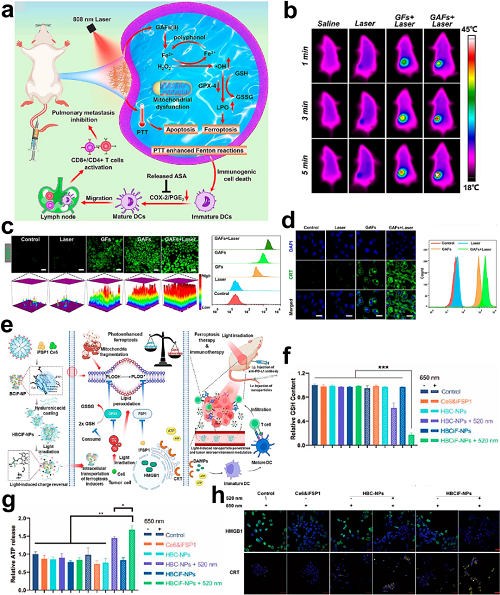
图7. a GAFs通过抑制COX-2/PGE2轴实现PTT增强铁死亡–免疫治疗的机制(808 nm照射下)。b 各处理组小鼠肿瘤在5分钟照射期间的实时光热成像。c 处理细胞中ROS生成的共聚焦显微及三维强度图。d 4T1细胞在GAFs ± 激光处理下的CRT表面外翻,共聚焦成像及流式细胞术分析。e 协同策略:通过HBCiF-NPs电荷反转诱导光活化铁死亡并结合PD-L1阻断;PDT诱导的GPX4抑制/ROS积累与iFSP1增强的脂质过氧化协同作用,驱动ICD介导的抗肿瘤免疫。f 不同治疗方案下A549细胞内GSH水平。g 不同处理组的细胞外ATP水平。h 处理后A549细胞中HMGB1由核向胞质的转位及CRT表面表达的共聚焦成像。
鉴于铁蛋白作为主要铁储存蛋白的作用,有针对性地诱导铁蛋白自噬(选择性铁蛋白自噬)可释放Fe2⁺库以增强肿瘤铁死亡。基于这一机制,构建了带聚乙烯吡咯烷酮(PVP)表面修饰的四足尖刺FePd纳米结构(TFP)。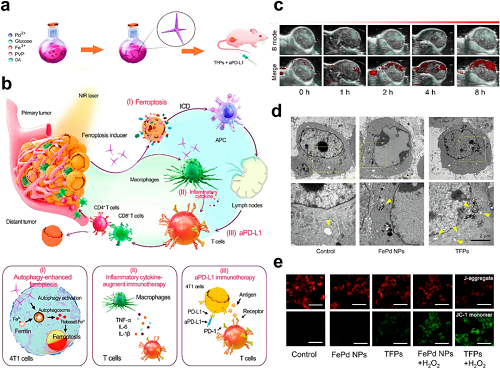
图8. a TFPs的合成方案。b 设计原理:尖刺纳米结构赋能TFPs以协同增强铁死亡–免疫治疗。c TFP注射后0–8 h 4T1肿瘤的体内PA成像。d 处理后4T1细胞的生物TEM观察,显示自噬体/自噬溶酶体(黄色箭头)。e 通过JC-1染色(CLSM)评估4T1细胞的线粒体去极化。
2.1.2 cGAS–STING信号通路激活
cGAS–STING信号轴在胞质DNA监测中起关键作用。当环鸟苷酸-腺苷酸合酶(cGAS)检测到异常的双链DNA(dsDNA)时,会催化环鸟苷酸-腺苷酸(cGAMP)的合成。该二级信使与干扰素基因刺激因子(STING)二聚体结合,引起构象变化,从而促进Tank结合激酶1(TBK1)的募集及随后的干扰素调节因子3(IRF3)磷酸化,最终驱动IFN-β的产生。该级联反应启动关键免疫应答,包括DC成熟、CD8⁺ T细胞/NK细胞激活及IFN-γ上调。铁死亡通过双重机制促进该通路:线粒体损伤释放mtDNA,同时细胞碎片提供胞质dsDNA片段,共同激活cGAS–STING信号。
金属离子通过不同机制调控该通路。Mn2⁺通过提高DNA结合敏感性并稳定cGAS–DNA复合物增强cGAS酶活,即使在亚最优DNA浓度下也能促进cGAMP生成。此外,Mn2⁺增强cGAMP与STING的结合亲和力,放大下游信号。Liang等构建了一种多功能纳米平台(HBMn-FA),将Hemin、BSO和Mn2⁺整合于FA修饰的PLGA聚合物中。该设计实现了双重激活:(1)BSO/Hemin诱导的铁死亡产生线粒体ROS,导致mtDNA释放,并与Mn2⁺协同启动cGAS–STING信号;(2)铁死亡碎片来源的dsDNA激活DC中的cGAS–STING通路,促进抗原呈递。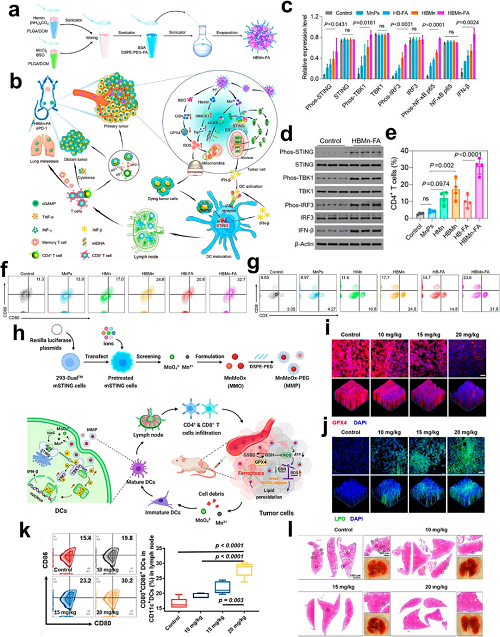
图9. a TFPs的合成方案。b 设计原理:尖刺纳米结构赋能TFPs以协同增强铁死亡–免疫治疗。c TFP注射后0–8 h 4T1肿瘤的体内PA成像。d 处理后4T1细胞的生物TEM观察,显示自噬体/自噬溶酶体(黄色箭头)。e 通过JC-1染色(CLSM)评估4T1细胞的线粒体去极化。
与金属离子介导的STING激活相比,通过诱导核或线粒体DNA释放的小分子有机药物已成为cGAS–STING通路的替代激活剂。例如,Guo等开发了表面包覆没食子酸(TA)并复合Fe2⁺和SN38(7-乙基-10-羟基喜树碱)的Fe₃O₄/Gd₂O₃杂化纳米颗粒。该系统利用SN38刺激含DNA外泌体的胞吐,同时Fe2⁺介导的LPO积累诱导质膜破裂,从而协同增强外泌体释放并促进DNA片段向DC传递以激活STING通路。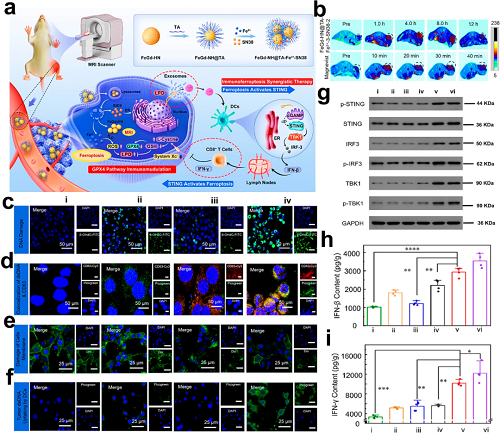
图10. a FeGd-HN@TA-Fe2⁺-SN38的合成及通过GPX4/STING双通路交叉作用实现免疫铁死亡治疗的机制。b BALB/c小鼠4T1肿瘤在注射FeGd-HN@TA-Fe2⁺-SN38(Fe/Gd剂量:5 mg/kg)与Magnevist®(Gd剂量:5 mg/kg)后的T1加权MRI成像。c 处理4T1细胞的共聚焦成像:(i)–(iv)DNA损伤(8OHdG,绿色)/核共染(DAPI,蓝色);d 外泌体标志CD63(红色)/核酸染色(PicoGreen,绿色);e 质膜完整性(DiO,绿色)。f 用(i)–(iv)处理细胞的条件培养基培养骨髓来源DCs(BMDCs)(DAPI核染色)。g 各组(i)–(vi)肿瘤中cGAS–STING通路蛋白(p-STING、TBK1、IRF3)的Western blot分析。h 各组(i)–(vi)肿瘤组织中IFN-β的ELISA定量。i 各组(i)–(vi)肿瘤组织中IFN-γ的ELISA定量。
2.1.3 佐剂驱动的先天免疫激活
作为疫苗的重要组成部分,免疫佐剂通过多重机制放大免疫反应的强度、广度和持久性。这些机制包括DC激活、补体系统参与以及细胞因子/趋化因子调控,共同改善癌症治疗的疗效。近期进展显示,将免疫佐剂(如TLR激动剂、铝基佐剂)与纳米递送平台整合,可在铁死亡介导的免疫治疗中提升APC效率。这种协同作用加速了T细胞驱动的抗肿瘤免疫并建立持久的免疫记忆。
值得注意的是,CpG ODNs——合成的TLR9激动剂——可诱导DC成熟,上调MHC-II表达,并刺激Th1极化及促炎细胞因子产生。基于此,Gao等使用DAPC脂质构建脂质体以包封CpG ODNs。肿瘤相关ROS触发DAPC脂质过氧化,同时诱导铁死亡并释放CpG ODNs。这种双重作用增强了DC成熟及CD8⁺ T细胞效应功能,形成自我增强的适应性免疫循环。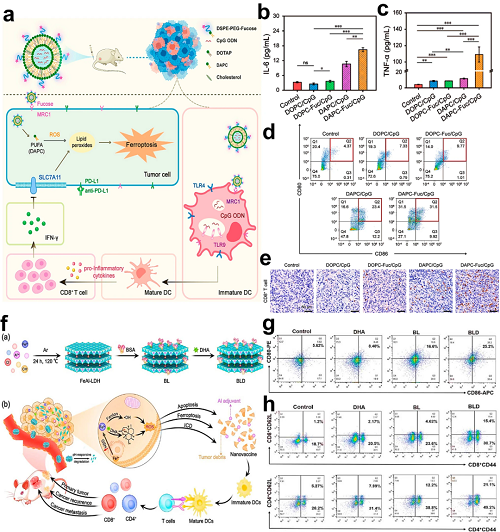
图11. a 靶向脂质体平台示意图,实现协同铁死亡–免疫治疗。b 治疗后血清IL-6定量。c 治疗后血清TNF-α定量。d 脾脏DC成熟分析(CD80⁺/CD86⁺比值)。e 治疗1天后肿瘤中CD8⁺ T细胞浸润(IHC成像)。f BLD构建体的合成及TME响应下Fe3⁺/Al3⁺/DHA释放机制。g 淋巴结中DC成熟(CD11c⁺CD80⁺/CD86⁺)的流式细胞术分析。h 脾脏CD8⁺/CD4⁺群体中记忆T细胞亚群(CD44⁺CD62L±)。
将铝基佐剂与CpG ODNs策略性组合,可通过提高抗原呈递效率和放大抗肿瘤免疫,实现免疫激活的协同增强。为体现这一模式,Shi等开发了包封CpG ODNs的铝磷酸盐纳米载体,并在表面包覆铁-紫草酮金属-酚网络(Alum-CpG@FeShikonin NPs),构建原位个性化纳米疫苗。肿瘤细胞内吞后,Fe-紫草酮壳解离生成Fe2⁺和紫草酮,共同诱导铁死亡和坏死性凋亡驱动的ICD。在此过程中释放的肿瘤来源抗原被铝纳米颗粒捕获,并与CpG ODNs共同递送至专业APC,启动多阶段抗肿瘤免疫级联反应。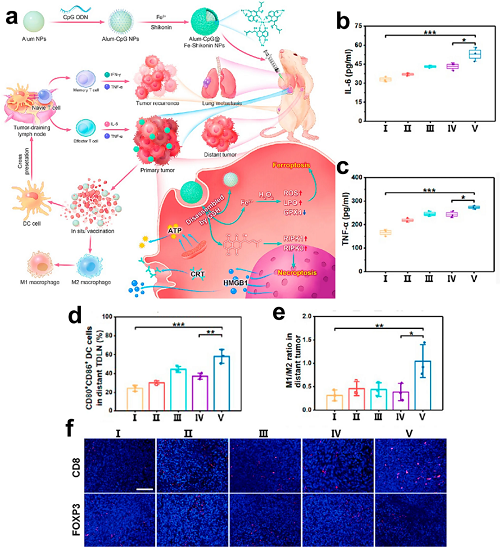
图12. a 通过自体肿瘤裂解物联合佐剂递送,共同诱导免疫原性铁死亡/坏死性凋亡的组合免疫治疗。b 各处理组4T1肿瘤小鼠血清IL-6水平(平均值 ± SD,n = 3)。c 各处理组血清TNF-α水平(平均值 ± SD,n = 3)。d 肿瘤引流淋巴结(TDLNs)中成熟DCs(CD11c⁺CD80⁺CD86⁺)的流式细胞术定量(n = 3)。e 远处肿瘤中M1/M2巨噬细胞极化比值(F4/80⁺CD206⁻CD86⁺/F4/80⁺CD206⁺CD86⁻)(n = 3)。f 远处肿瘤中CD3⁺CD8⁺ T细胞及Tregs(Foxp3⁺)的免疫组化染色。
2.2 破坏免疫抑制性肿瘤微环境
2.2.1 与ICB基础治疗的协同
免疫检查点通过配体–受体相互作用向免疫效应细胞传递抑制信号,从而抑制抗肿瘤免疫。虽然该机制可维持自身耐受性并防止自身免疫性组织损伤,但恶性细胞利用这些通路逃避T细胞介导的免疫监视。针对CTLA-4、PD-1或PD-L1的免疫检查点阻断(ICB)疗法通过破坏抑制性信号轴抵消这一免疫抑制,从而恢复T细胞功能并增强系统性抗肿瘤反应。铁死亡诱导与ICB的联合显示出通过互补机制的治疗协同作用。铁死亡通过促进免疫细胞浸润并将免疫惰性(“冷”)肿瘤转化为反应性(“热”)微环境,从而提升肿瘤免疫原性并改善ICB疗效。反之,ICB通过抑制免疫抑制网络并建立免疫记忆,弥补铁死亡的局限性,降低转移潜力并防止复发。
PD-1/PD-L1免疫检查点轴中,PD-1在肿瘤浸润免疫细胞上表达,PD-L1在肿瘤细胞上表达,通过促进肿瘤免疫逃逸在抑制适应性抗肿瘤免疫中起关键作用。当前治疗策略将PD-1/PD-L1抗体与铁死亡诱导剂联合使用,以同时阻断该免疫抑制通路并增强抗肿瘤免疫反应。除了传统抗体,最新研究还强调了PD-L1拮抗肽、核酸、酶以及小分子药物作为免疫检查点抑制剂的潜力。
近期进展包括一种铁死亡纳米平台(DPPA-RRPNP@Fe₂O₃),通过将阻断PD-L1的D肽(DPPA-1)静电吸附于DMSA@Fe₂O₃纳米颗粒上构建。该系统通过铁死亡与ICB联合协同诱导ICD及T细胞活化,实现更优的肿瘤免疫治疗效果。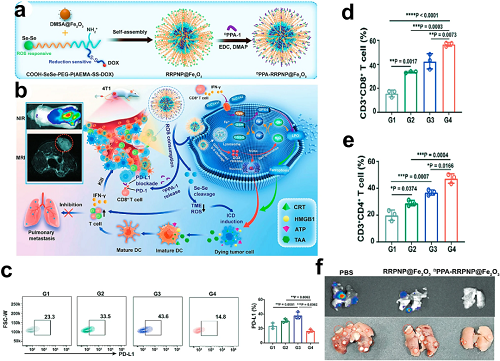
图13. a DPPA-RRPNP@Fe₂O₃的合成。b DPPA-RRPNP@Fe₂O₃协同ROS清除、免疫检查点阻断及化疗-铁死亡介导的抗肿瘤免疫。c 各处理组肿瘤细胞PD-L1表达的流式细胞术分析(平均值 ± SD,n = 3)。d 肿瘤浸润CD3⁺CD8⁺ T细胞定量。e 肿瘤浸润CD3⁺CD4⁺ T细胞定量。f 第31天通过荧光素酶生物发光成像检测肺转移。
平行研究探索了PD-L1 DNA适配体(Apt-PD-L1)以利用其高特异性和组织穿透能力。Zhang等将Apt-PD-L1与诱导铁死亡的纳米反应器结合,以放大TAA释放并增强免疫浸润。另一种方法将抗PD-L1脱氧核糖核酶(DZ)装载于Mn2⁺/Fe3⁺杂化金属-酚网络(DZ@TFM)中,有效沉默PD-L1并诱导铁死亡–免疫治疗。DZ@TFM处理显著下调PD-L1表达,并通过铁死亡与PTT的协同作用增强DC成熟。值得注意的是,若干有机小分子显示出对PD-1/PD-L1通路的有效阻断作用。一个代表性例子是构建半导体聚合物基金属–酚网络(PFG MPNs),其中共同包封了铁死亡诱导剂Fe3⁺和外泌体抑制剂GW4869。该PTT活性平台靶向PD-L1外泌体分泌,从而逆转DC成熟抑制和T细胞功能障碍,同时将PTT与铁死亡诱导的ICD协同作用,增强抗肿瘤免疫。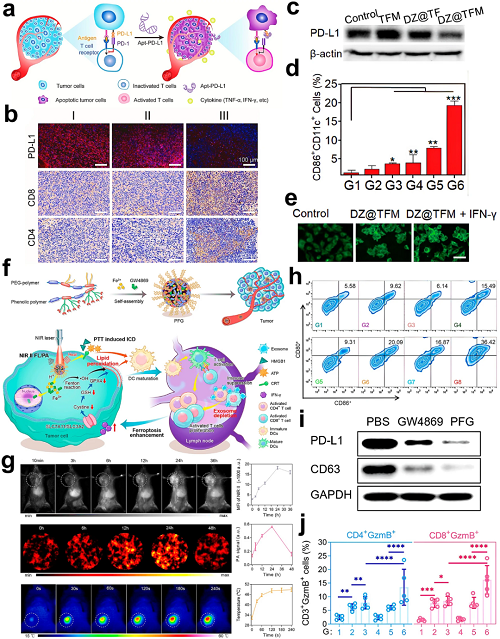
图14. a Apt-PD-L1介导的免疫检查点阻断机制。b 肿瘤切片中PD-L1的免疫荧光染色及CD4⁺/CD8⁺ T细胞浸润的免疫组化分析。c B16F10黑色素瘤细胞中PD-L1表达的Western blot分析。d 肿瘤引流淋巴结中DC成熟(CD80⁺/CD86⁺)的定量评估。e IFN-γ预处理后LPO水平的荧光成像。f PFG MPNs设计:光热成像/治疗介导的外泌体免疫抑制缓解、铁死亡增强及免疫激活。g PFG MPNs在肿瘤中的体内NIR-II荧光成像、PA成像及热成像。h 肿瘤引流淋巴结(TDLNs)中成熟DCs(CD11c⁺CD80⁺CD86⁺)的流式细胞术分析。i 肿瘤来源外泌体中特异性PD-L1和CD63的Western blot检测。j 肿瘤引流淋巴结中GzmB⁺CD4⁺/CD8⁺ T细胞(CD3⁺门控)的流式细胞术分析。
T细胞上的CD28与DC上的B7分子相互作用,提供T细胞活化的关键共刺激信号。然而,T细胞上表达的CTLA-4通过其对B7的结合亲和力高于CD28,从而竞争性抑制该过程,抑制T细胞活化并作为免疫检查点。为抵消这一免疫抑制机制,抗CTLA-4抗体被用于阻断抑制信号并增强T细胞活化,为改善铁死亡介导的免疫治疗提供协同策略。在近期研究中,抗CTLA-4抗体被整合到多功能纳米颗粒(FeCO-IR820@FeIIITA)中,该纳米颗粒由没食子酸、CO前药(FeCOPBA)、Fe3⁺离子及光敏剂IR820组成。在近红外(NIR)照射下,FeCO-IR820@FeIIITA组显示最强的绿色荧光,表明CO释放、IR820光热效应及Fe3⁺介导铁死亡共同驱动了强烈的ROS生成。
NLG919作为直接的IDO酶抑制剂,与索拉非尼共同负载于铁蛋白修饰的聚合物载体上,形成纳米治疗平台,可诱导依赖铁蛋白自噬的铁死亡。该策略促进DC成熟,增强肿瘤浸润T细胞群体并提升细胞因子分泌,有效重编程免疫抑制性TME。相比之下,吲哚昔莫(IND)通过调控犬尿氨酸(Kyn)代谢抑制IDO通路。Huang等通过Fe3⁺与酚基螯合及多巴胺聚合开发了多功能纳米平台(FIP),该系统可自驱动释放IND,同时放大氧化应激,协同增强铁死亡与光热IDO免疫治疗。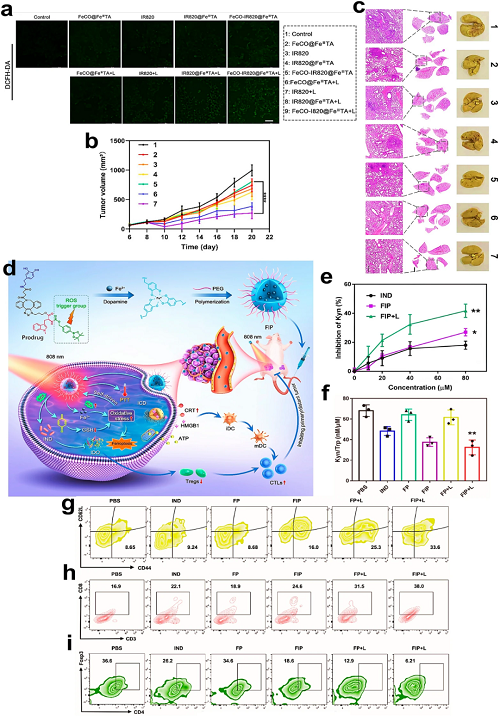
图15. a 各处理组细胞内ROS水平的共聚焦显微成像(使用DCFH-DA探针)。b 4T1肿瘤小鼠的肿瘤生长动力学,每2天监测一次,共14天。c 七个实验组的肺脏大体形态及H&E染色切片。d FIP纳米系统设计,实现铁死亡、光热治疗及免疫激活的组合治疗。e 处理后4T1细胞的犬尿氨酸(Kyn)抑制率。f 通过ELISA定量Kyn/Trp比值。g 治疗后脾脏记忆T细胞(CD44⁺CD62L⁺)的流式细胞术分析。h 肿瘤浸润CD8⁺ T细胞的流式细胞术定量。i 肿瘤浸润Tregs(CD4⁺Foxp3⁺)的流式细胞术定量。
近期研究报道了一种创新的自放大铁死亡诱导金属有机框架(Fe3⁺-H₂BDC MOF),可协同启动铁死亡与ICD。该双重作用系统在释放“寻找我”信号(如ATP)和“吞噬我”信号(如CRT)的同时,联合应用抗CD47抗体以中和免疫抑制信号,有效重编程TME。体外验证中,使用荧光素酶标记的4T1小鼠乳腺癌细胞,经抗CD47处理后生物发光显著下降(p < 0.01),证实巨噬细胞吞噬能力增强。为优化治疗递送,研究人员构建了一种新型纳米平台,将高亲和力CD47抑制肽PEP20与MMP-2响应连接子整合在一起。该结构被接枝于M1巨噬细胞膜包覆的纳米颗粒上,同时负载Ce6和没食子酸(MP@CH/BSA NPs),形成一个多模态系统,可同时实现巨噬细胞活化和T细胞刺激。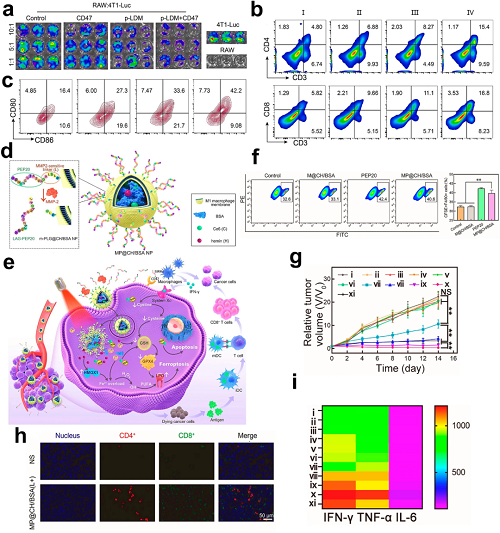
图16. a 各处理组中RAW264.7巨噬细胞介导的4T1-Luc细胞吞噬的共聚焦显微成像。b 肿瘤浸润CD3⁺CD4⁺辅助T细胞(Ths)及淋巴结中CD11c⁺CD80⁺CD86⁺成熟DCs的流式细胞术分析。c 肿瘤浸润CTLs(CD3⁺CD8⁺)的流式细胞术定量。d, e MMP-2响应的MP@CH/BSA NPs设计及体内肿瘤靶向机制。f 处理后FITC⁺PE⁺ BMDM/4T1共培养体系的流式细胞术定量。g 不同治疗方案下4T1肿瘤生长曲线。h 肿瘤切片中CD4⁺(红)与CD8⁺(绿)T细胞的免疫荧光共定位。i 治疗后4T1肿瘤小鼠血清细胞因子谱(IFN-γ/TNF-α/IL-6)热图。
B7-H3(CD276)是一种跨膜蛋白,于2001年被鉴定为B7超家族成员,在多种恶性肿瘤中表现出肿瘤特异性高表达,而在正常组织中表达极低。该免疫调节分子可抑制T细胞活化。与传统单克隆抗体不同,双特异性抗体(BiAbs)通过工程化构建将两个不同的单链可变片段结合在一起。值得注意的是,双特异性T细胞接合器可同时与T细胞上的CD3ε及肿瘤相关抗原(TAA)结合,促进效应T细胞与肿瘤细胞之间免疫突触的形成,从而触发T细胞活化、炎症性细胞因子释放及随后的肿瘤细胞裂解。基于这一机制,Fan等开发了MMP-2响应纳米颗粒(S-biAb/dEGCG@NPs),整合抗B7-H3 × CD3双特异性抗体(BiAbs)、表没食子儿茶素没食子酸二聚体(dEGCG)及透明质酸-PLGLAG-dEGCG共轭物,以增强胶质母细胞瘤中的免疫耐受逆转和铁死亡。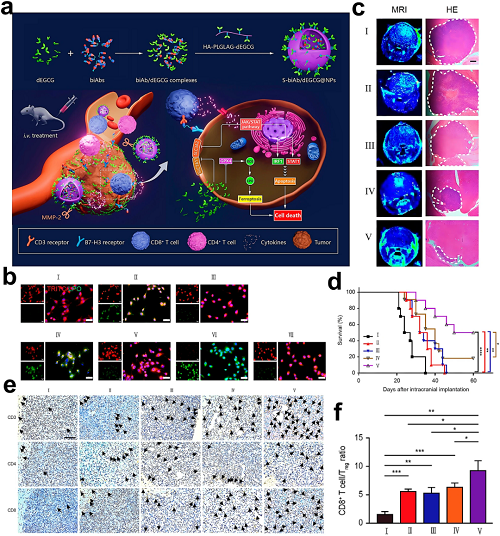
图17. a S-biAb/dEGCG@NP介导的铁死亡增强型胶质母细胞瘤(GBM)免疫治疗示意图。b 各处理组U87细胞脂质过氧化水平的共聚焦成像(C11-BODIPY染色)。c 治疗后第35天原位GBM模型的MRI及H&E染色脑切片。d GBM小鼠生存曲线(n = 8)。e 脑内浸润CD3⁺/CD4⁺/CD8⁺ T细胞的流式细胞术定量。f 肿瘤浸润淋巴细胞(TILs)中CD8⁺ T细胞/Treg比例的流式细胞术分析。
2.2.2 免疫抑制性细胞群的精准调控
免疫抑制性细胞通过抑制过度免疫活化来维持免疫稳态,从而防止自身免疫疾病。然而,肿瘤相关免疫抑制性群体,包括肿瘤相关巨噬细胞(TAMs)、调节性T细胞(Tregs)、髓系来源抑制细胞(MDSCs)及肿瘤相关中性粒细胞(TANs),反而通过细胞因子介导的信号促进肿瘤进展,包括转移、血管生成及免疫逃逸。因此,针对这些免疫抑制性细胞群进行治疗性调控,以克服肿瘤免疫耐受,是增强基于铁死亡免疫治疗疗效的有前景策略。
在TME中,TAMs主要表现为促进肿瘤发生的M2极化表型。这些细胞通过多种机制增强免疫逃逸:(1)表达免疫检查点配体(如PD-L1);(2)分泌抗炎细胞因子(IL-10);(3)通过VEGF介导血管生成。将M2 TAMs重编程为具有肿瘤杀伤功能的M1巨噬细胞成为对抗免疫抑制并增强铁死亡-免疫治疗的潜在策略。值得注意的是,铁负荷已被证明可通过激活干扰素调节因子5通路并抑制精氨酸酶-1诱导M1极化,从而改变M1/M2平衡。基于这一铁介导的极化机制,He等设计了一种半导体聚合物纳米免疫调节剂(SINM),其特征为Fe3⁺螯合支架和PEG化侧链。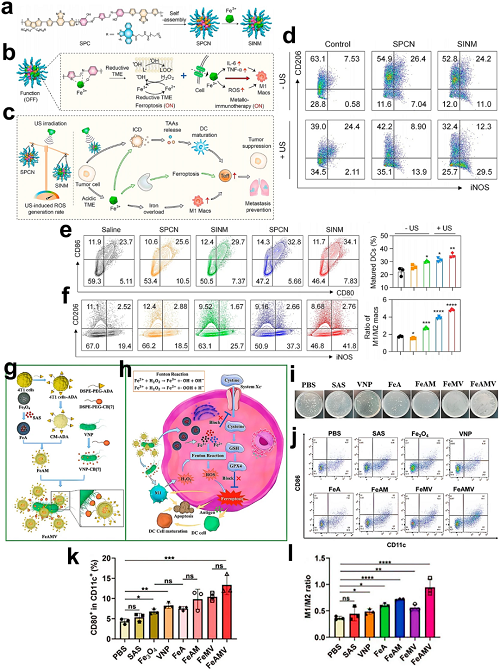
图18. a SINM的合成方案及化学结构。b 铁介导的铁死亡与金属免疫治疗机制在还原性TME中的作用。c 时空可控SINM实现体内精准声-金属免疫治疗。d BMDM在12 h SINM/SPCN孵育+60 s声波处理后的极化分析(M1/M2)。e TAMs(F4/80⁺)中M1(iNOS⁺)/M2(CD206⁺)巨噬细胞比例。f 第10天肿瘤引流淋巴结(TDLNs)中DC成熟度(CD80⁺/CD86⁺)。g Fe3O4@CM-ADA/CB-VNP的主客体共轭合成。h FeAM肿瘤靶向策略,结合铁死亡诱导与抗肿瘤免疫激活。i 各治疗组疗后代表性肿瘤形态。j,k 治疗24 h后肿瘤组织中DC成熟度(CD86⁺/CD11c⁺)定量分析。l 肿瘤组织中M1(CD11c⁺)/M2(CD206⁺)巨噬细胞比例。
M2巨噬细胞独特的代谢特征,尤其是其可诱导一氧化氮合酶(iNOS)/NO•表达较M1低,为治疗提供了机会。在机制上,iNOS催化精氨酸生成NO•,抑制15-脂氧合酶介导的氧化反应,从而限制脂质过氧化物(LPO)积累,使M2巨噬细胞对铁死亡产生耐受性。为了利用这一脆弱性,设计了一种仿生铁死亡诱导剂(D@FMN-M),通过包封DHA和掺铁MSNs,并表面修饰外膜囊泡。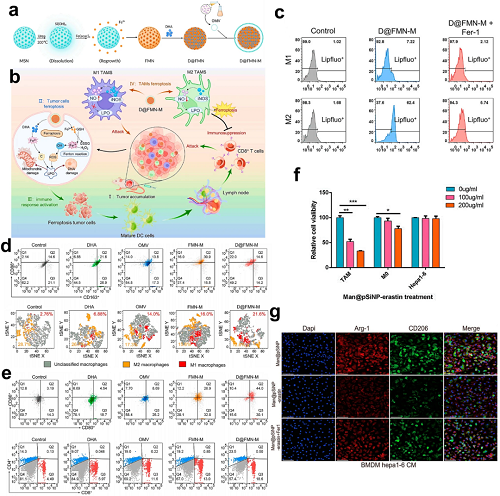
图19. a D@FMN-M组装方案。b D@FMN-M介导的肿瘤细胞/M2-TAMs双重铁死亡诱导增强抗肿瘤免疫。c 各处理组脂质过氧化(Lipfluo⁺)流式细胞术定量。d 巨噬细胞极化分析(M1/M2)及肿瘤中CD163⁺ M2-TAMs的t-SNE映射。e 4T1肿瘤模型中DC成熟度(CD80⁺/CD86⁺)及CD4⁺/CD8⁺ T细胞谱分析。f TAMs/M0巨噬细胞/Hepa1-6细胞在Man@pSiNPs-erastin处理后的细胞活力。g 不同治疗条件下TAM亚群(Arg-1⁺/CD206⁺)浸润免疫荧光染色。
新兴证据表明,肿瘤相关中性粒细胞(TANs)在TME内自发经历铁死亡,其释放的脂质过氧化物(LPO)损伤T细胞功能并促进肿瘤进展。靶向中性粒细胞铁死亡提供了一种缓解肿瘤免疫抑制的潜在治疗策略。在此背景下,研究人员开发了双功能脂质体(LLI),共同负载ICD诱导剂Icy7和铁死亡抑制剂Liproxstatin-1,同时在肿瘤细胞中诱导ICD并抑制中性粒细胞铁死亡,从而重编程免疫抑制性TME并建立持久抗肿瘤免疫记忆。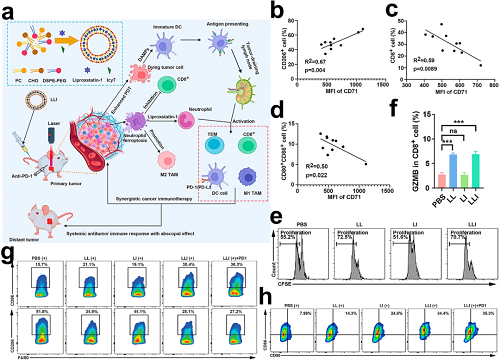
图20. a LLI纳米药物实现免疫原性PDT/中性粒细胞靶向免疫治疗,以增强抗PD-1®疗效并诱导远端免疫。b CD71 MFI与M2-TAM浸润的相关性。c CD8⁺ T细胞丰度。d 肿瘤中DC成熟度。e 与LLI预处理中性粒细胞共培养后,GzmB⁺CD8⁺ T细胞流式细胞术定量。f 与LLI激活中性粒细胞共培养后CD8⁺ T细胞增殖(CFSE稀释)。g 各处理组肿瘤中M1/M2-TAM比例流式细胞术定量。h 肿瘤中DC成熟度(CD80⁺/CD86⁺)流式分析。
2.3 肿瘤微环境的生物物理特征重塑
2.3.1 调控肿瘤内缺氧
缺氧是多种恶性肿瘤TME的典型特征,由血管供氧不足和快速增殖的肿瘤细胞对氧需求增加共同导致。这种缺氧状态激活缺氧诱导因子(HIF)及其下游信号通路,推动肿瘤侵袭性、进展及转移潜能,同时通过多种机制促进免疫逃逸。HIF介导的途径刺激免疫抑制性细胞因子产生,促进TAM向M2型极化并增强MDSC功能。值得注意的是,HIF-1α的稳定化使缺氧肿瘤细胞通过增强脂肪酸代谢和脂质储存抵抗铁死亡,从而减轻过氧化物对细胞膜的损伤。
新兴研究表明,肿瘤来源的外泌体携带的miR-301a可激活TAMs中的PTEN/PI3Kγ信号通路,进一步促使其分化向促肿瘤M2表型。在针对这一机制的治疗策略中,Li等设计了一种多功能纳米粒子系统(Cu2−xSe/ZIF-8@Era-PEGFA),其结构包括硒化铜核、沸石咪唑骨架-8(ZIF-8)壳层以及erastin负载。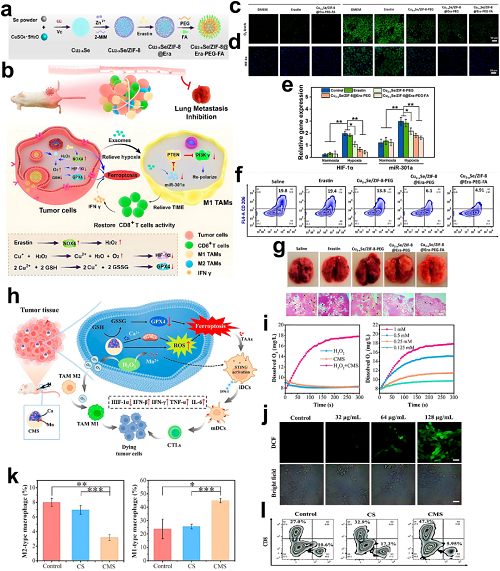
图21. a Cu₂₋ₓSe/ZIF-8@Era-PEG-FA的合成方案。b Cu₂₋ₓSe/ZIF-8@Era-PEG-FA通过将H₂O₂转化为O₂并消耗GSH来驱动铁死亡、重新极化TAMs并激活抗肿瘤免疫。c 各处理组细胞内O₂荧光成像(Ir(III)探针)。d 肿瘤切片中HIF-1α的免疫荧光分析。e 外泌体PD-L1 mRNA水平的qRT-PCR定量。f 肿瘤中M2-TAMs(CD206+)浸润情况。g 4T1肿瘤模型肺转移灶生物发光成像。h CMS纳米平台在触发铁死亡的同时重编程TAMs/DCs以增强抗肿瘤免疫。i H₂O₂/CMS体系中随时间变化的溶解O₂动力学(左);不同H₂O₂浓度下CMS + H₂O₂反应(右)。j CMS处理的4T1细胞中ROS的共聚焦成像(DCFH-DA)。k 肿瘤中M1(iNOS+)/M2(CD206+)巨噬细胞比例的流式细胞术分析。l 肿瘤中CD8+ T细胞浸润分析。
2.3.2 肿瘤细胞外基质的精确调控
失调的ECM作为肿瘤微环境的关键组成部分,在恶性肿瘤中表现出典型的病理性改变。肿瘤相关ECM通过过度胶原交联以及糖蛋白/糖胺聚糖的过度生成而显著致密化。这种结构重塑具有双重致癌效应:增强的基质刚度促进肿瘤侵袭和转移,同时阻碍治疗药物的渗透并限制抗肿瘤免疫细胞的浸润,从而最终降低治疗效果。新兴研究指出,ECM重塑是一个有前景的治疗靶点,尤其考虑到胶原在ECM组成中的主导作用。策略性胶原降解可能抑制转移、改善纳米载体介导的药物递送,并增强免疫效应细胞的浸润,从而增强基于铁死亡的免疫治疗。基于这一原理,研究者开发了T-FeCo/P纳米载体—以特尔米沙坦-PEG2000修饰的Fe/Co双金属MOFs,包载组蛋白去乙酰化酶(HDAC)抑制剂泛比诺司他。这种双靶向系统有效作用于4T1细胞和癌相关成纤维细胞(CAFs),在诱导铁死亡的同时通过胶原降解介导ECM破坏。重塑后的肿瘤微环境增强了CTL浸润和药物渗透,同时调控NF2/Hippo-YAP通路并减少MDSC募集,共同使肿瘤对铁死亡敏感。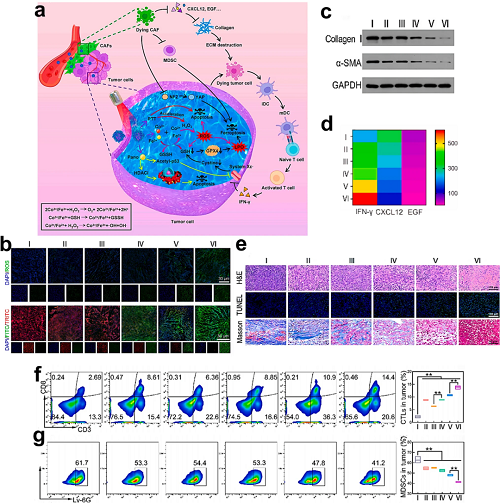
图22. a T-FeCo/P介导的铁死亡激活与ECM重塑协同增强抗肿瘤免疫。b 4T1/CAF肿瘤中不同处理组的ROS(DCFH-DA,绿色)和脂质过氧化(LPO,C11-BODIPY,红色)共聚焦成像。c Western blot分析各处理组ECM标志物(Collagen I/α-SMA)表达。d 4T1/CAF模型中IFN-γ/CXCL12/EGF水平的热图分析(平均值 ± SD,n = 3)。e 肿瘤切片的H&E(坏死)、TUNEL(凋亡)及Masson三色染色(纤维化)(比例尺:50 μm)。f 流式细胞术定量分析肿瘤浸润CTLs(CD3+CD8+)。g 流式细胞术分析MDSCs(CD11b+Ly-6G+)浸润情况。
2.4 铁死亡–免疫治疗中的纳米药物:临床前景
尽管靶向铁死亡–免疫治疗的抗癌药物开发仍需长期探索,但在阐明铁死亡–免疫相互作用机制和纳米药物递送技术方面的关键进展显示出可喜的临床转化潜力。目前,进入临床试验的铁死亡诱导剂仍然有限。例如,Imetelstat 通过调控脂肪酸代谢促进多不饱和脂肪酸磷脂(PUFA-PL)合成,触发脂质过氧化和氧化应激,从而在急性髓系白血病(AML)细胞中诱导铁死亡。在AML患者来源异种移植模型的随机II期试验中,Imetelstat 显著降低白血病负荷并延长生存期。在临床前模型中,GPX4抑制剂 cyst(e)inase 联合免疫治疗可协同增强T细胞介导的抗肿瘤免疫,同时诱导癌细胞铁死亡。此外,零价铁纳米颗粒(ZVI-NPs)可在肺癌细胞系中引发线粒体功能障碍、氧化应激及脂质过氧化,从而触发铁死亡并重塑肿瘤微环境,实现强效抗肿瘤作。值得注意的是,多种FDA批准的药物可诱导铁死亡,从而提升抗肿瘤疗效。例如,Sorafenib 已获准用于肝癌、肾癌及甲状腺癌,其通过抑制 System Xc− 并激活铁死亡发挥作用。在乳腺癌中,拉帕替尼与溶酶体破坏剂 siramesine 联用可扰乱铁代谢并触发脂质过氧化。同样,奥曲肽(批准用于卵巢癌)可直接抑制GPX4,诱导铁死亡并增强抗肿瘤免疫。抗疟药青蒿素通过降低谷胱甘肽(GSH)水平并增加头颈癌细胞内ROS,实现铁死亡诱导及免疫激活。
III 总结与展望
近年来,将铁死亡诱导纳米平台与免疫调节剂整合的研究取得了显著进展,推动了协同铁死亡–免疫治疗策略的发展。这些方法不仅旨在消除原发肿瘤,还可激活系统性抗肿瘤免疫,从而抑制转移及复发性病灶。这类创新为未来癌症治疗建立了概念框架,并有望引发治疗模式的潜在转变,超越传统疗法。纳米材料工程的发展在推动肿瘤免疫治疗方面发挥了关键作用,其中合理的纳米载体设计已成为决定铁死亡–免疫治疗效果的重要因素。
首先,当前的纳米平台定制利用了多样化的材料组成和结构配置。铁基纳米材料占主导地位,因为其可提升细胞内铁水平,从而增强Fenton反应并产生细胞毒性活性氧(ROS)。仿生系统采用细菌膜囊泡、肿瘤细胞衍生物或巨噬细胞启发的构造,可实现增强的免疫逃逸、延长循环时间及肿瘤靶向能力。血红蛋白基载体兼具供氧(用于光动力疗法)和提供铁源(用于铁死亡诱导)的双重优势,为药物递送系统设计提供了新视角。
其次,纳米载体的结构决定了治疗性负载物的装载方式,包括疏水相互作用、π–π堆叠、电荷吸附或共价连接。关键的理化参数——如尺寸、表面电荷、形态、两亲性及光学特性——显著影响生物稳定性、体内分布、细胞内吞及最终治疗效果。对这些性质的战略性调控是优化纳米平台性能的核心策略。
第三,通过化学修饰构建的多功能纳米载体可实现:(1) 通过配体–受体相互作用的靶向递送,(2) 在特定理化条件下的刺激响应药物释放,以及 (3) 集成生物成像能力以监控治疗过程。材料选择进一步影响治疗潜力,其中活性Fenton金属基纳米材料、GSH耗竭型纳米酶及富含多不饱和脂肪酸(PUFA)的脂质体在增强铁死亡方面表现出显著优势。
最后,肿瘤微环境(TME)具有显著免疫抑制性、低氧、高抗氧化防御及致密ECM等特点,对治疗形成挑战。尽管纳米材料工程能够解决部分障碍,但全面的解决方案仍需多模式策略,以实现:(1) 放大免疫原性细胞死亡,(2) 逆转免疫抑制,(3) 重塑低氧及ECM丰富的TME特征,(4) 恢复免疫监视,(5) 加速抗原呈递细胞成熟,以及 (6) 增强肿瘤浸润免疫效应细胞群体。此类综合方法最大化了铁死亡–免疫治疗范式的治疗潜力。
作者简介


关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 铁死亡-免疫治疗纳米平台综述:面向肿瘤微环境重塑与疗效优化的多维工程设计
 Nano-Micro Letters
Nano-Micro Letters 湖南大学郑建云等:基于太阳能的废旧电池高纯锂金属光电化学回收新策略
湖南大学郑建云等:基于太阳能的废旧电池高纯锂金属光电化学回收新策略 哈尔滨工业大学娄帅锋团队:“一箭双雕”-Sb/Nb协同TiNb₂O₇助力高性能低温锂离子电池
哈尔滨工业大学娄帅锋团队:“一箭双雕”-Sb/Nb协同TiNb₂O₇助力高性能低温锂离子电池 合肥理工学院吴玉程、李兆乾等:三氯蔗糖调控Zn²⁺溶剂化结构和(002)面取向实现高放电深度水系锌离子电池
合肥理工学院吴玉程、李兆乾等:三氯蔗糖调控Zn²⁺溶剂化结构和(002)面取向实现高放电深度水系锌离子电池 南昌航空大学刘崇波等:配位热力学调控磁畴构型演变实现低频电磁波衰减
南昌航空大学刘崇波等:配位热力学调控磁畴构型演变实现低频电磁波衰减