研究背景
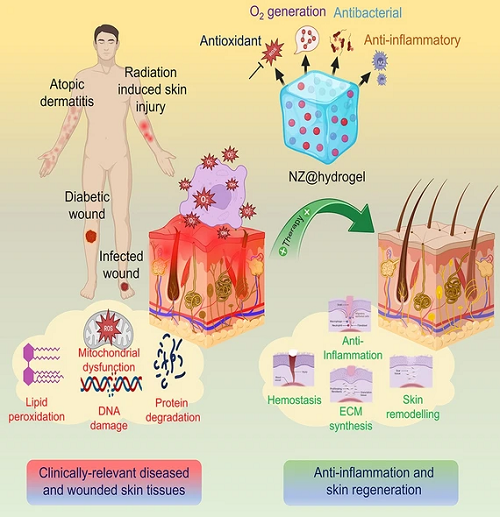
由于受伤、感染和疾病等各种因素造成的皮肤损伤已成为全球普遍关注的问题,因此需要有针对性的干预措施来促进组织再生。为了解决这些具有挑战性的病理性皮肤状况,人们开创皮肤组织工程(STE),以再生受损的皮肤组织,为传统伤口愈合方法提供潜在的替代方案。面对皮肤组织的不同特征,例如形态、生化成分和机械性能的变化,研究人员通过整合先进纳米酶(NZ)材料,结合水凝胶其固有的生物相容性和物理化学性质,为个性化皮肤护理治疗提供了潜在的解决方案。
Nanozyme-Engineered Hydrogels for Anti-Inflammation and Skin Regeneration
Amal George Kurian, Rajendra K. Singh, Varsha Sagar, Jung-Hwan Lee & Hae-Won Kim*
Nano-Micro Letters (2024)16: 110
https://doi.org/10.1007/s40820-024-01323-6
本文亮点
1. 基于纳米酶的方法来生产治疗性水凝胶。
2. 纳米酶工程水凝胶用于皮肤治疗的酶机制和多功能作用。
3. 纳米酶工程水凝胶对发炎皮肤组织的治疗作用。
4. 由纳米酶工程水凝胶指导关于机械和免疫学方面的皮肤治疗。
5. 纳米酶工程水凝胶平台的前景和挑战。
内容简介
炎症性皮肤病可导致疤痕和功能障碍,给患者和医疗保健系统带来巨大负担。传统疗法是采用皮质类固醇和非甾体类抗炎药,其疗效有限且存在不良反应。最近,基于纳米酶(NZ)工程水凝胶在应对这些挑战方面显示出了巨大的前景。基于NZ工程水凝胶结合了氧化还原纳米材料的治疗功效、酶活性和水凝胶的保水能力,具有独特的治疗能力。这些水凝胶的多方面治疗作用包括清除活性氧和其他炎症介质,调节对促再生环境的免疫反应,并通过触发细胞迁移和分化来增强再生潜力。檀国大学Hae-Won Kim等在这篇综述重点介绍了NZ工程水凝胶(NZ@水凝胶)在抗炎和皮肤再生应用中的最新技术水平,分析其有效性背后的潜在化学-机械-生物学机制。此外,还讨论了该领域的挑战和未来方向,特别是其临床转化,为个性化皮肤护理疗法提供新的可能。
图文导读
I NZ@水凝胶的酶促机制和多功能作用
在生物系统中,NZ@水凝胶具有协同的多酶活性功能,维持细胞内氧化还原平衡,保护生物体免受氧化损伤并形成防御系统。图1所展示的是NZ@水凝胶在皮肤治疗中的四种主要催化活性,包括人工过氧化物酶(POD)、过氧化氢酶(CAT)、氧化酶(OXD)和超氧化物歧化酶(SOD)。
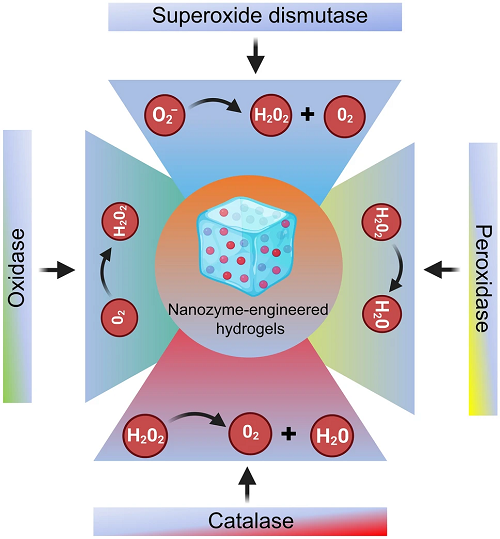
图1. 基于内在酶性质的NZ@水凝胶化学设计示意图。
图2所展示的是一系列具有促进皮肤再生酶功能的NZ@水凝胶设计。包括利用近红外吸收的二硫化钼(MoS₂),所制备的MoS₂@TA/Fe NSs与PVA、Dex和硼砂形成了粘性、可自我修复和形状可调节的水凝胶,表现出卓越的抗菌功效(图2a)。另一项研究利用由全氟辛基溴(PFOB)和聚(乳酸-乙醇酸)(PLGA)组成的PtNZ复合材料,是一种微环境自适应纳米杂化双网络水凝胶,可降低伤口中的葡萄糖水平(图2b)。此外,一种MoS₂@Au@BSA可模仿SOD在碱性伤口中的行为,减轻氧化应激、缓解缺氧问题,并加速糖尿病伤口的愈合(图2c)。
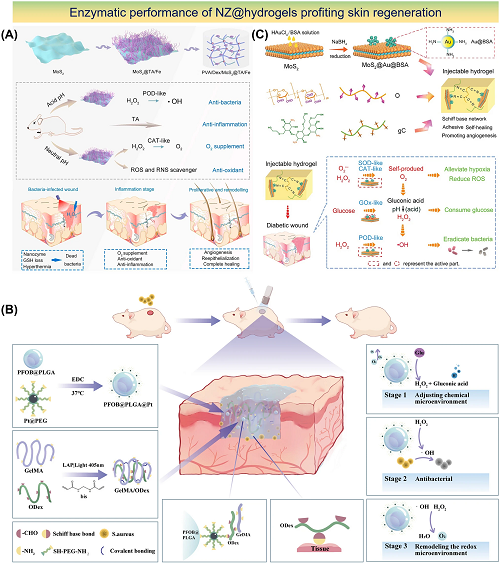
图2. 具有促进皮肤再生主要酶性能的NZ@水凝胶设计:a MoS₂@TA/Fe NSs的合成过程和双酶模拟活性用于加快伤口修复;b具有优异酶催化和抗菌特性的PFOB@PLGA@Pt/GelMA/ODex纳米杂化双网络水凝胶用于促进伤口愈合;c 使用供氧葡萄糖驱动的级联反应制备MoS₂@Au@BSA NS可注射水凝胶,用于重建糖尿病皮肤。
II NZ@水凝胶对临床患者和受伤皮肤组织的治疗效果
NZ@水凝胶在临床患者和受伤皮肤组织方面表现出了显著的疗效,特别是在挑战性病,例如糖尿病伤口、感染伤口、特应性皮炎和辐射引起的皮肤损伤(RISI)中的应用。图3所展示的为一系列NZ@水凝胶可加速糖尿病伤口愈合的研究实例。
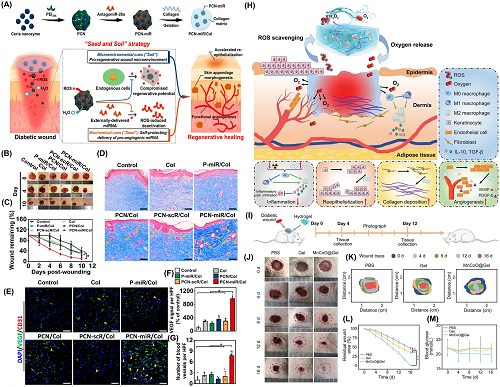
图3.NZ@水凝胶可加速糖尿病伤口愈合:a用于加速糖尿病皮肤再生的PCN-miR/Col水凝胶的制造过程;b水凝胶治疗后不同时期糖尿病伤口的照片;c从照片中获得的伤口面积的量化;d治疗28天后皮肤组织的Masson三色染色;e VEGF和CD31标记物的荧光表达;f VEGF表达定量和g 28天时多条血管的定量;h由MnCoO@PLE/HA水凝胶协调加速伤口愈合;i用于糖尿病伤口愈合的MnCoO@PLE/HA水凝胶的制造过程;j水凝胶治疗后16天对糖尿病伤口的照片进行评估;k不同时间点相对伤口愈合的表示;l根据伤口照片量化残留伤口面积;m糖尿病动物的血糖水平用于研究伤口愈合过程。
伤口发生的流行性感染给公共医疗系统带来了巨大的经济和社会负担。为了解决这些问题,NZ@水凝胶已被用来催化产生各种活性氧(ROS),从而消灭引起感染的细菌。图4所为部分NZ@水凝胶用于加速伤口愈合过程的研究成果。
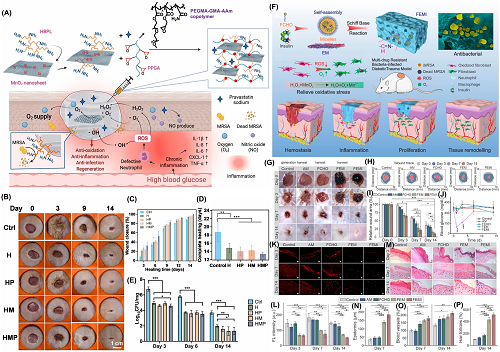
图4. 具有抗菌特性的NZ@水凝胶可加速伤口愈合过程:a基于PEGMA-GMA-Aam共聚物的多功能抗菌水凝胶的制备;b水凝胶治疗后感染伤口的照片;c不同时间点的相对伤口愈合率;d伤口完全愈合所需的天数;e感染伤口中细菌密度的定量;f用于感染糖尿病伤口的FEMI水凝胶的制作示意图;g施用水凝胶后伤口的照片;h不同时间点伤口闭合度的展示;i伤口闭合率的量化;j在不同时间点小鼠的血糖水平;k二氢乙锭的伤口中ROS水平的荧光表达;l不同水凝胶基团的DHE荧光强度;m水凝胶治疗后伤口的组织学检查;n第7天表皮厚度;o在第7天和第14天血管再生情况;p第14天毛囊形成情况。
特应性皮炎(AD)也是一种常见的炎症性皮肤病,由ROS诱导的氧化应激已成为一种潜在的治疗方法。由于新型NZ@水凝胶纳米制剂具有增强的功效和较低的毒性,这促进了其进一步的开发。图5所展示的为部分NZ@水凝胶在缓解AD方面的治疗成果进展。
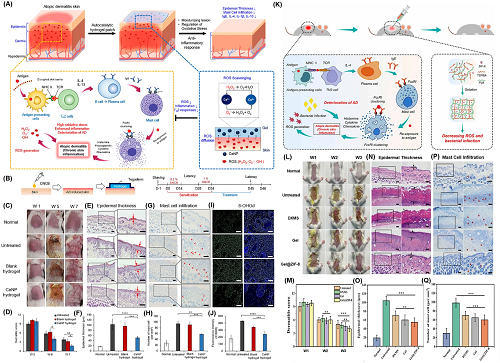
图5. NZ@水凝胶在缓解AD方面的治疗特性:a用于治疗AD的基于nCe的水凝胶贴片的设计;b体内实验示意图和动物实验时间表;c治疗后不同组的背部皮肤照片;d皮炎评分评估;e处理后用H&E染色的小鼠皮肤切片的组织;f表皮厚度比较;g样品的组织显示有浸润的肥大细胞;h浸润肥大细胞的相对定量;i氧化DNA损伤标记物的代表性免疫荧光图像:8-OHdG;j相对8-OHdG定量;k插图为Gel@ZIF-8抑制氧化应激和减轻炎症反应的能力;l治疗后小鼠背部皮肤的照片;m皮炎程度评估;n组间表皮厚度比较;o表皮厚度的相对定量;p样品的组织学显示浸润的肥大细胞;q肥大细胞的相对定量。
辐射性皮肤损伤(RISI)是指由于辐射暴露而导致的皮肤损伤。最近的研究表明,纳米治疗方法在解决RISI方面具有显着功效。在此背景下,NZ@水凝胶提供了一种具有酶促和抗氧化能力的有前途的解决方案。它们为涉及放射治疗和核辐射事故的情况下的高效辐射防护剂提供了可行的途径。图6为NZ@水凝胶在用于皮肤辐射防护治疗的研究成果展示。

图6. NZ@水凝胶可作为皮肤治疗的辐射防护剂:a nanoGDY@SH水凝胶的皮肤辐射防护能力的图示;b不同处理后小鼠皮肤伤口变化照片;c通过H&E和Masson染色对皮肤组织进行检查;d RISI的IFI6-PDA@GO/SA水凝胶的制备示意图;e用于诱导小鼠RISI模型的医疗设备的图像;f治疗期间小鼠背部皮肤的照片;g第14天皮肤组织的H&E染色;h伤口面积、肉芽组织厚度和伤口微血管密度的相对定量。
III 具有力学生物学功能的NZ@水凝胶
当前,许多研究强调皮肤内的各种细胞类型都可以感知机械信号。AD或湿疹是受遗传和环境因素影响的多因素疾病的典型例子,其中力传导机制在AD的发展和进展中发挥着至关重要的作用,其破坏可以作为各种皮肤病理的触发因素。最近的许多研究强调了机械传导信号分子的重要性,包括整合素、粘着斑分子、肌动蛋白细胞骨架和核转录因子(图7)。这些研究证实了NZ@水凝胶中ROS清除和FAK抑制的整合,可作为AD的协同治疗方法具有巨大的前景。
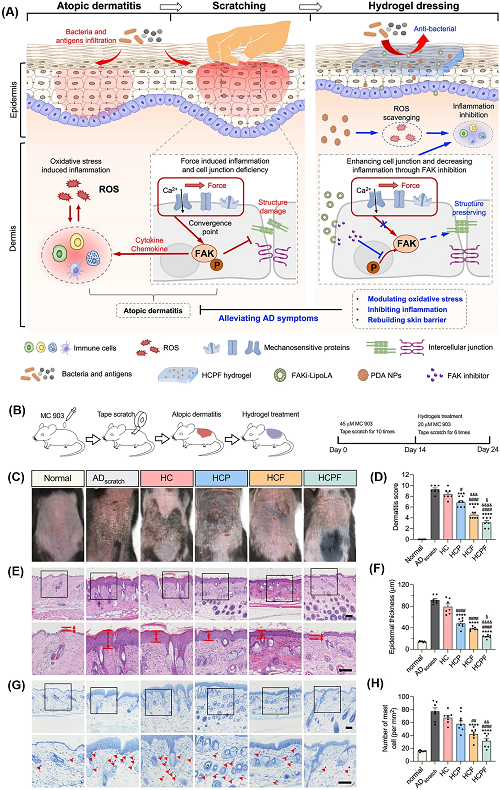
图7. NZ@水凝胶通过机械化学作用缓解AD症状:a由于氧化损伤而导致的AD炎症反应以及AD机械抓伤的结果,通过ROS清除和FAK磷酸化抑制治疗AD的协同作用;b体内的代表性实验;c第24天小鼠背部皮肤的照片;d皮炎评分评估;e皮肤切片的H&E染色;f通过H&E染色定量表皮厚度;g皮肤切片的TB染色;h测量治疗后每组肥大细胞的密度。
IV 展望与挑战
NZ@水凝胶已被证明是一种多功能平台,可以通过对抗ROS来治疗各种皮肤并发症,从而显示出抗细菌,甚至表现出抗癌特性。对于含有纳米粒子的治疗性水凝胶,未来的重点应该是推进微加工技术。这些先进技术可以精确控制NZ@水凝胶的成分、结构和功能,从而增强生物相容性、细胞和材料之间的相互作用,并改善治疗效果。3D生物打印等技术可用于创建高度模仿皮肤内在ECM的水凝胶(图8)。NZ@水凝胶平台的另一个关键特征是其智能响应能力。这种响应性可以通过多种刺激来启动,例如pH、温度、光或特定的生物分子信号,从而可以精确调节各种行为。此外,将NZ@水凝胶与基因疗法或基于干细胞的方法整合,从而提高组织工程策略的有效性,最终增强组织再生并更有效地治疗炎症性皮肤病。随着数据驱动的智能设计和机器学习(ML)技术的潜在使用,NZ@水凝胶平台结合机器学习旨在从现有数据推断数学模型,从而为加速所需材料的开发提供有效的工具。
尽管NZ@水凝胶在皮肤再生方面具有潜在的应用,但其固有的局限性需要考虑。生物相容性和潜在毒性是主要问题。此外,NZ@水凝胶在体内的长期影响仍不完全清楚,需要对潜在的慢性影响进行广泛的研究,包括其积累和生物降解。成本效率是另一个主要问题,因为纳米材料的制造和质量保证经常经历巨额费用,限制了其可访问性。
通过研究人员、生物医学工程师和临床医生之间持续的研究、创新和合作,为医疗保健的未来提供保障,这些新颖的疗法旨在提高全世界患者的生活质量。
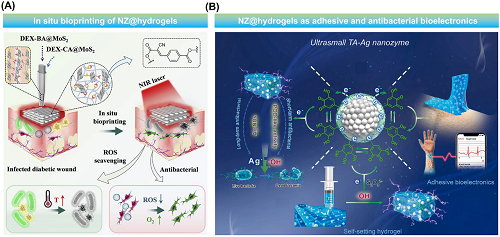
图8. 设计先进的NZ@水凝胶皮肤治疗平台:a通过微流体辅助原位打印方法制作MoS₂辅助胶凝水凝胶支架,以加速感染慢性伤口的愈合;b一种粘性、抗菌、可植入生物电极的超小型TA-Ag NZ催化水凝胶平台,可检测生物信号并加速组织再生同时预防感染
作者简介

本文通讯作者
纳米生物材料、细胞与生物材料的相互作用、三维培养方法以及肌肉骨骼、牙齿和神经组织的细胞重编程。
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 檀国大学Hae-Won Kim等综述:纳米酶工程水凝胶用于抗炎和皮肤再生
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用