Shuang Bai, Yulu Lan, Shiying Fu, Hongwei Cheng, Zhixiang Lu *, Gang Liu*
Nano-Micro Letters (2022)14: 145
https://doi.org/10.1007/s40820-022-00894-6
1. 综述了钙基纳米材料介导的癌症诊断与治疗的最新进展。
2. 讨论了钙基纳米材料的主要挑战和临床转化前景。
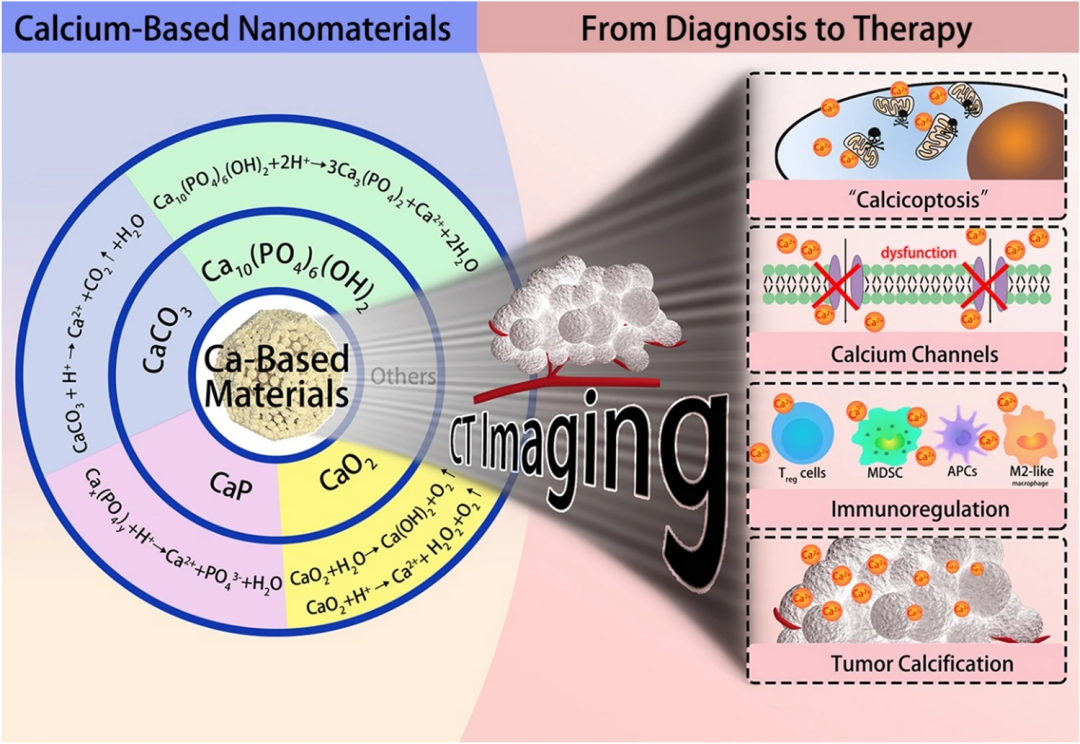
钙基载体是最安全的纳米材料之一,在肿瘤治疗中,常见的钙基纳米材料主要有碳酸钙(CaCO₃)、磷酸钙(CaP)、过氧化钙(CaO₂)、羟基磷灰石(HAp)等。其副产物如Ca²⁺、PO₄³⁻或CO₃²⁻等都是存在于血液中的安全成分。同时,大多数钙基功能材料都具有良好的肿瘤微环境反应性能,可与肿瘤微酸环境相互作用,因此常被用于设计pH响应的治疗系统。这类钙盐具有良好的生物相容性、生物降解性、生物安全性和有效性,在递药和疾病治疗方面具有广阔的应用前景(如图1)。
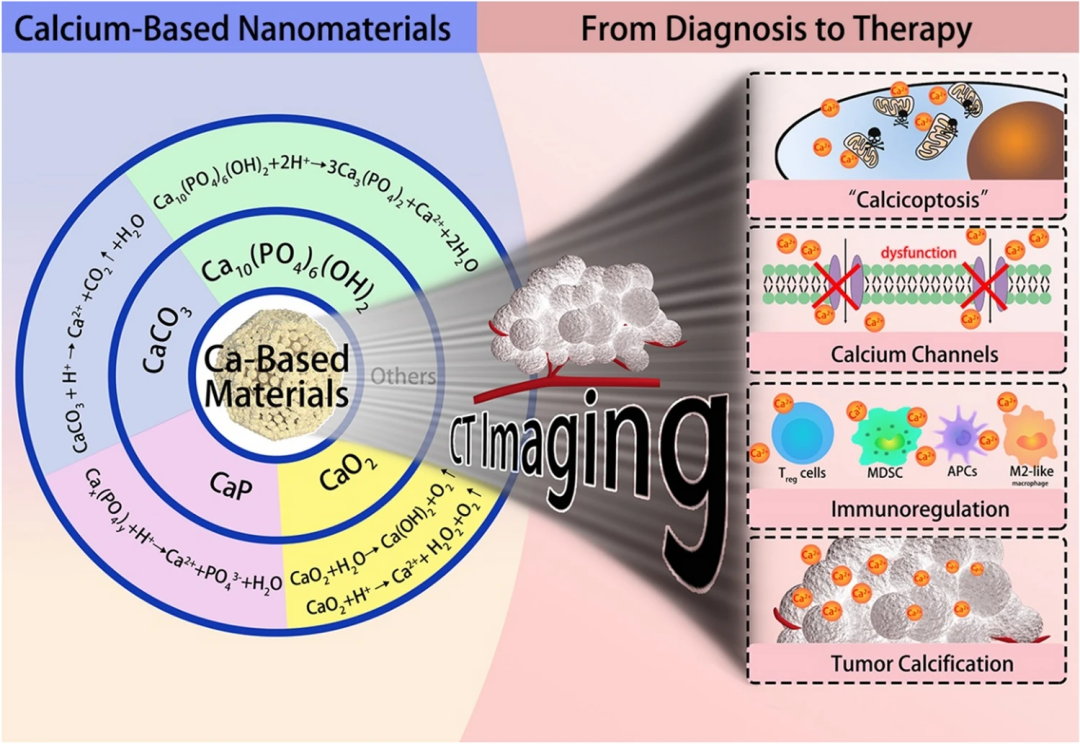
图1. 常见钙化合物及其介导的相关肿瘤治疗。
II 用于癌症诊断和治疗的钙基纳米材料
2.1 钙离子干扰疗法
离子干扰疗法-通过扰乱细胞内的离子平衡来调节其抗癌活性。钙基纳米材料可以通过直接提高细胞内钙浓度从而诱导钙离子干扰治疗,进而实现钙超载引起的亚细胞器损伤-线粒体损伤。线粒体结构受损和功能紊乱,会导致细胞结构破坏和氧化应激损伤,阻碍细胞增殖、迁移和侵袭,最终导致细胞凋亡(如图2a-d)。此外,改变渗透压是诱导钙离子干扰的另一种方式。基于黑磷(BP)的原位磷酸钙矿化策略(如图2f-h),能够诱导钙离子介导的渗透失衡, 并引起线粒体受损诱导的细胞死亡。
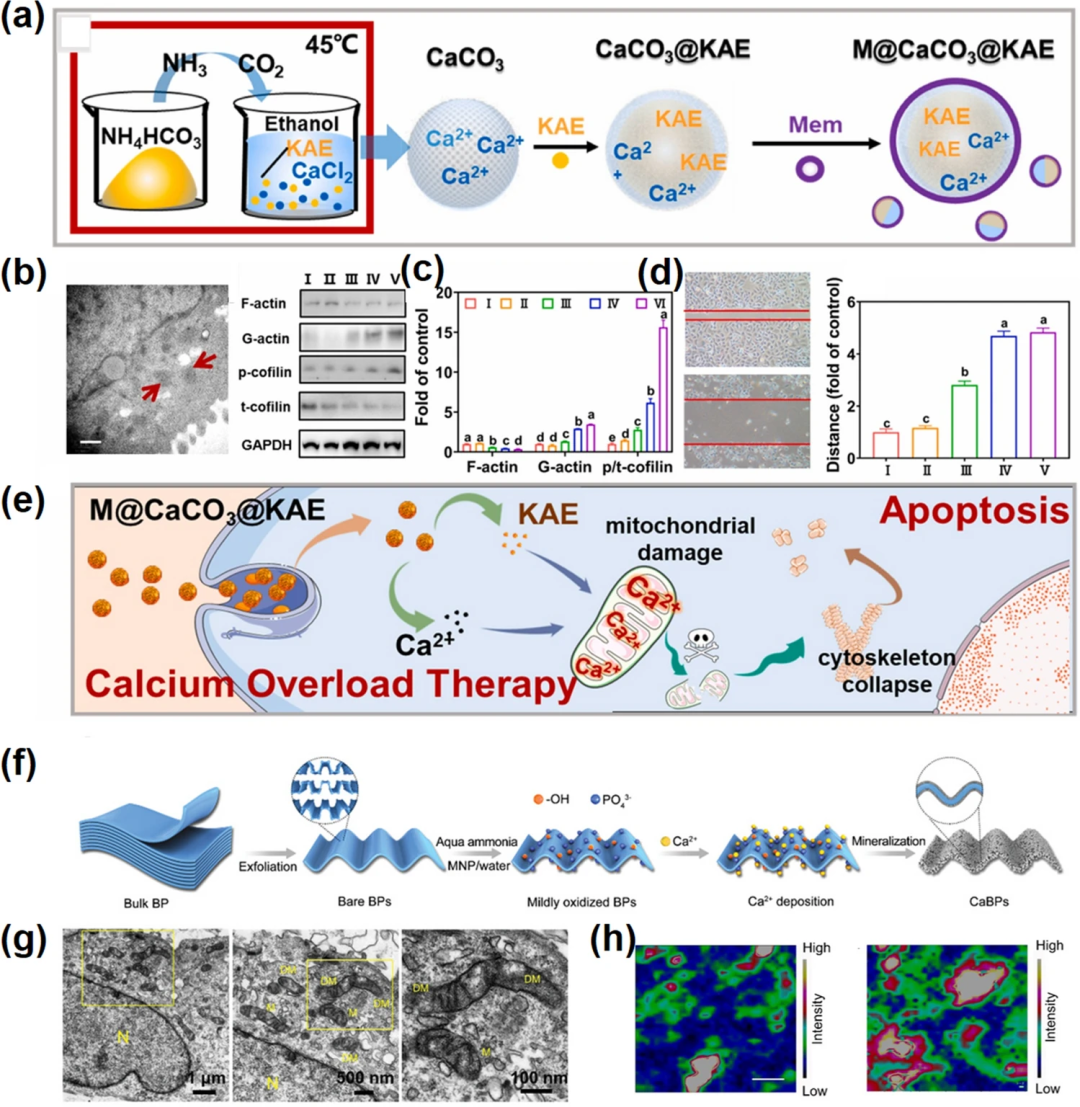
图2. 钙基纳米材料介导离子干扰治疗。(a)M@CaCO₃@KAE NPs的合成工艺;(b) M@CaCO₃@KAE NPs处理后线粒体的TEM图像;(c) A549细胞的蛋白水平(左)和强度(右);(d) A549细胞的迁移能力(左)和迁移距离的定量结果(右);(e) M@CaCO₃@KAE NPs介导的凋亡示意图;(f) CaBPs的合成工艺;(g) CaBPs治疗组的Bio-TEM图像;(h) 基于CaBPs处理(左)和未修饰的BPs处理(右)MCF-7细胞中分离的线粒体BPs绘制A1g拉曼峰特征强度的拉曼图。
2.2 钙通道与钙泵介导的肿瘤治疗
钙通道和钙泵是调节钙稳态的主要工具。改变Ca²⁺转运分子的表达可以促进肿瘤细胞生长,肿瘤血管生成以及不受控制的增殖和转移。癌症中许多Ca²⁺泵和通道的相关活动可以被特定的分子调节。如图3a-c,NO能够活化肿瘤细胞中过表达的ryanodine受体,使得细胞内Ca²⁺浓度升高,同时小檗胺关闭Ca²⁺外排通道,阻止钙外流,导致Ca²⁺超载介导的细胞死亡。此外,细胞内过多的ROS水平也会影响这些钙通道和钙泵中相关蛋白的活性。如图3d-e,CaO₂发挥作用诱导ROS以及Ca²⁺的释放,引起了钙通道失衡和钙超载,最终导致细胞死亡。
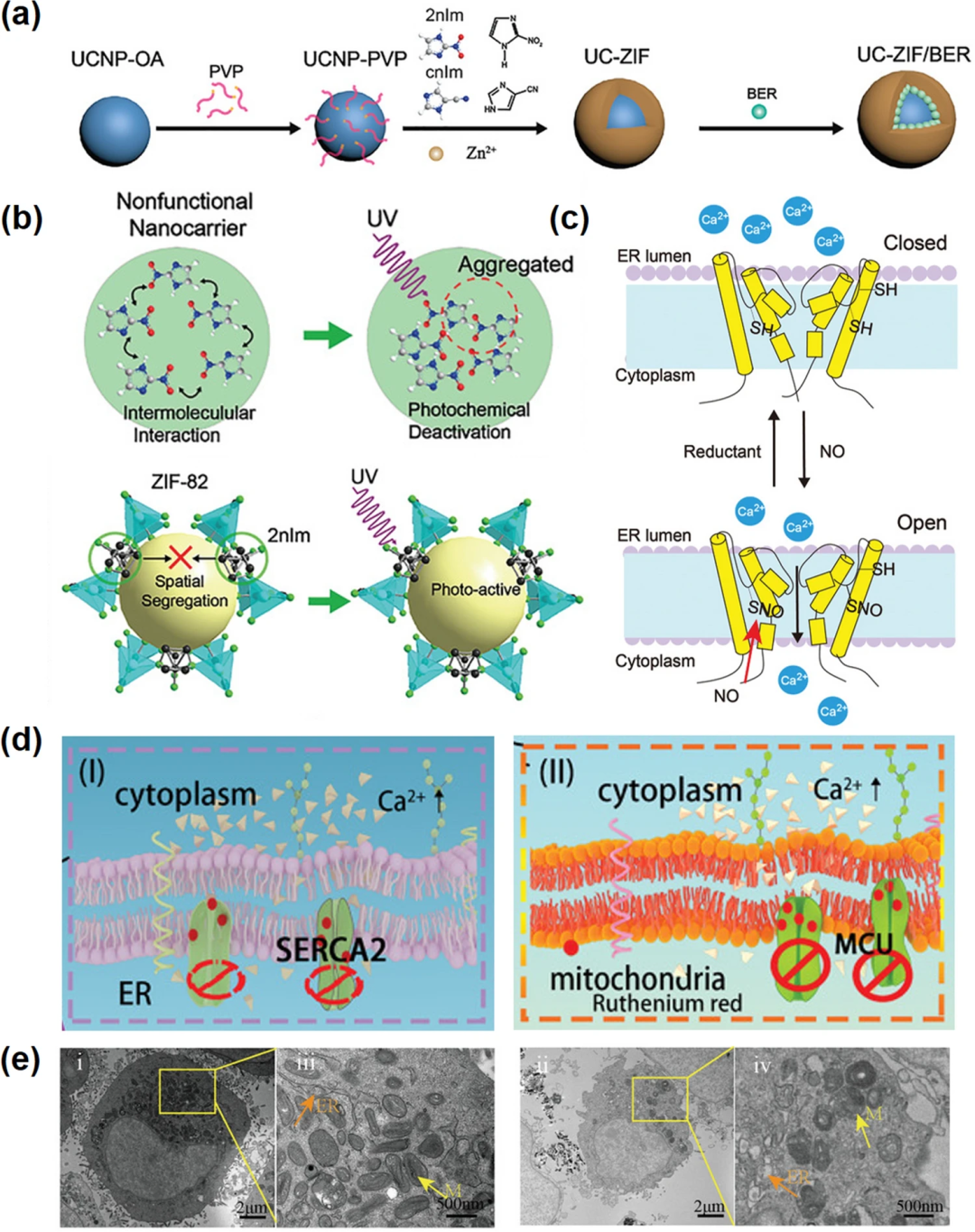
图3. 钙通道和钙泵。(a) UC-ZIF/BER的合成工艺;(b) 2nIm分子在非功能载体上的聚集猝灭机理(上);ZIF-82能提高2nIm分子的光化学活性(下);(c) NO激活RyRS的图解;(d) Ca²⁺通道蛋白抑制剂钌红通过抑制内质网Ca²⁺- ATP酶(左)和线粒体钙单胞体(右)诱导钙超载;(e) UCRSPH + SA-CaO₂ NPS与4T1肿瘤细胞孵育5min后0 h(左)和6 h(右)Bio-TEM图像。
2.3 钙基纳米材料介导的免疫治疗
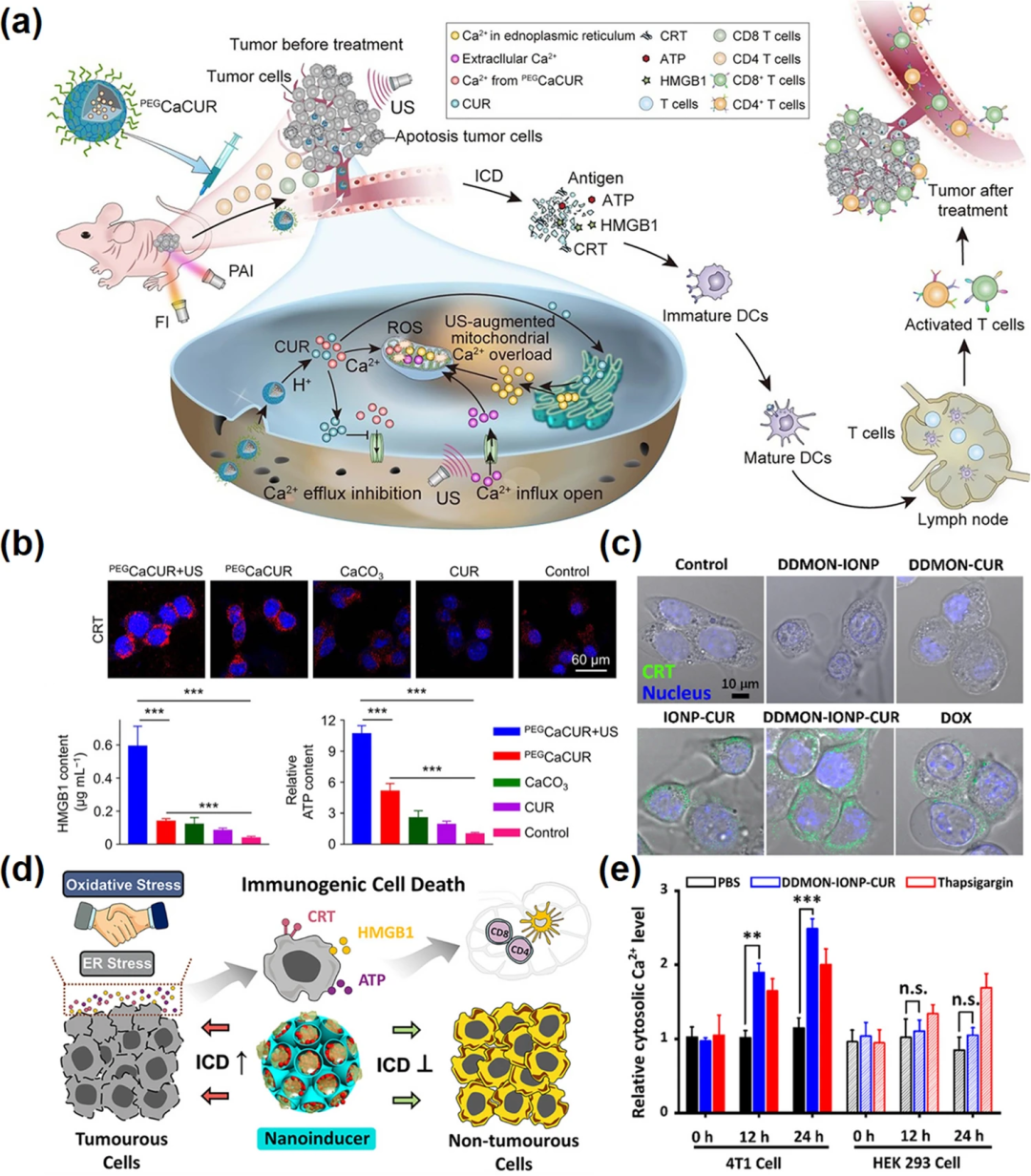
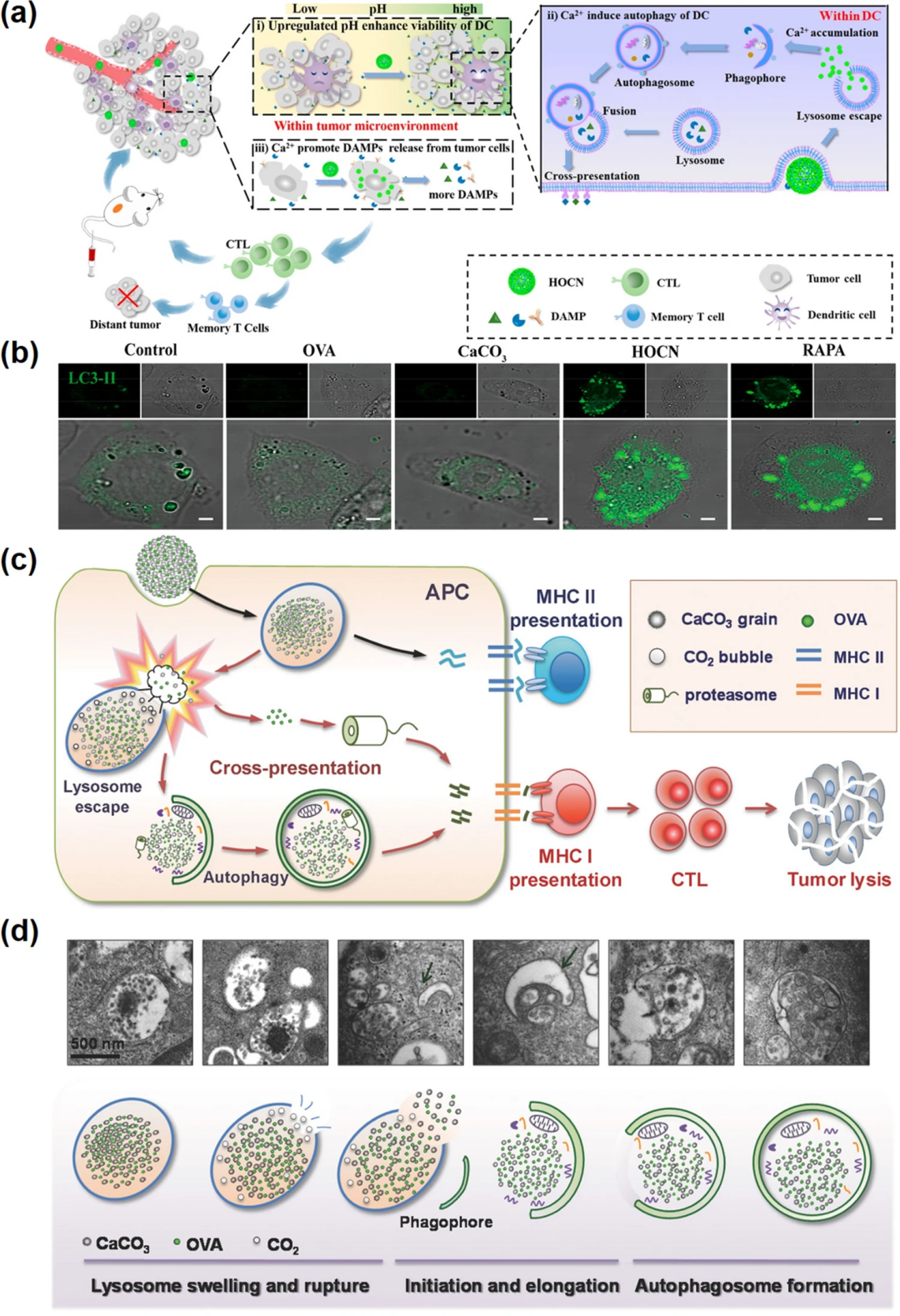
图5. 钙基纳米材料诱导自噬。(a) HOCN通过打破树突状细胞抗原交叉呈递的多重障碍来增强米托蒽醌介导的化学免疫治疗;(b) LC3-II在树突状细胞中的表达水平;(c) OVA@NP相关的自噬介导的抗原交叉呈递图;(d) 自噬过程的TEM图像。
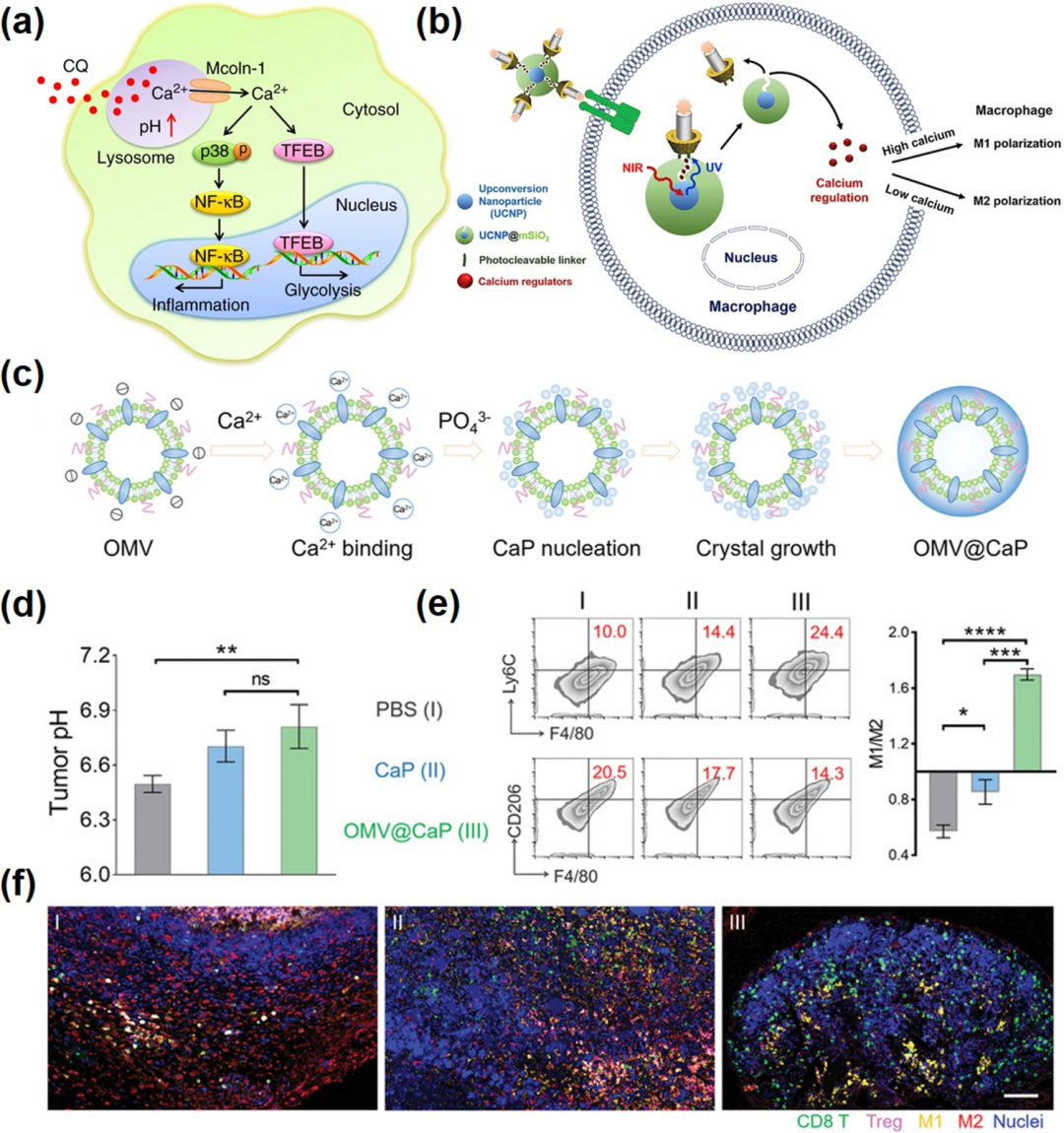
图6. 钙基纳米材料促进巨噬细胞极化。(a) 氯喹重置肿瘤相关巨噬细胞的示意图;(b) 本研究中纳米材料的合成工艺及实验方案说明;(c) OMV@CaPs生物矿化程序方案图;(d) 多光谱荧光定量测定不同治疗组肿瘤组织pH值;(e) 流式细胞术分析肿瘤中M1、M2巨噬细胞及M1/ M2比值(右);(f) Opal多色免疫荧光染色肿瘤组织图像。
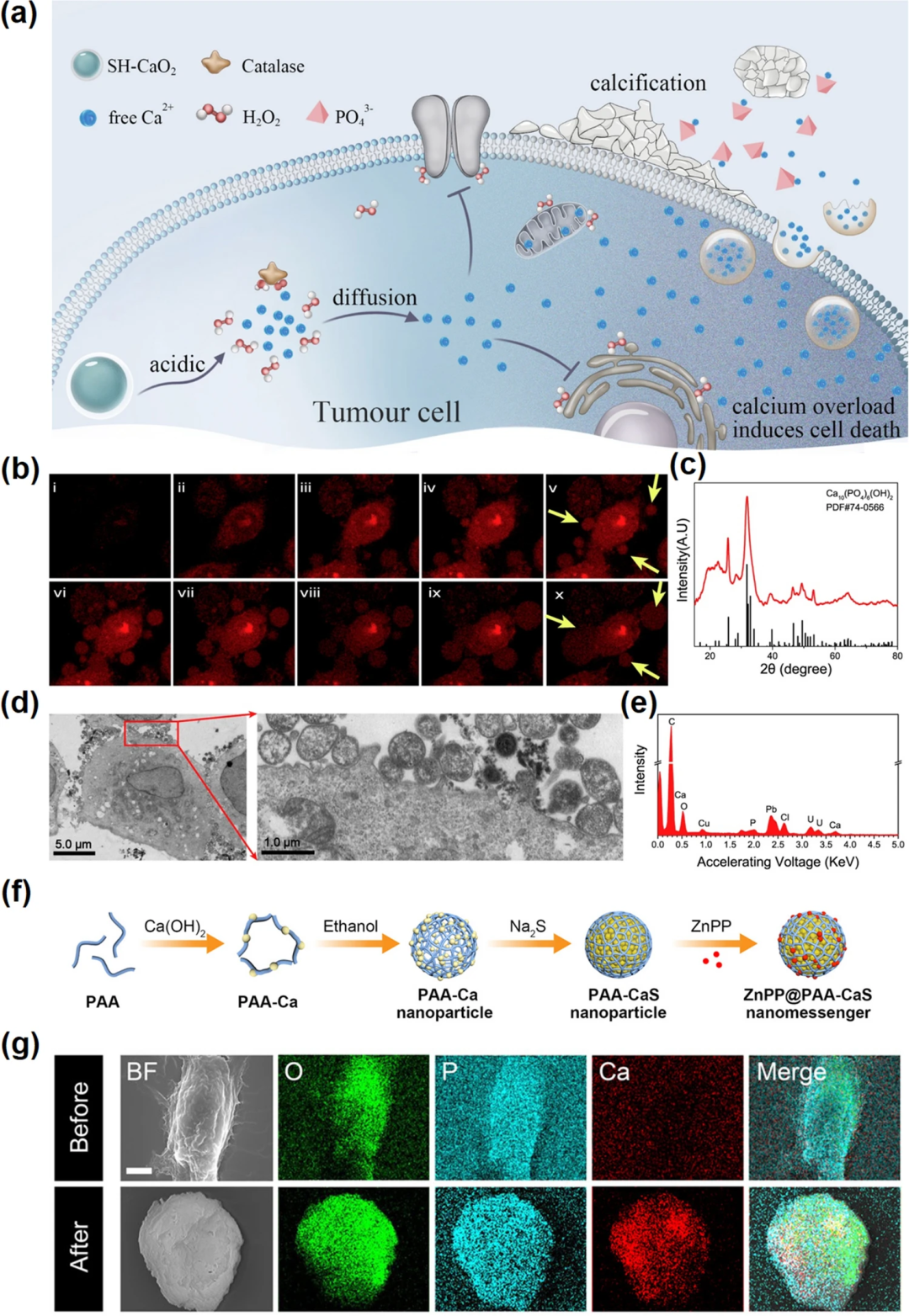
图7. 肿瘤钙化。(a) SH-CaO₂ NPs在肿瘤细胞中的功能示意图。SH-CaO₂ NPs在TME中分解,释放出Ca²⁺和H₂O₂分子。癌细胞中CAT的低表达导致H₂O₂的积累和钙转运途径的失衡,导致细胞内钙的高效过载,诱导细胞死亡。同时,局部Ca²⁺浓度升高,增加肿瘤钙化的可能性;(b)黄色箭头为SH-CaO₂ NPs处理后钙化小泡形成和胞吐现象;(c) SH-CaO₂ NPs处理后细胞胞吐产物的XRD;(d) 钙化小泡的生物透射电镜图像;(e) SH-CaO₂ NPs处理细胞外产物的EDS;(f) ZnPP@PAA-CaS纳米信使的合成过程示意图;(g) ZnPP@PAA-CaS纳米信使处理后4T1细胞的元素图谱。
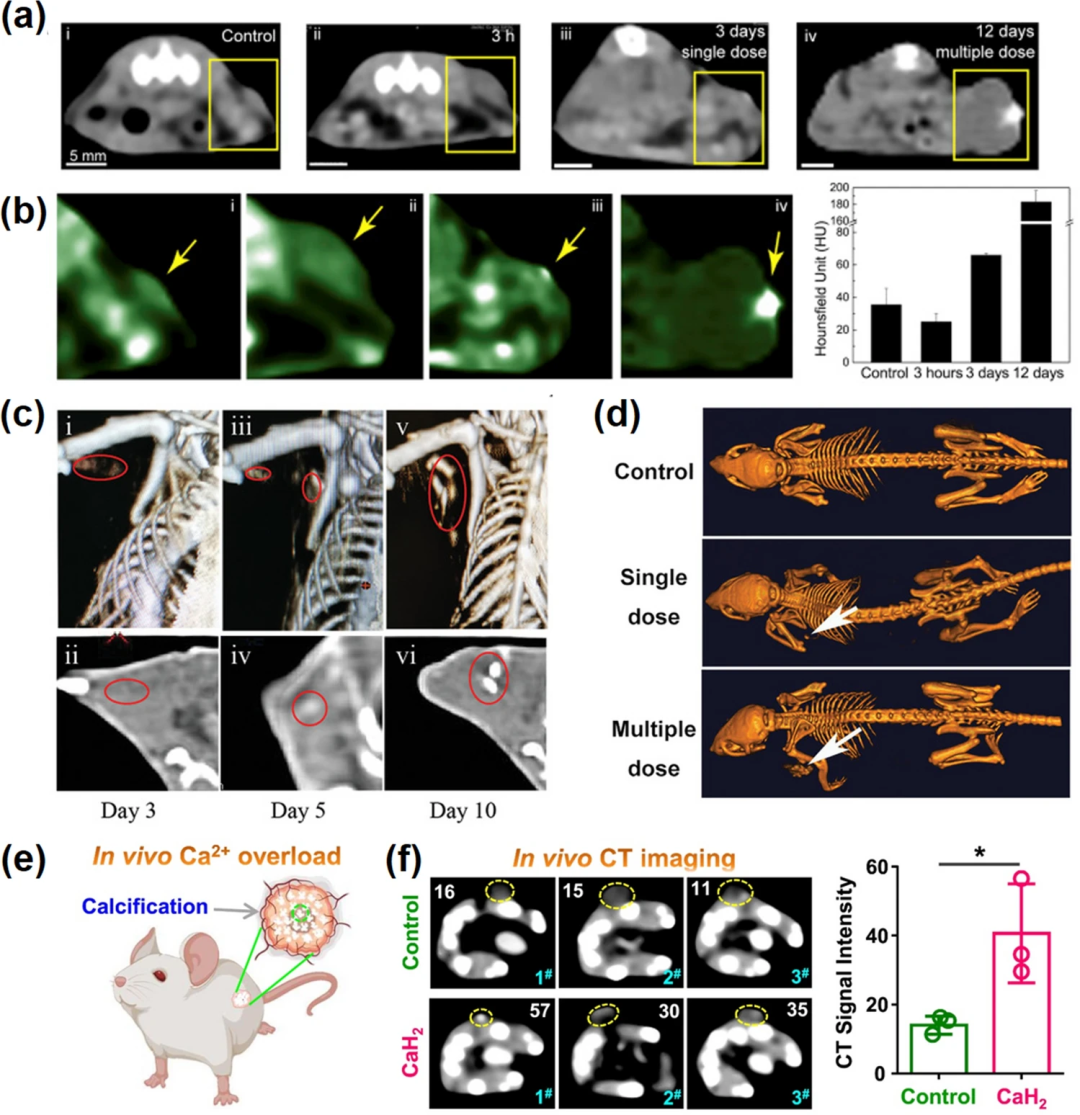
图8. 钙化介导的癌症成像。(a)使用SH-CaO₂ NPs治疗肿瘤的CT图像:(i)对照,(ii)小肿瘤单次注射后3小时或(iii) 3天,(iv)大肿瘤4次注射后12天;(b) 肿瘤伪彩色CT图像(左)及统计值;(c) UCRSPH + SA-CaO₂ +激光治疗后3、5、10天的CT图像;(d)治疗后对照组、单剂量组和多剂量组小鼠的CT图像;(e)纳米CaH₂注射后钙超载诱导的钙化示意图;(f)纳米CaH₂注入后的CT图像和相应的亨氏单位(HU)值。



本文共同通讯作者
▍主要研究成果
▍Email:zhixianglu_xd@163.com

本文通讯作者
▍主要研究成果
▍Email:gangliu.cmitm@xmu.edu.cn
撰稿:原文作者

Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 厦门大学刘刚教授团队:钙基纳米材料与癌症—从诊断到治疗
 Nano-Micro Letters
Nano-Micro Letters 韩国国家癌症中心:纳米凝胶增强肿瘤成像和光动力治疗效果
韩国国家癌症中心:纳米凝胶增强肿瘤成像和光动力治疗效果 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展