研究背景
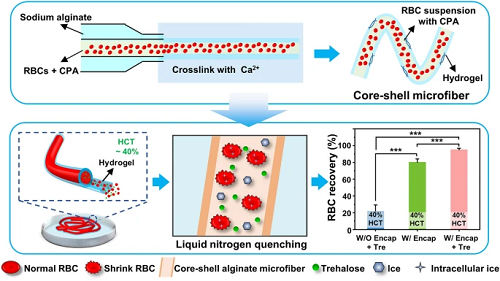
传统的红细胞低温保存方法通常采用高浓度的甘油(20%或40%,w/v),需要繁琐耗时的去甘油化过程,而现有的红细胞低甘油低温保存研究仍然面临着红细胞压积低的瓶颈问题,导致较大的储存空间和输注前额外的浓缩过程,给临床应用带来诸多不便。本文提出预脱水结合水凝胶封装的红细胞无甘油化低温保存策略,通过利用海藻糖作为唯一的低温保护剂对红细胞进行预脱水以及核壳微纤维增强低温保存过程中的传热,实现了高压积(>40%)红细胞高达95%的冻后回收率,低温保存后的红细胞被证明保持了其形态、力学和功能特性,同时该方法有望通过3D生物打印进一步扩展。
Core-Shell Microfiber Encapsulation Enables Glycerol-free Cryopreservation of RBCs with High Hematocrit
Xianhui Qin, Zhongrong Chen, Lingxiao Shen, Huilan Liu*, Xilin Ouyang* and Gang Zhao*
Nano-Micro Letters (2024)16: 3
https://doi.org/10.1007/s40820-023-01213-3
本文亮点
1. 开发了一种高效、无毒、无甘油、可扩展的高压积(>40%)红细胞低温保存方法。
2. 通过消除对渗透性低温保护剂的需求,简化洗涤步骤,以及减少洗涤时间,为冰冻红细胞的超快速便捷应用提供了潜力。
3. 取得了高达95%的红细胞回收率,冻存后的红细胞保持了其形态、力学和功能特性。
内容简介
传统的红细胞低温保存方法通常采用高浓度的甘油(20%或40%,w/v),需要繁琐耗时的去甘油化过程,而现有的红细胞低甘油低温保存研究仍然面临着红细胞压积低的瓶颈问题,导致较大的储存空间和输注前额外的浓缩过程,给临床应用带来诸多不便。中国科学技术大学赵刚课题组提出预脱水结合水凝胶封装的红细胞无甘油化低温保存策略,通过利用海藻糖作为唯一的低温保护剂对红细胞进行预脱水以及核壳微纤维增强低温保存过程中的传热,实现了高压积(>40%)红细胞高达95%的冻后回收率,低温保存后的红细胞被证明保持了其形态、力学和功能特性,同时该方法有望通过3D生物打印进一步扩展。
图文导读
I 红细胞核壳微纤维的制备过程及不同流速下的水凝胶微纤维的形态大小
制备红细胞核壳微纤维的过程如图1a所示。同轴针头的两个入口分别注射海藻糖和红细胞的混合溶液和海藻酸钠水溶液,在氯化钙溶液中凝胶成水凝胶微纤维。图1b-c为不同流速组合下核壳微纤维的显微图,结合图1d-f的统计数据可见,核壳微纤维尺寸约为1~1.4 mm,通过改变核溶液流速(Qcore)或壳溶液流速(Qshell),可以很容易地调节微纤维的内、外径,以及壁厚。
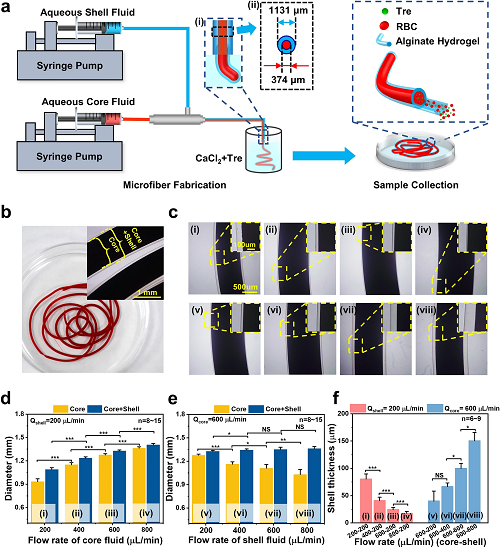
图1. 红细胞核壳微纤维的制备过程以及不同流速下的水凝胶微纤维的形态大小。a)基于微流控平台的微纤维制备概述及微纤维示意图:水性岩心液:含海藻糖的RBC悬浮液。Aqueous Shell Fluid:海藻酸钠溶液。Aqueous Core Fluid:红细胞悬液和海藻糖。RBC:红细胞。Tre:海藻糖;b) 浸在CaCl₂溶液中的核壳水凝胶微纤维的照片,以及微纤维的显微图像;c) i)-iv)和d) 不同核溶液流速下制备的微纤维显微图像和直径;c) v)-viii)和e)不同壳溶液流速下制备的微纤维显微图像和直径;f) 外壳厚度与不同流量组合的关系。Qshell:外壳溶液的流速。Qcore:核心溶液的流速。
II 本方法与传统红细胞低温保存方法的对比
17.5% Gly组和微纤维组冻融过程如图2a-d所示。图2e为两组冷冻复温过程中的温度变化曲线及降复温速率,可以发现,微纤维组(红色)的降/复温速率可达10000℃/min,远远高于冻存管组(蓝色),展现出更快的热传递效果。结合图1f和2f可以发现,微纤维外壳越薄,红细胞的冻后回收率越高。出于对无损封装的考虑,后续研究基于600-200 μL/min的核壳流速进一步探究了不同参数条件下红细胞的冻后存活率(图2g-j),包括海藻糖浓度、红细胞冻存压积、海藻酸钠溶液浓度、柠檬酸钠溶液浓度。最终探索出本方法的最优参数为:600-200 μL/min(核-壳),0.5 M Tre、40% HCT、2% SA、0.3 M SC。
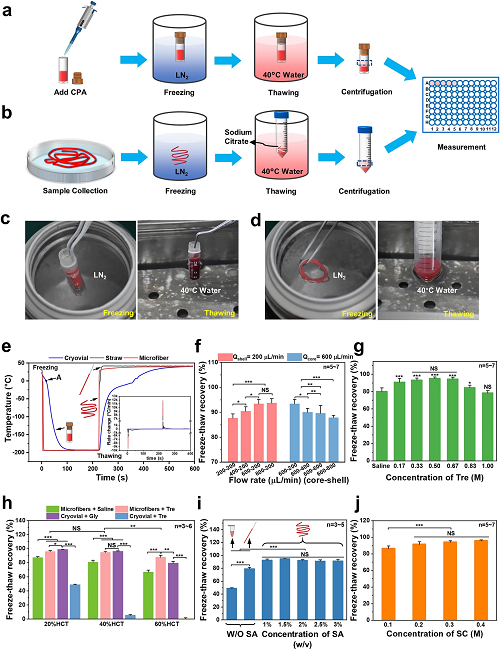
图2. 本方法与传统红细胞低温保存方法的对比。a)传统低甘油(17.5%)快冷法;b) 核壳微纤维封装红细胞的低温保存;c)低甘油快冷法的冻融照片;d)红细胞微纤维冷冻保存的冻融照片;e)不同参数下的红细胞回收率:e)冻融过程中的传热分析;f)不同流速组合下的冷冻回收率;g)不同浓度海藻糖溶液的冷冻回收率;h)不同红细胞压积下不同组的冷冻回收率;i)不同浓度海藻酸钠溶液的冷冻回收率;j)不同浓度柠檬酸钠溶液的冷冻回收率。Tre:海藻糖。SA:海藻酸钠。SC:柠檬酸钠。
III 红细胞的洗涤过程和洗涤后红细胞的功能性质、形态的评估
在评估冻后红细胞的质量参数之前,首先对冻后红细胞进行了洗涤(图3a)。在洗涤过程中,上清液的典型照片如图3b所示,反映了洗涤后红细胞的溶血情况,图3c和d定量分析了洗涤过程中每一步骤的溶血率以及洗涤后红细胞的回收率,微纤维组的洗涤回收率与传统甘油组没有显著性差异,而其洗涤过程比甘油组更简化和更省时。进一步地,通过红细胞渗透脆性实验评估其力学性能(图3e-f),结果显示相对于甘油组,微纤维组红细胞可以耐受更低渗的溶液。图3g-h展示了红细胞胞内ROS和NO水平,数据表明微纤维组的结果与新鲜组的没有显著性差异,而ATP含量(图3i)虽然比新鲜组略有下降,但是文献表明回输体内后可以在37℃的血清中迅速恢复正常水平。最后,通过扫描电镜和流式细胞仪的结果(图3j-k)证明了微纤维组的红细胞可以维持其正常的双凹圆盘状结构。

图3. 红细胞的洗涤过程和洗涤后红细胞的功能性质、形态的评估。a) 红细胞洗涤过程示意图;b)两种冻存方法洗涤过程中每一步骤上清液的照片;c)洗涤过程中各步骤的溶血率;d)洗涤后不同组的洗涤回收率;e)渗透脆性曲线;f)渗透脆性指数;g-i)比较新鲜红细胞(黑色)、17.5% Gly组(蓝色)和微纤维组(红色)冷冻保存后红细胞的功能特性。测定红细胞三种生化指标:g)胞内活性氧(ROS)水平,h)胞内一氧化氮(NO)水平,i) ATP水平。阴性对照组(黑色虚线表示未染色的新鲜红细胞,蓝色虚线表示17.5% Gly组中未染色的洗涤红细胞,红色虚线表示超纤维组中未染色的洗涤红细胞)不进行标记,并作为检测细胞自身荧光的基线;J-k)形态评估:j)红细胞的电子显微镜观察;k)流式细胞术获得的散点图。
IV 本工作与之前水凝胶微纤维封装红细胞冷冻保存方法之间的比较
与之前的工作相比,本工作有了很大的改进(图4):第一,微纤维结构不同,本工作中核壳微纤维的外壳不仅可以通过抑制薄膜沸腾来促进传热,还可以保护封装的细胞免受外界的机械损伤,起到物理屏障的作用。第二,本工作在不使用甘油的情况下,即使在较高的红细胞压积(40%,至少是使用甘油时的5倍),冷冻回收率也显著提高(约提高了15%)(图4b),意味着更高效。第三,本工作由于冻存压积高而大大减少了储存空间、能量消耗和解交联时间(图4c)。
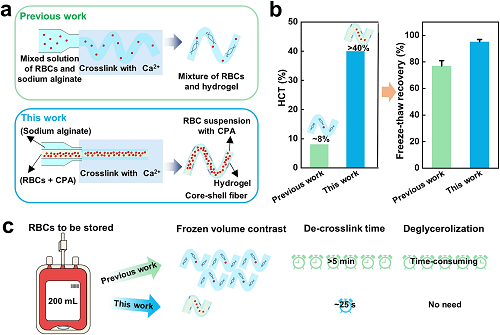
图4. 本工作与之前水凝胶微纤维封装红细胞冷冻保存方法之间的比较。a)制备过程和结构,b) 红细胞压积(HCT)和冷冻回收率,c)处理能力。
V 红细胞低温保存机制分析
图5a-b是定量评估冰重结晶抑制(IRI)活性的“splat”试验结果,微纤维组使用的0.5 M Tre的重结晶冰晶比其他两组要小得多,说明0.5 M Tre对冰晶重结晶有明显的抑制作用。图5c为核壳微纤维封装结合海藻糖预脱水的红细胞冷冻保存方法的可能机制:首先,海藻糖在冷冻前使红细胞脱水,从而减少了降温过程中红细胞胞内冰的形成,对冰晶重结晶有明显的抑制作用(图5a-b)。然后,微纤维的外壳不仅可以通过抑制膜沸腾来促进热传递,还可以保护封装的红细胞免受外界的机械损伤,起到物理屏障的作用。超快复温速率(图2e)使红细胞在复温过程中更快地通过危险温度区,以避免或减少重结晶可能产生的有害影响。最后,海藻糖具有膜稳定作用。
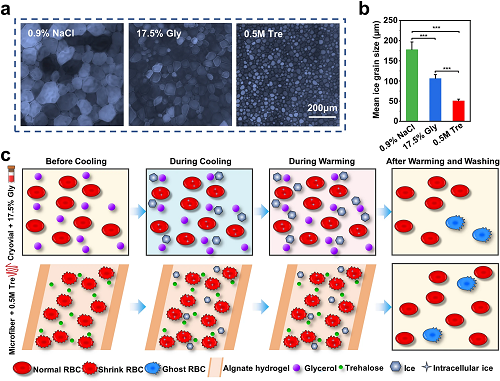
图5. 红细胞低温保存机制分析。a-b)不同低温保护剂的冰晶重结晶抑制(IRI)活性:a) 在NaCl溶液(0.9%)、17.5% Gly溶液和0.5 M Tre溶液中生长的冰晶显微图像;b)各组平均冰晶粒度;c)低温保存过程中可能的机理示意图。
VI 可扩展性
最后,对于现成可用的红细胞来说,冷冻保存方法的可扩展性至关重要。如图6所示,通过3D生物打印或编织进一步扩展本方法,可以获得具有临床意义的通量。后续工作将基于冷冻打印技术进一步验证本工作的扩展效果。
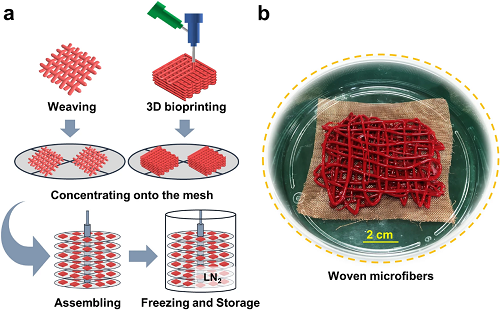
图6. a)扩展化的概念示意图:首先,通过3D生物打印或编织制备核壳红细胞微纤维,收集于网状圆盘上。然后,将这些网片堆叠并组装在一起。最后,将收集在组装圆盘上的红细胞微纤维置于经过紫外线消毒的液氮中冷冻和保存;b)编织微纤维的图片。
作者简介

本文第一作者
 刘会兰
刘会兰本文通讯作者
▍Email:huilanl@ustc.edu.cn

本文通讯作者
 赵刚
赵刚本文通讯作者
▍Email:zhaog@ustc.edu.cn
撰稿:原文作者
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 中科大赵刚教授等:核壳微纤维封装实现人体红细胞的高压积-无甘油化低温保存
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用