Tumor Microenvironment Cascade‑Responsive Nanodrug with Self‑Targeting Activation and ROS Regeneration for Synergistic Oxidation‑Chemotherapy
Yang Li#, Jinyan Lin#, Peiyuan Wang, Qiang Luo, Fukai Zhu, Yun Zhang, Zhenqing Hou, Xiaolong Liu*, Jingfeng Liu*
Nano‑Micro Lett.(2020)12:182
https://doi.org/10.1007/s40820-020-00492-4
1. 构建了一种兼具自靶向激活和ROS循环放大功能的pH/ROS级联响应维生素E纳米前药。
2. 纳米前药可响应肿瘤细胞内源性ROS按需释放维生素E琥珀酸酯,继而作用于线粒体呼吸链复合物II产生外源性ROS,通过正反馈循环进一步加速纳米前药解体,实现药物在肿瘤部位的特异释放。
3. 纳米前药可通过氧化疗法和化疗的有序组合实现肿瘤的高效协同治疗。
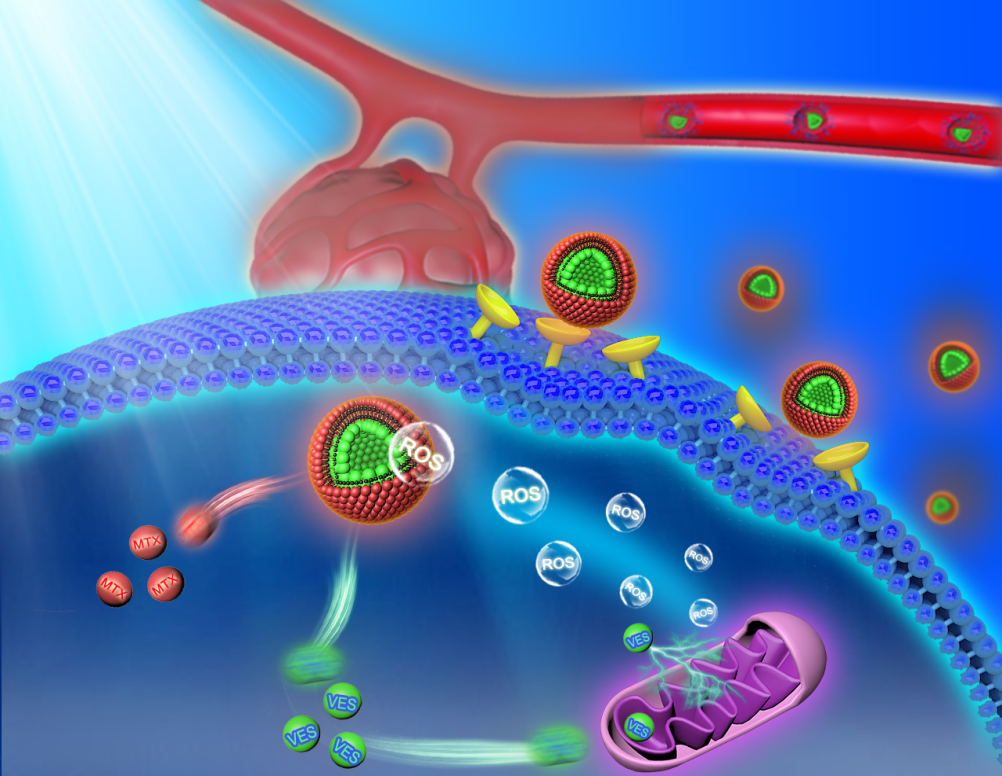
无载体纳米前药可经EPR效应聚集于肿瘤部位,同时兼具超高载药量和控释等优点,作为新兴的药物递送系统受到广泛关注。然而,与诸多其他纳米药物一样,无载体纳米前药在肿瘤部位和肿瘤细胞中的蓄积不足是限制其临床转化的一大难题;此外,肿瘤微环境中常见内源性刺激水平含量不够高且分布不均匀,难以有效实现药物的精准和特异释放。维生素E琥珀酸酯(VES)可作用于线粒体呼吸链复合物II快速产生大量ROS以产生氧化应激;甲氨蝶呤(MTX)既可发挥化疗功效又可发挥靶向作用。有鉴于此,我们将两者结合,合成肿瘤微酸环境响应VES-N=CH-PEG和肿瘤细胞内ROS响应VES-Se-Se-MTX两种药物前体基元,自组装构建一种肿瘤微环境级联响应纳米前药,可依次通过自靶向激活和ROS循环放大,实现纳米药物于肿瘤部位和肿瘤细胞的高效蓄积与特异释放,最终实现对肿瘤氧化-化疗协同疗效的增强。中国科学院福建物质结构研究所&福建医科大学孟超肝胆医院刘小龙、刘景丰团队基于肿瘤细胞内ROS响应维生素E琥珀酸酯-甲氨蝶呤前体药物(VES-Se-Se-MTX)的自组装和肿瘤微酸环境响应维生素琥珀酸酯-PEG(VES-N=CH-PEG)的表面嵌入,开发了一种兼具自靶向激活和ROS循环放大功能的pH/ROS级联响应无载体纳米前药。
聚乙二醇(PEG)冠包被于表面可掩蔽MTX的靶向性能,避免药物被免疫系统清除。纳米前药经长循环聚集至肿瘤部位后,可响应微酸环境导致PEG冠脱落,从而暴露MTX靶向配体,实现肿瘤细胞对其的特异摄取;随后肿瘤细胞内源性ROS可触发二硒键断裂,从而导致纳米前药分解;从中释放出来的VES可作用于线粒体呼吸链复合物II,产生大量外源性ROS,继而通过正反馈循环进一步加速药物释放。借助于自靶向激活和ROS循环放大的级联反应,纳米前药经尾静脉注射入裸鼠体内,可高效蓄积于肿瘤组织和肿瘤细胞并实现肿瘤细胞内的特异药物释放,最终实现对肿瘤氧化-化疗协同疗效的增强。
I pH/ROS级联响应VSeM-N=CH-PEG纳米前药的构建
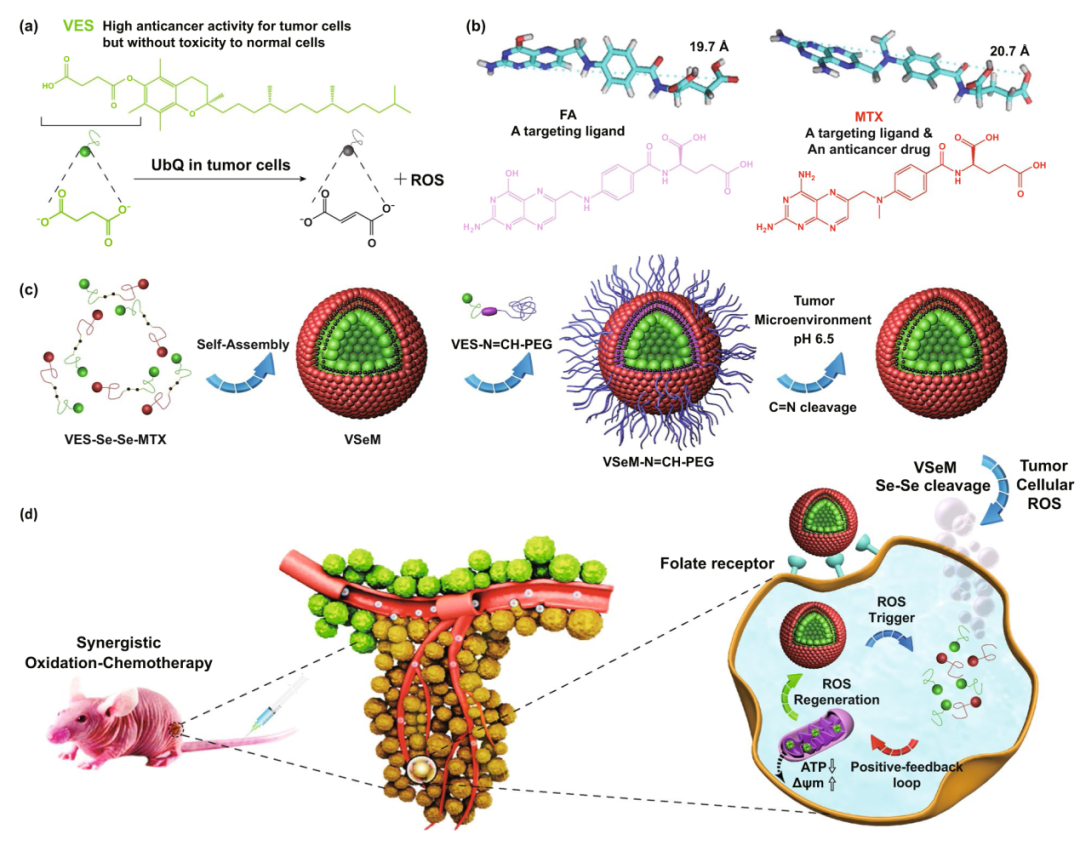
维生素E琥珀酸酯(VES)是一种重要的维生素E酯类衍生物。诸多文献报道发现VES能高度选择性地诱导肿瘤细胞凋亡,却对正常人体细胞及组织几乎没有毒性。最近研究发现,VES能够特异靶向攻击肿瘤细胞线粒体,作用于线粒体呼吸链复合物II诱导活性氧(ROS)快速产生和积累(图1a)。另外,由于甲氨蝶呤(MTX)与叶酸(FA)的化学结构高度类似,相异之处在于FA蝶啶环4位基团为羟基,而MTX则为氨基,MTX既可作为抗肿瘤药物,也可作为靶向配体(图1b)。有鉴于此,我们合成了ROS响应VES-Se-Se-MTX和pH响应VES-N=CH-PEG两种药物前体,基于VES-Se-Se-MTX的自组装和VES-N=CH-PEG的表面嵌入,构建了一种pH/ROS级联响应VSeM-N=CH-PEG纳米前药(图1c),依次通过肿瘤微酸响应的自靶向激活和肿瘤细胞内ROS响应的“药物突释和ROS循环放大”的级联反应,实现氧化-化疗协同治疗并增加疗效(图1d)。
图1. (a) VES的化学结构和产生ROS机制;(b) FA和MTX的分子构型优化和化学结构;(c) 基于ROS响应VES-Se-Se-MTX的自组装和肿瘤微酸响应VES-N=CH-PEG的表面嵌入,构建pH/ROS级联响应VSeM-N=CH-PEG纳米前药;(d) 肿瘤微酸响应的自靶向激活和ROS响应的“药物突释和ROS循环放大”应用于氧化-化疗协同治疗。
II pH/ROS级联响应VSeM-N=CH-PEG纳米前药的表征
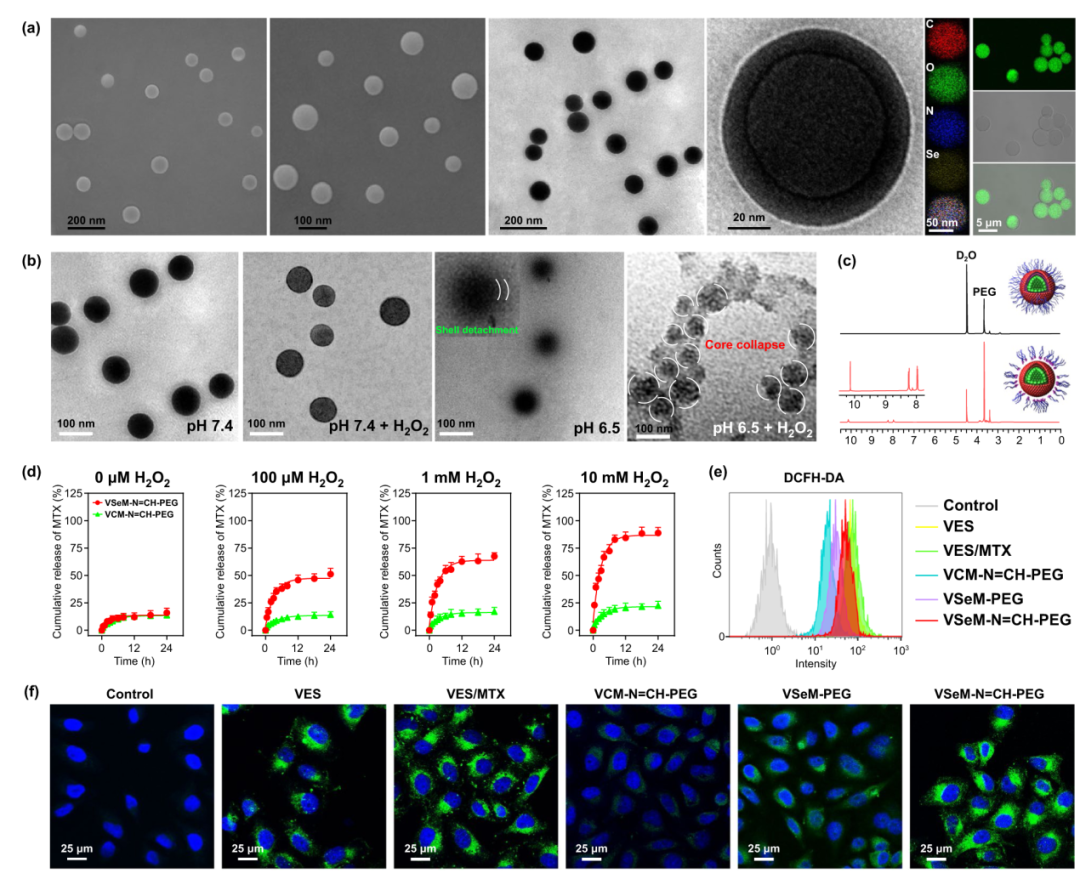
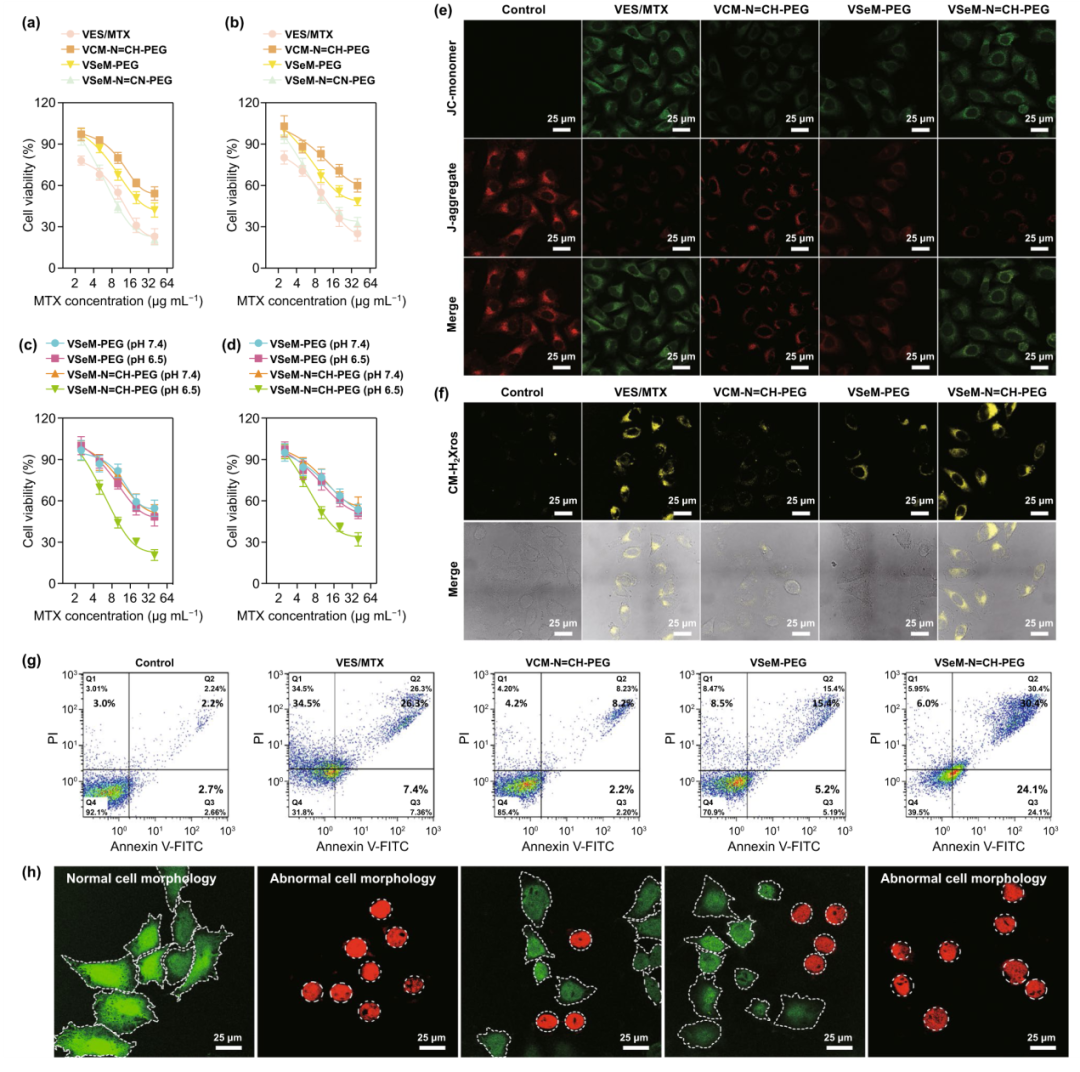
VES-Se-Se-MTX可通过二硒键介导的自组装形成球状纳米前药(VSeM)。为进一步提高VSeM的分散稳定性和延长其血液循环时间,我们利用后插入法在其表面嵌入苯甲酰亚胺键连接的VES-N=CH-PEG,构建VSeM-N=CH-PEG纳米前药。SEM图、TEM图、元素分布图等表明该纳米前药的大小约为100nm,呈均匀球形分布(图2a)。依次引入酸性pH和H₂O₂刺激后,该纳米前药的形貌发生变化,不仅出现壳结构分离和核结构瓦解(图1b, c),而且药物释放也得以加快(图1d)。此外,为研究VSeM-N=CH-PEG纳米前药的ROS产生能力,肿瘤细胞与VES(小分子),VES/MTX(小分子混合物),VCM-N=CH-PEG(ROS不敏感性纳米前药),VSeM-PEG(pH不敏感性纳米前药),VSeM-N=CH-PEG(pH/ROS响应纳米前药)在pH 6.5条件下共同孵育6 h。结果表明VSeM-N=CH-PEG相较于VCM-N=CH-PEG和VSeM-PEG,可诱导肿瘤细胞产生显著更多的ROS(图2f)。
图2. VSeM-N=CH-PEG的理化表征:(a) SEM图、TEM图、元素分布图、激光共聚焦图;(b) pH 7.4、pH 7.4 + H₂O₂、pH 6.5、pH 6.4 + H₂O₂条件下的TEM图;(c) pH 7.4和pH 6.5条件下的1H NMR图;(d) pH 6.5、不同H₂O₂浓度条件下药物释放曲线;(e, f) HeLa细胞与VES/MTX,VCM-N=CH-PEG,VSeM-PEG,VSeM-N=CH-PEG在pH 6.5条件下共同孵育6 h后的ROS水平含量分析:(e) 流式曲线图和(f) 激光共聚焦图。
III pH/ROS级联响应VSeM-N=CH-PEG纳米前药的细胞摄取
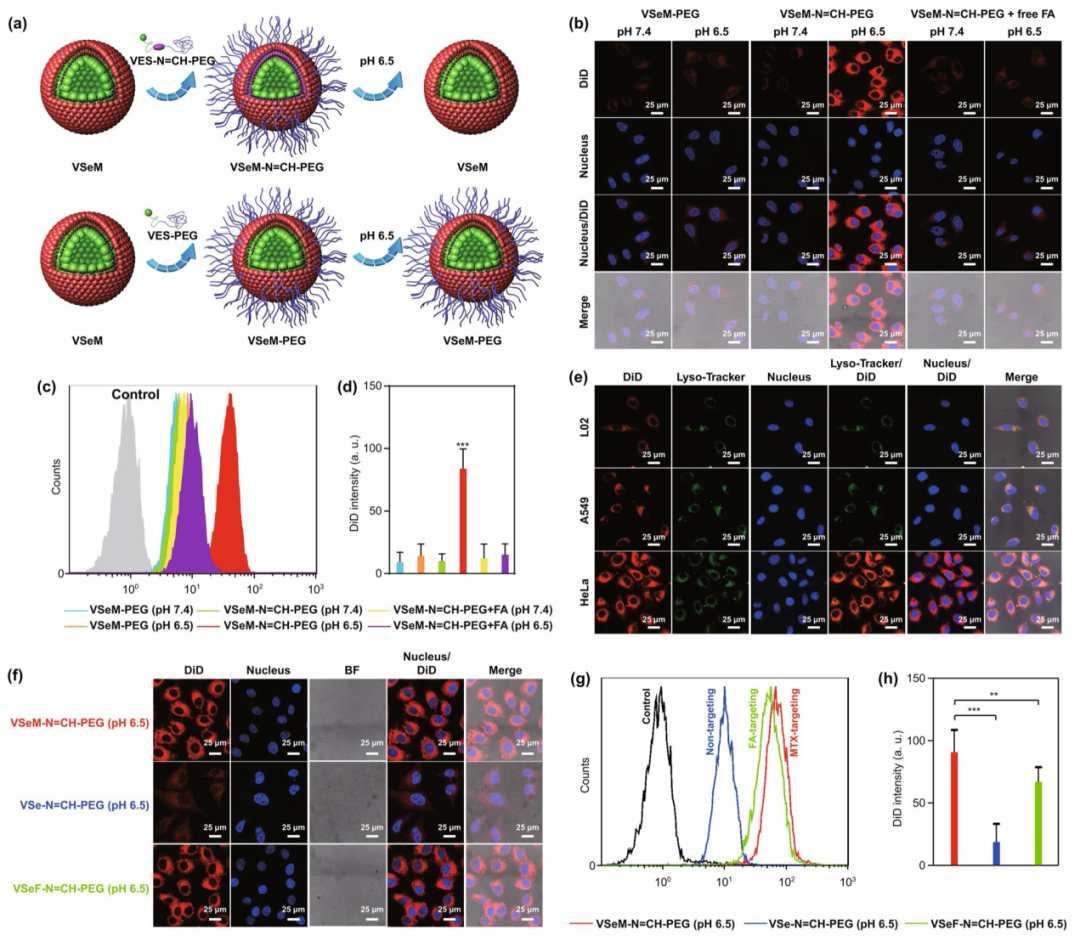
为研究纳米前药的细胞摄取能力,纳米前药与叶酸受体高表达的HeLa细胞共孵育4 h,结果发现肿瘤微酸响应VSeM-N=CH-PEG在pH 6.5相较于在pH 7.4下,细胞摄取效率增强约8倍;相较于此,对肿瘤微酸不敏感的VSeM-PEG在两种pH下,细胞摄取效率没有显著性差异(图3a-d)。结果表明靶向能力来源于pH变化下MTX配体的暴露。而且,在pH 6.5下,相较于HeLa细胞,A549和L02细胞对纳米前药的摄取能力显著降低,归因于叶酸受体在A549和L02细胞膜表面上的更低表达(图3e)。此外,HeLa细胞对VSeM-N=CH-PEG和叶酸靶向的VSeF-N=CH-PEG的摄取能力没有明显区别(图3f-g)。这些结果证实VSeM-N=CH-PEG纳米前药具备优异的肿瘤微酸响应的自靶向激活能力。
图3. VSeM-N=CH-PEG的肿瘤微酸响应的自靶向激活和细胞摄取:(a) VSeM-N=CH-PEG和VSeM-PEG分别在肿瘤微酸条件下的靶向激活和失活示意图;(b-d) HeLa细胞与负载DiD的VSeM-PEG,VSeM-N=CH-PEG在经叶酸有/无前处理、pH 7.4/6.5条件下共同孵育4 h后的(b) 激光共聚焦图、(c) 流式曲线图、(d) 平均荧光强度;(e) L02、A549、HeLa细胞与负载DiD的 VSeM-N=CH-PEG在pH 6.5条件下共同孵育4 h后的激光共聚焦图;(f-g) HeLa细胞与负载DiD的VSe-N=CH-PEG,VSeF-N=CH-PEG,VSeM-N=CH-PEG在pH 6.5条件下共同孵育4 h后的(f) 激光共聚焦图、(g) 流式直方图、(h) 平均荧光强度。
IV pH/ROS级联响应VSeM-N=CH-PEG纳米前药的体外抗癌活性
为研究纳米前药的细胞杀伤能力,纳米前药与HeLa细胞共孵育24 h以测定细胞存活率。结果发现VSeM-N=CH-PEG(pH/ROS响应性)相较于VCM-N=CH-PEG(ROS不敏感性)和VSeM-PEG(pH不敏感性)在pH 6.5条件下对HeLa和MCF-7两种肿瘤细胞具有更强的杀伤能力(图4a, b)。此外,在pH 7.4和6.5条件下,VSeM-PEG对HeLa和MCF-7两种肿瘤细胞的杀伤能力没有显著差异;对比之下,VSeM-N=CH-PEG在pH 6.5相较于在pH7.5条件下,细胞杀伤能力显著增强(图4c, d)。这些结果进一步证实VSeM-N=CH-PEG优异的肿瘤微酸响应的自靶向激活能力。线粒体去极化(图4e)和细胞氧化应激(图4f)显示VSeM-N=CH-PEG组相较于VCM-N=CH-PEG和VSeM-PEG组而言,细胞内ROS水平含量和capsase-9/caspase-3活性显著上调,ATP水平含量显著下调。结果表明VSeM-N=CH-PEG能够有效阻断ATP供应,进而通过线粒体功能异常触发程序性细胞死亡。细胞凋亡(图4g)和活死细胞染色(图4h)结果进一步证实VSeM-N=CH-PEG增强性抗肿瘤活性来源于肿瘤微酸性触发自靶向激活、循环放大的ROS触发药物突释和线粒体功能异常。
图4. VSeM-N=CH-PEG的体外抗肿瘤效果:(a) HeLa和(b) MCF-7细胞与VES/MTX,VCM-N=CH-PEG,VSeM-PEG,VSeM-N=CH-PEG在pH 6.5下共孵育24 h后的细胞存活率;(c) HeLa和(d) MCF-7细胞与VSeM-PEG和VSeM-N=CH-PEG在pH 7.4和6.5下共孵育24 h后的细胞存活率;(e-h) HeLa细胞与VES/MTX,VCM-N=CH-PEG,VSeM-PEG,VSeM-N=CH-PEG在pH 6.5下共孵育12 h后的(e) 线粒体去极化;(f) 细胞氧化应激;(g) 细胞凋亡;(h) 活死细胞染色。
V pH/ROS级联响应VSeM-N=CH-PEG纳米前药的体内生物分布和肿瘤蓄积
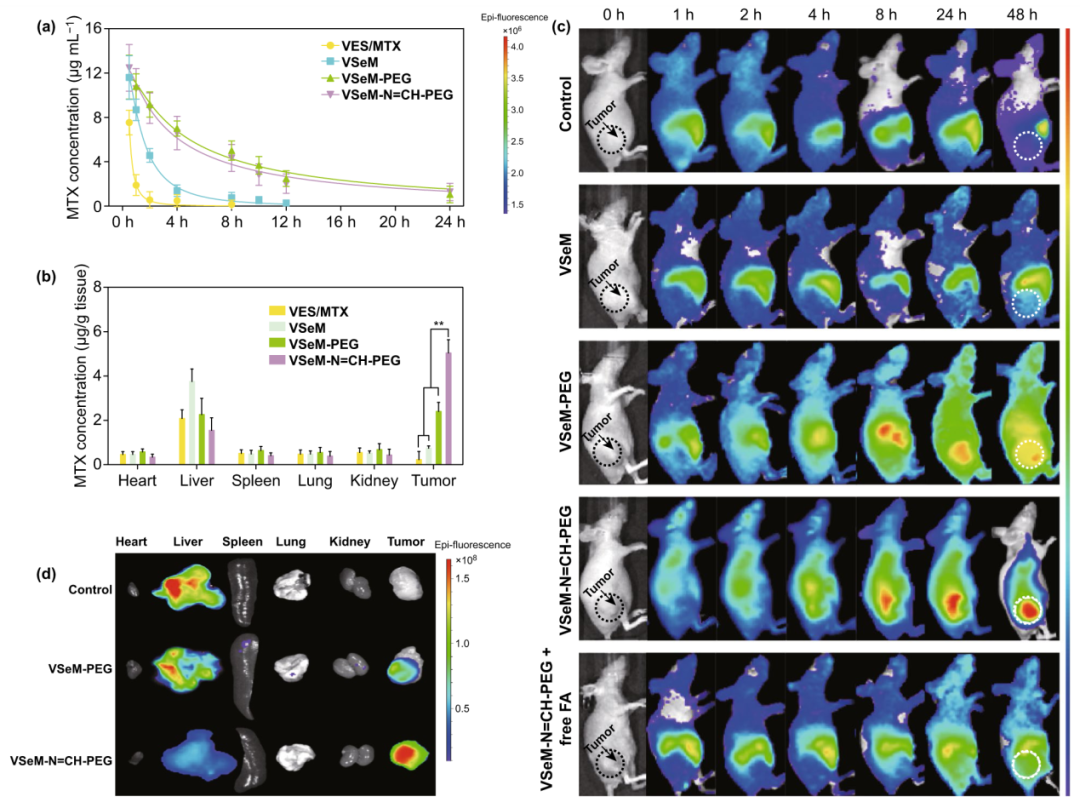
构建HeLa荷瘤裸鼠模型,纳米前药经尾静脉注射入裸鼠体内后,不同时间点收集血液测定血药浓度,分析药代动力学参数。结果表明VSeM-PEG和VSeM-N=CH-PEG组相较于VES/MTX和VSeM组,血液循环时间显著延长(图5a)。生物分布实验表明VSeM-N=CH-PEG组相较于VES/MTX、VSeM、VSeM-PEG组,肿瘤部位的药物含量显著更高(图5b)。活体/离体荧光成像实验表明相较于负载DiR的VSeM和VSeM-PEG,负载DiR的VSeM-N=CH-PEG在肿瘤部位的荧光信号显著更强(图5c, d),该结果证实肿瘤微酸响应PEG的表面嵌入能够显著提高维生素E纳米前药在肿瘤部位的富集程度。
图5. VSeM-N=CH-PEG的药代动力学、生物分布、肿瘤蓄积效果:HeLa荷瘤裸鼠静脉注射VSeM-N=CH-PEG的(a) 药代动力学曲线和(b) 生物分布效果;HeLa荷瘤裸鼠静脉注射负载DiR的VSeM-N=CH-PEG的(c) 0-48 h活体荧光成像图和(d) 48 h后离体荧光成像图。
VI pH/ROS级联响应VSeM-N=CH-PEG纳米前药的体内抗肿瘤效果
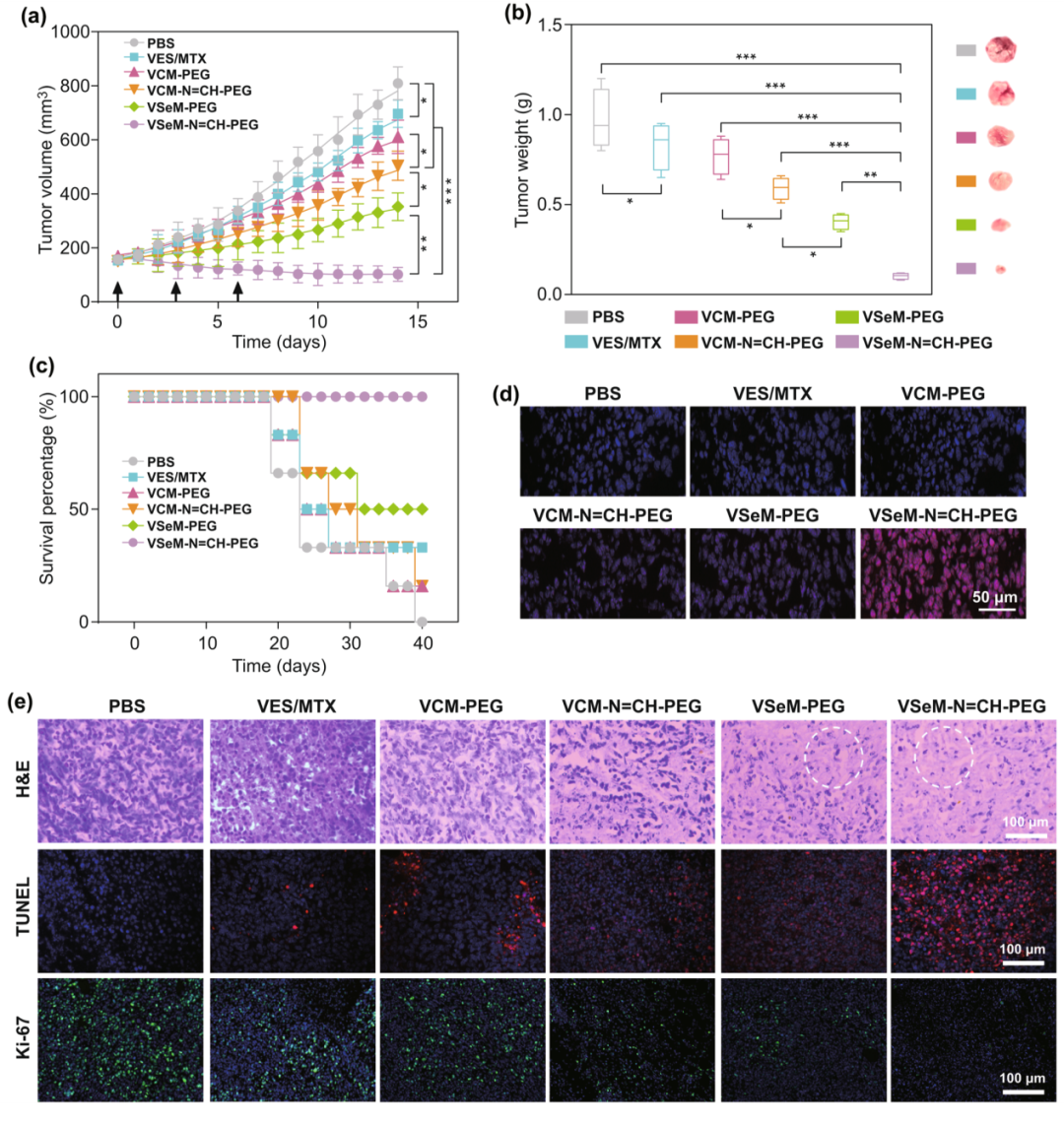
纳米前药经尾静脉注射入裸鼠体内后,为期14天的抑瘤实验研究表明VSeM-N=CH-PEG注射组相较于VES/MTX小分子混合物,VCM-N=CH-PEG,VSeM-PEG,VSeM-N=CH-PEG注射组表现出显著更强的肿瘤增殖抑制能力(图6a, b)和显著更高的动物生存率(图6c)。此外,VSeM-N=CH-PEG注射组相较于其他组,肿瘤组织内ROS产生能力显著更高(图6d)。而且,H&E、TUNEL、Ki-67染色结果进一步证实VSeM-N=CH-PEG的优异抗肿瘤结果(图6e),这归因于VSeM-N=CH-PEG纳米前药中自靶向激活与ROS循环放大之间的级联集成。
图6. VSeM-N=CH-PEG的体内抗肿瘤效果:(a) 肿瘤体积变化曲线;(b) 治疗结束第14天肿瘤体重和肿瘤照片;(c) 动物生存率;(d) 肿瘤切片的细胞内ROS水平;(e) 肿瘤切片的H&E、TUNEL、Ki-67染色图。
 刘小龙 研究员
刘小龙 研究员
本文通讯作者
中国科学院福建物质结构研究所&
福建医科大学孟超肝胆医院
从事肿瘤早期诊断新技术与新方法、免疫治疗与精准医学方面的基础与临床转化研究。
▍主要研究成果
主持国家自然科学基金“重大科研仪器研制项目”、重点项目、面上项目、国家传染病防治科技重大专项等科研项目;以通讯作者在Advanced Science, ACS Nano, Clinical Cancer Research, Nature Communications, Small等杂志发表论文90多篇;入选福建省百人计划、福建省卫生健康突出贡献中青年专家,荣获2015年日本肿瘤学会青年科学家奖、2019年福建省科学技术进步一等奖。
▍Email: xiaoloong.liu@gmail.com
 刘景丰 研究员
刘景丰 研究员
本文通讯作者
中国科学院福建物质结构研究所&
福建医科大学孟超肝胆医院
从事肝胆外科、肝移植及肝癌综合治疗的相关临床及转化医学研究工作。
▍主要研究成果
主持完成国家自然科学基金、国家传染病防治科技重大专项及省部级科研项目20多项;以通讯作者在Lancet Gastroenterology & Hepatology, Journal of Clinical Oncology, Cell Research, Advanced Science, ACS Nano, Clinical Cancer Research, Small等杂志发表论文100多篇;入选新世纪百千万人才工程国家级人选、国务院政府特殊津贴、福建省劳动模范、福建省科技创新领军人才、国家卫健委突出贡献中青年专家。荣获国家科技进步二等奖和福建省科技进步一等奖。
▍Email: drjingfeng@126.com

Nano-Micro Letters《纳微快报》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2019 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前15%)。2019 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
Tel:021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 无载体纳米前药:自靶向激活和ROS循环放大实现肿瘤的氧化-化疗协同治疗

 刘小龙 研究员
刘小龙 研究员 刘景丰 研究员
刘景丰 研究员
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用