Near-Infrared Light-Responsive Nitric Oxide Delivery Platform for Enhanced Radioimmunotherapy
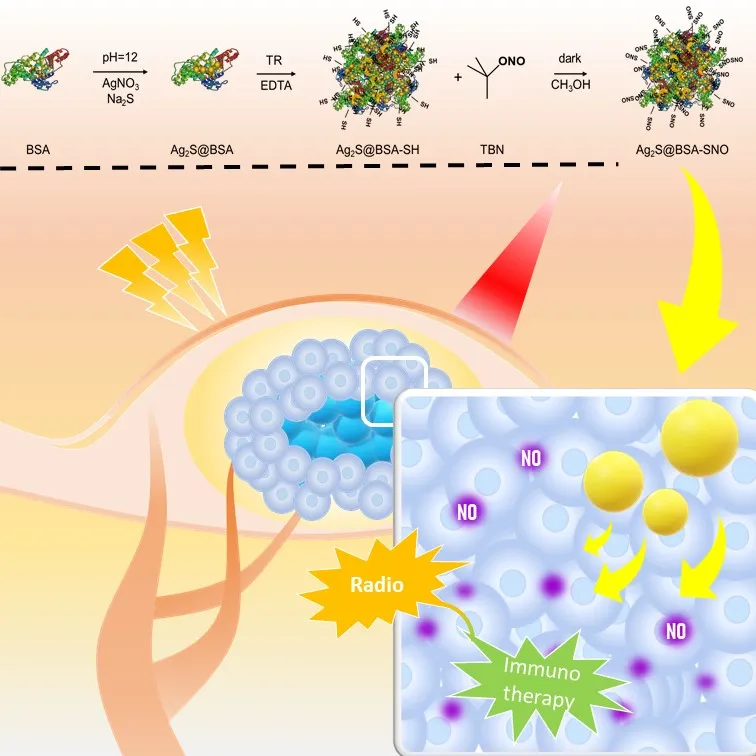
这一体系选取了蛋白质这一生物相容性极好、来源广泛、又具有特异性的物质作为载体,通过对蛋白质表面基团的修饰,引入一氧化氮供体基团(-SNO)该基团具有热响应性及光响应性,高温时会释放一氧化氮。为了提高一氧化氮释放效率,采用生物矿化的方法在蛋白质空腔中合成硫化银量子点,利用硫化银量子点的光热性能,释放一氧化氮。
该纳米颗粒通过被动靶向富集到肿瘤部位,808 nm波长激光照射引起光热从而导致一氧化氮的释放,进一步的,一氧化氮增强放疗的效果,成功消除NOD小鼠皮下4T1肿瘤。随后,我们使用模式抗原OVA作为载体,合成的Ag2S@OVA-SNO纳米颗粒能够有效增强小鼠的抗肿瘤免疫反应。该体系能够实现一氧化氮的有效控释,增敏肿瘤放疗-免疫治疗,并通过改变蛋白质载体,实现特异性的免疫增强。
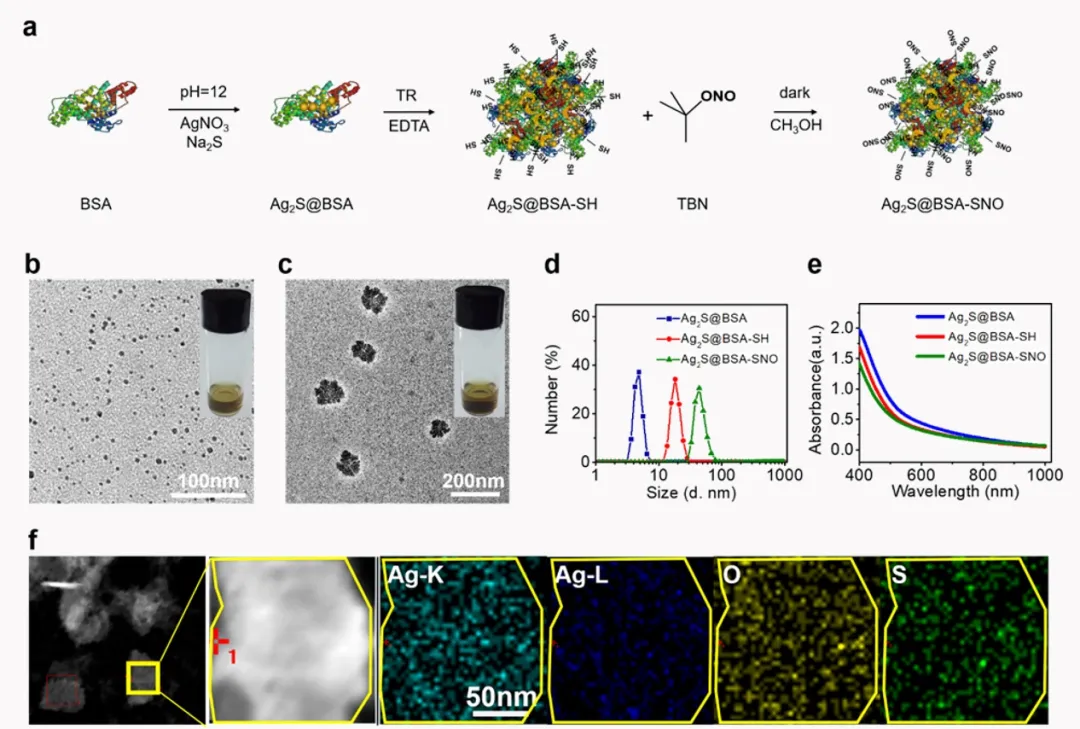
首先,采用生物矿化的方法合成Ag2S@BSA纳米颗粒,参考Yang等人的工作选取55℃下合成的Ag2S@BSA进行下一步的制备。使用Traut’s reagent将蛋白进行巯基化修饰,再与亚硝基叔丁酯进一步反应引入-SNO功能基团,作为一氧化氮供体。对合成过程中的每一步产物进行基本表征,最终产物的粒径主要分布在50 nm左右,该体系在近红外波段有较平稳的吸收。
II Ag2S@BSA-SNO纳米颗粒的性能测试及体外实验
首先测试了Ag2S@BSA-SNO的光热转换情况,与文献报道一致,含有Ag2S的纳米颗粒在808 nm波长激光照射下升温,其温度变化随着浓度的升高而增加,并具有一定的光热稳定性。此外,该光热材料还具有光声信号,在730 nm波长下具有与浓度相关的广生信号强度变化,可用于活体内材料富集的监测。不同温度下的一氧化氮释放和光热控释的一氧化氮释放情况也通过试剂盒进行了检测,37℃下该体系尚能保持稳定,但是该纳米颗粒能够在激光引发的光热作用下有效释放一氧化氮。细胞克隆实验结果证明了一氧化氮的释放能够增敏放疗,大大降低肿瘤细胞的存活率。通过DNA染色实验,证明了该过程大概率由NO阻碍 DNA损伤修复引起。
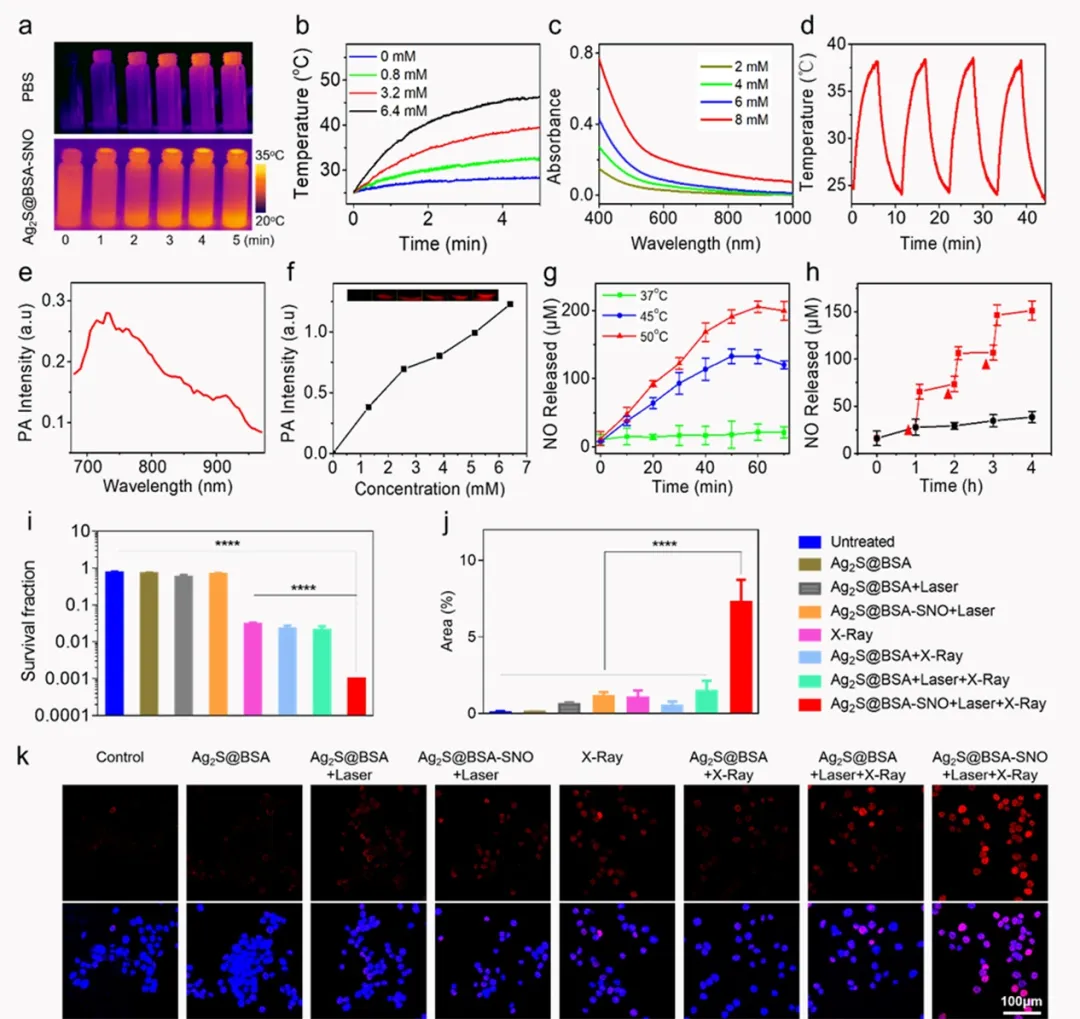
图2. 材料的特性表征。a)808 nm波长激光照射下Ag2S@BSA-SNO溶液和PBS溶液的红外热成像;b)不同浓度的Ag2S@BSA-SNO溶液在相同功率的808 nm波长激光照射下的温度变化曲线;c)不同浓度的Ag2S@BSA-SNO溶液的紫外-可见光吸收图谱;d)多次激光开/关循环引起的Ag2S@BSA-SNO溶液温度变化曲线;e,f)Ag2S@BSA-SNO的光声信号及其与浓度的关系;g)不同温度下一氧化氮的释放情况;h)多次激光刺激引起NO的阶段性释放;i)细胞克隆统计结果,图例同图j;j,k)DNA损伤染色实验的定量及定性数据。
III Ag2S@BSA-SNO体系的体内富集、升温和抗肿瘤疗效

图3.材料的富集和活体上肿瘤的放疗增敏。a,b)肿瘤内的光声信号图及强度变化曲线;c,d)808 nm激光器照射尾静脉注射不同材料后的肿瘤部位,得到的红外热成像图及温度变化曲线;e,f,g)肿瘤治疗实验中肿瘤生长曲线,存活率统计及体重变化;h)不同组别处理后未完全消失的肿瘤部位切片HE染色图。
IV Ag2S@OVA-SNO体系的肿瘤放疗-免疫治疗联合治疗
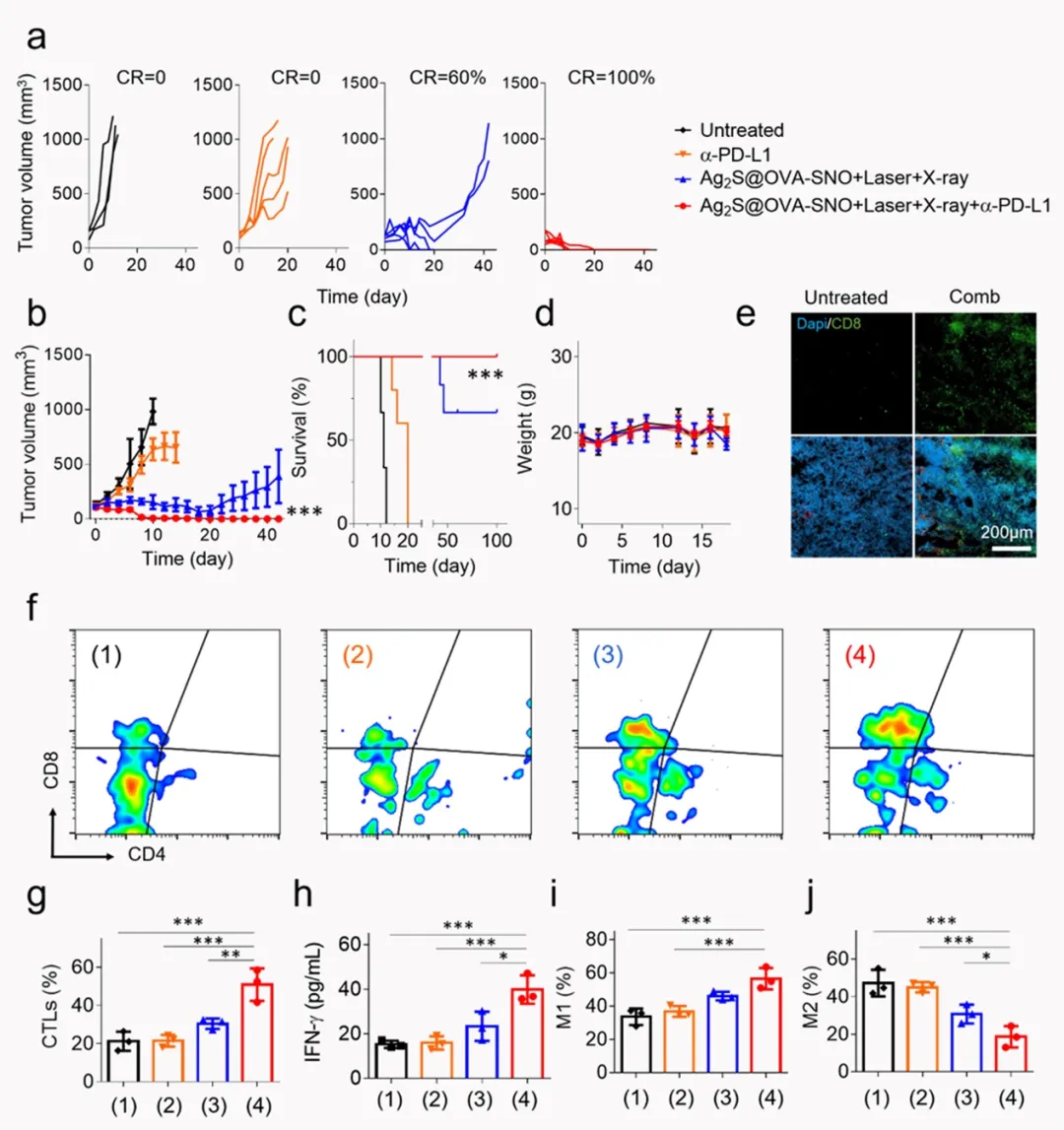
图4. Ag2S@OVA-SNO的增强肿瘤放疗-免疫治疗联合治疗的疗效及评价。a)单只小鼠肿瘤生长曲线;b)不同组别的小鼠肿瘤生长曲线统计图;c)小鼠存活率统计;d)小鼠体重记录;e)肿瘤部位切片,染色CD8+ T细胞,联合治疗组的CD8+信号明显高于对照组;f,g)不同组别小鼠肿瘤组织中CTLs的典型流式图及统计图;h)不同组别小鼠血清中IFN-γ水平;i,j)流式分析肿瘤部位巨噬细胞分型。
 孟周琪 博士后(2017-2019)
孟周琪 博士后(2017-2019)
本文通讯作者
苏州大学功能纳米与软物质研究院
 汪超 教授
汪超 教授
本文通讯作者
苏州大学功能纳米与软物质研究院
E-mail:editorial_office@nmletters.org
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 肿瘤放疗增敏+免疫治疗:基于纳米AgS的多功能近红外光热控释一氧化氮体系
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用