Rapid Isolation and Multiplexed Detection of Exosome Tumor Markers Via Queued Beads Combined with Quantum Dots in a Microarray
Nano-Micro Lett. (2019) 11:59
https://doi.org/10.1007/s40820-019-0285-x
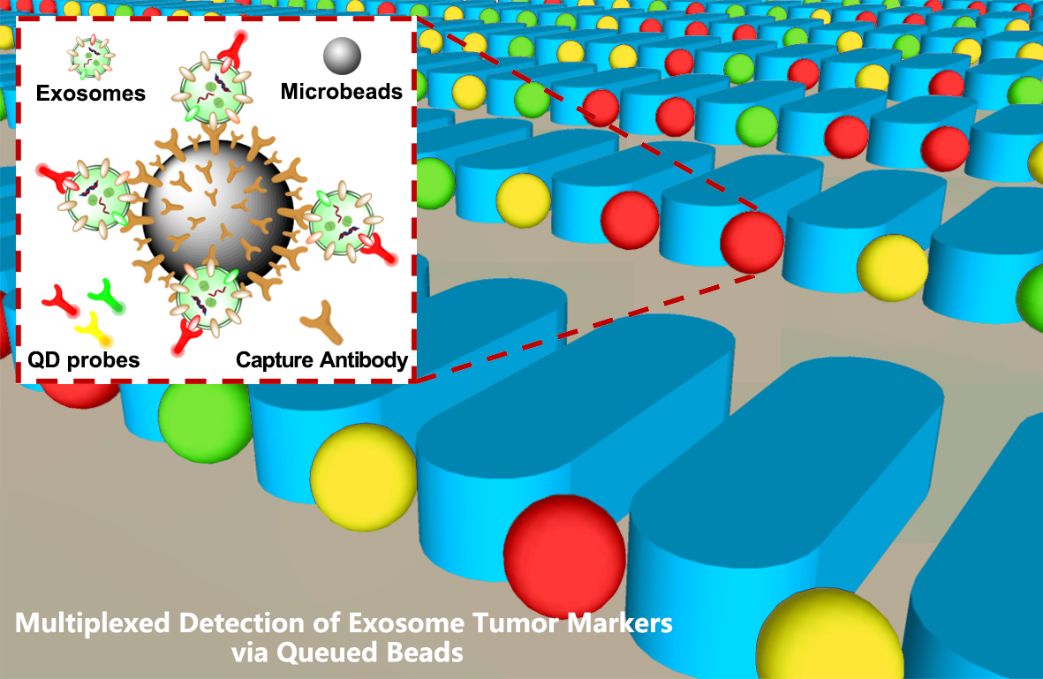
2 捕获外泌体的微珠被均匀排布在微柱之间,避免了光学干扰,使测试结果更加准确;
3 不同类型的肺癌外泌体样品显示出独特的标志物表达水平。
这种设计通过将光学信号分散到每颗微珠上,从而避免了光学干扰,使测试结果更为准确。
同时分析了三种肺癌细胞和正常细胞培养上清液中的外泌体,并且采用三种QD探针标记不同肺癌标志物,对外泌体表面蛋白标志物进行多重检测。来源于肺癌细胞的荧光强度显著高于正常细胞(6~10倍),并且不同类型的肺癌细胞也显示出其独特的标记物表达水平。
此外,使用该芯片对癌症患者的临床血样进一步验证,显示与常规血清标志物检测较好的一致性。这些结果为外泌体肿瘤标志物检测和早期肿瘤诊断提供了一种有前景的解决方案。
由于它们尺寸较小、机制复杂,且受限于当前分离和检测方法,因此影响了其研究的进展。与传统方法相比,微流体技术提供了更好的分析方法。
单一的标志物检测使其在敏感性和特异性方面都受到了限制;因此,我们针对三种肺癌相关标志物进行了多重检测:CEA,腺癌中最常见的广谱肿瘤蛋白标志物;Cyfra21-1,鳞状细胞癌常用标志物;ProGRP,特异的,分泌活跃的小细胞肺癌细胞产物。
使用抗CD9标记的微珠分离来自A549,H226,H446和HUVEC等细胞培养上清液的外泌体,并且分别用相应的肿瘤标志物抗体标记的三个QD探针用于检测微珠表面上的外泌体。
从图1a中可以看出,肺癌细胞与正常细胞间的荧光强度存在较大差异(RPMI 1640作为阴性对照)。如图1b所示,我们对三种肺癌标志物的平均表达水平进行了分析。结果显示, 与正常细胞相比,肺癌细胞显示出更高的荧光强度(6~10倍)。
此外,不同的肺癌细胞显示出明显不同的标志物表达水平,根据各个肺癌蛋白标志物的表达情况可以初步实现对肺腺癌,肺鳞癌,小细胞肺癌这三种肺癌的分型, 这为进一步的肿瘤分类提供了可能。
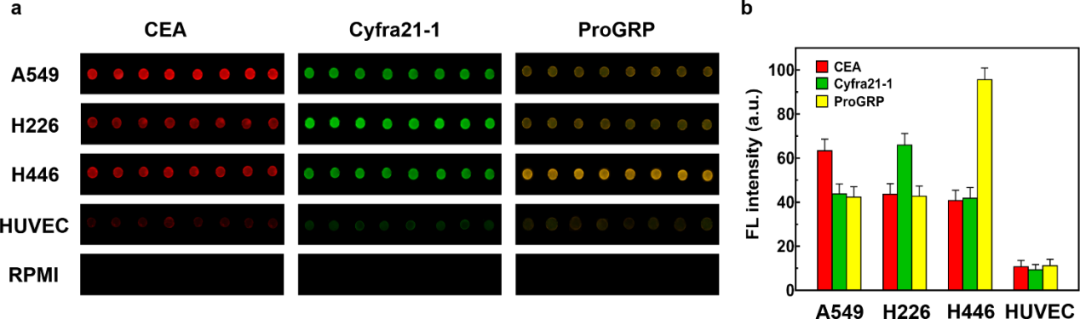 图1 (a) 不同细胞系外泌体使用三种不同的肿瘤特异性QD探针检测的荧光图像;(b) 三种肺癌标志物在不同细胞系的表达水平。
图1 (a) 不同细胞系外泌体使用三种不同的肿瘤特异性QD探针检测的荧光图像;(b) 三种肺癌标志物在不同细胞系的表达水平。
▍血浆外泌体肿瘤标志物的检测验证
进一步利用该芯片对临床血浆样本进行验证,检测样本包含10个临床肿瘤标志物检测异常的肺癌患者样本和10个健康对照样本。
如图2a所示,肺癌样本标志物的表达水平显著高于健康对照组;然而,我们没有观察到不同肺癌类型与不同标志物表达水平的相关性,这可能是由于血浆样本的成分较为复杂以及检测样本较少。
如图2b所示,我们采用了ROC曲线对诊断准确性进行了评估,结果显示CEA、Cyfra21-1和ProGRP的AUC分别为0.84、0.85和0.84。表明血浆外泌体在肺癌患者和健康对照的鉴别中具有较好的准确性。
为了评估芯片的检测效果,我们将10例肺癌患者的CEA-QD探针表达水平与临床应用电化学发光免疫法检测的血液中CEA浓度进行了比较。结果如图2c所示,实验结果与临床数据有较好的一致性,说明我们检测方法的可靠性。
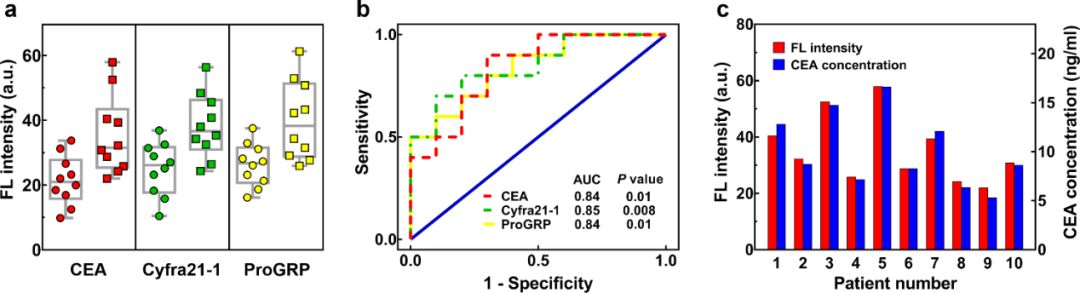
图2 (a) 肺癌患者(方形)和健康对照(圆形)临床血浆外泌体的三种肿瘤标志物的表达水平;(b) 三种肺癌外泌体标记物多重检测的ROC曲线(CEA:AUC = 0.84,p =0.01;Cyfra21-1:AUC = 0.85,p = 0.008;ProGRP:AUC= 0.84,p = 0.01;置信区间为95%);(c) 本方法测定的外泌体CEA表达水平与临床免疫法检测CEA浓度的比较。
与现有的微流控方法相比,我们的芯片具有以下优点:(1) 本设计能够在相邻微柱间拦截微珠而不堵塞,避免游离荧光信号的干扰;(2) 采用QDs进行免疫检测,提高了荧光稳定性,并可进行多重生物标志物的检测;(3) 该芯片结构简单,分离检测简便,无需外场,可实现低成本快速检测。

毛红菊
研究员、博士生导师
中国科学院上海微系统与信息技术研究所
传感技术联合国家重点实验室课题组负责人
多年来一直从事生物传感器及纳米技术用于生物大分子检测的研究工作。
▍主要研究成果
负责研发的“丙型肝炎诊断试剂盒”获得了国家一类新药证书(国药证S20060022),在临床上得到较好的应用。
作为课题负责人及科研骨干,承担及参与了国家973计划、国家重点研发计划、中科院重大创新工程项目、国家自然科学基金和上海市重大项目等30多个重要项目,形成多项重要研究成果。现为国家重点研发计划、国家自然科学基金等项目课题负责人,负责多项国家重大课题的研究。
近年来在本领域主流期刊及国内外会议发表论文100余篇,作为主要发明人申请及授权专利40余项,参编专著和教材5部(英文专著1部)。
E-mail: hjmao@mail.sim.ac.cn

白亚楠
博士
中国科学院上海微系统与信息技术研究所
传感技术联合国家重点实验室
主要从事微纳生物传感技术用于生物大分子检测的研究工作。
▍主要研究成果
作为科研骨干,参与了国家973计划、国家重点研发计划、中科院STS项目、上海市科委国际合作项目以及国家自然科学基金等多个重要项目的研发。在本领域主流期刊发表SCI论文10余篇,申请或授权发明专利5项。
E-mail: albert.bai@foxmail.com
生物医学应用 · 往期回顾 👇
1 体内肿瘤的靶向检测与治疗:基于SiO2中空核-壳纳米结构的双模态PET/光学成像系统
2 肿瘤的光热及光动力联合治疗:吲哚菁绿色修饰的磁性普鲁士蓝纳米复合药物系统
3 癌症标志物检测:基于纳米牛血清白蛋白功能化的石墨烯生物传感器
E-mail:editorial_office@nmletters.org
Tel:86-21-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 肿瘤诊断焕发“芯”生!微阵列芯片快速分离、多重检测外泌体肿瘤标志物
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用