研究背景
氢气中的杂质(烷烃、水、氧以及碳的氧化物等)会迅速毒化高密度固态储氢材料,所以氢气在储存前需先纯化到99.999%,从而增加氢应用的成本,进而限制许多不同来源氢气的再利用。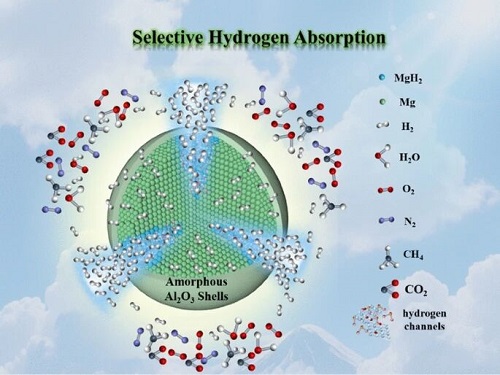
Solid-state hydrogen storage materials with excellent selective hydrogen adsorption in the presence of alkane, oxygen , and carbon dioxide by atomic layer amorphous Al₂O₃ encapsulation
Fanqi Bu, Zhenyu Wang,* Ali Wajid, Rui Zhai, Ting Liu, Yaohua Li, Xin Ji, Xin Liu, Shujiang Ding, Yonghong Cheng, Jinying Zhang*
Nano-Micro Letters (2026)18: 78
https://doi.org/10.1007/s40820-025-01934-7
本文亮点
1. 性能飞跃:本研究通过镁基固态储氢颗粒表面封装纳米厚度无定形Al₂O₃,在保证高的储氢密度和储释氢动力学热力学的基础上(起始释氢温度185℃,快速释氢温度~250℃,释氢密度>6 wt%),实现了固态储氢材料对CH₄,CO₂, H₂O, O₂和N₂的隔离,实现了氢气的选择性吸附而不破坏。
2. 技术革新:利用原子层沉积技术实现固态储氢材料微观封装,从而使高密度固态储氢材料在含有杂质气体的条件下实现选择性吸附,并保持高的储氢密度以实现氢气的高效储运,在用氢时释放出纯氢,实现氢气的纯化存储一体化技术。
3. 应用前景广阔:本研究不仅可以降低氢气的纯化的要求从而降低成本,也可以应用于工业副产氢的再利用,甚至可能用于氢气的纯化,能够大大降低氢储存再利用的成本。
内容简介
针对高密度固态储氢对氢气纯度要求高的问题, 西安交通大学张锦英等人通过原子层沉积技术在高活性镁基固态储氢颗粒外成功构建了纳米级非晶Al₂O₃封装层,在保证储氢动力学和储氢密度的基础上实现了氢气的选择性吸附。研究发现该复合体系不仅在空气暴露2个月后未水解、氧化,同时在含10% CH₄ (3 MPa,100℃) 、0.1%O₂+0.4%N₂ (1.6 MPa,100℃)以及0.1%CO₂+0.4%N₂ (1.6 MPa,100℃)的混合氢气中可实现稳定选择性吸氢。吸/放氢行为、物相转变、元素分析以及分子动力学仿真等证明复合体系水氧隔离性以及氢气选择吸附特性可归因于具有合适空隙的非晶Al₂O₃封装层对H₂的选择渗透性以及对H₂O、CH₄、O₂、N₂以及CO₂的选择阻隔性。该研究成功构建了具有温和反应温度、快速动力学、稳定水氧隔离以及氢气选择性吸附的镁基固态储氢体系,可大大降低氢气存储成本,并实现不同来源氢气的再利用,具有广阔应用前景与巨大经济价值。
图文导读
I 选择性氢存储固态储氢材料的制备
本研究通过原子层沉积(ALD)技术成功制备了具有微纳封装的MgH₂-ZrTi@Al₂O₃复合材料。首先在商用MgH₂表面沉积10nm ZrO₂层,随后与少层Ti₃C₂按照19:1的重量比进行球磨复合,得到MgH₂-ZrTi基底材料。接着通过ALD工艺在MgH₂-ZrTi表面包覆无定形Al₂O₃保护层。通过控制循环次数,最终获得具有5nm、10nm和20nm不同厚度Al₂O₃壳层的系列样品,分别命名为MgH₂-ZrTi@5nmAl₂O₃、MgH₂-ZrTi@10nmAl₂O₃ 和MgH₂-ZrTi@20nmAl₂O₃。此外,对300°C脱氢后的MgH₂-ZrTi同样包覆10nm Al₂O₃,制备得到非氢状态的Mg-ZrTi@10nmAl₂O₃对比样品。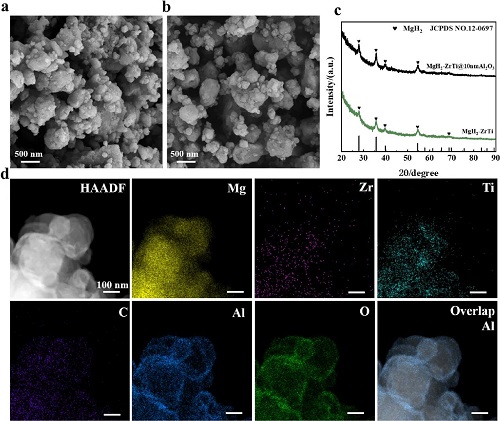
图1. MgH₂-ZrTi和MgH₂-ZrTi@10nmAl₂O₃的表征。(a)和(b)为MgH₂-ZrTi和MgH₂-ZrTi@10nmAl₂O₃的扫描电子显微镜(SEM)图像。(c)为MgH₂-ZrTi(绿色)和MgH₂-ZrTi@10nmAl₂O₃(黑色)的X射线衍射(XRD)谱图。(d)为MgH₂-ZrTi@10nmAl₂O₃的HAADF-STEM及元素面分布分析。
通过引入富含氧空位的Zr、Ti组分,成功制备出具有低反应温度、快速动力学及稳定循环性能的MgH₂-ZrTi复合材料。采用原子层沉积技术在其表面构建无定形Al₂O₃壳层,实现了中温条件下(75-100℃)的选择性氢吸附。SEM显示原始MgH₂-ZrTi颗粒呈不规则形状,约90%颗粒分布在100-500nm范围内,极少部分可达1μm(图1a);沉积Al₂O₃后未观察到形貌或尺寸分布变化(图1b),表明ALD过程未引起颗粒熔融或生长。X射线衍射(XRD)分析(图1c)证实包覆前后仅检测到MgH₂特征衍射峰(27.9°、35.7°、39.9°、54.6°和68.8°),未出现脱氢/氧化产物或Al₂O₃结晶峰,证明ALD过程未损害储氢材料且壳层呈无定形特征,这与ALD制备金属氧化物的典型特征一致。HAADF-STEM及元素分析(图1d)清晰观察到Al、O元素以原子层厚度均匀包覆于颗粒表面,而Zr、Ti、C元素则作为氢通道均匀分布于颗粒内部。
将ALD沉积得到的MgH₂-ZrTi@Al₂O₃样品直接暴露在空气中,暴露时间分别设置为1天、1周、1个月、2个月和3个月。平均气温为15 °C,平均湿度为25% RH。
II 非晶态Al₂O₃涂层对MgH₂-ZrTi的屏蔽效应
MgH₂-ZrTi在暴露于空气1天后脱氢性能显著恶化,如在275°C等温脱氢中仅释放0.036 wt% H₂(图S3a),而暴露前在相同温度下6分钟内释放6.20 wt% H₂;温度程序脱氢(TPD)中,暴露后即使到400°C也只释放1.10 wt% H₂,而暴露前到300°C即释放6.40 wt% H₂(图S3b)。然而,MgH₂-ZrTi@Al₂O₃在暴露后未检测到明显变化,变化小于0.2 wt%,其脱氢曲线在等温(0-400 s,图2a)和TPD(100-280°C,图2b)中均重叠, MgH₂-ZrTi@10nmAl₂O₃暴露后在275°C的500 s内释放4.87 wt% H₂(图2a)。MgH₂-ZrTi@20nmAl₂O₃在暴露前/后于275°C的25分钟内分别释放4.23/4.31 wt% H₂(图2a),脱氢温度也随厚度增加而有所升高(图2b)。ZrO₂和Ti₃C₂组分的质量比约为11 wt%。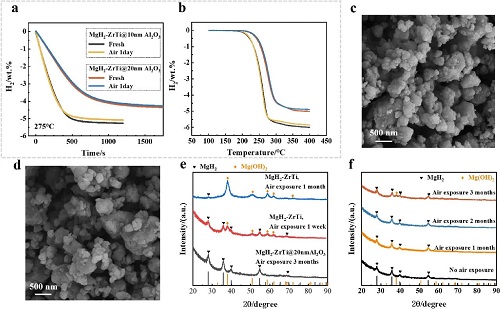
图2. (a) 等温脱氢(275 °C)和 (b) 程序升温脱氢(TPD)曲线:MgH₂-ZrTi@10nmAl₂O₃(新鲜—黑色,暴露于空气1天—黄色)与MgH₂-ZrTi@20nmAl₂O₃(新鲜—红色,暴露于空气1天—蓝色)在空气暴露1天前后的测试结果。MgH₂-ZrTi@10nmAl₂O₃暴露于空气(c)1个月和(d) 2个月的扫描电子显微镜(SEM)图像。(e) MgH₂-ZrTi、MgH₂-ZrTi@20nmAl₂O₃,以及 (f) MgH₂-ZrTi@10nmAl₂O₃在不同空气暴露时间前后的X射线衍射(XRD)谱图。
MgH₂-ZrTi暴露于空气后XRD清晰检测到Mg(OH)₂特征(图2e),其强度随暴露时间增加而上升,与氢存储性能下降一致;通过定量分析表明,暴露一周后Mg(OH)₂杂质约占34%。而MgH₂-ZrTi@5nmAl₂O₃暴露一周后未检测到Mg(OH)₂。相比之下,MgH₂-ZrTi@10nmAl₂O₃和MgH₂-ZrTi@20nmAl₂O₃即使暴露2至3个月也未检测到MgO或Mg(OH)₂(图2e, f),但MgH₂-ZrTi@10nmAl₂O₃在暴露3个月后出现微弱Mg(OH)₂衍射峰(图2f)。此外,MgH₂-ZrTi@10nmAl₂O₃暴露1个月(图2c)和2个月(图2d)后无形态变化,且在调整空气条件(15°C至25% RH到30°C和50% RH)下暴露3周后也未检测到Mg(OH)₂。MgH₂-ZrTi@5nmAl₂O₃、MgH₂-ZrTi@10nmAl₂O₃和MgH₂-ZrTi@20nmAl₂O₃分别能在暴露空气1周、2个月和3个月后保持完整而无明显氧化,证明10 nm Al₂O₃涂层能有效防止MgH₂-ZrTi因暴露于空气(H₂O和O₂)而降解。
III 在CH₄、O₂、N₂和CO₂杂质存在下MgH₂-ZrTi@10nmAl₂O₃的氢选择性吸附
MgH₂-ZrTi@10nmAl₂O₃在含10%甲烷的氢气(10% CH₄ + 90% H₂)中表现出良好的氢选择性吸附,其在75°C、30 bar下3小时内吸附约4.79 wt% H₂(图3a),略低于纯氢气(99.999%)下的5.00 wt%(图3a),氢化动力学在杂质氢气中稍慢,归因于实时氢气压力较低,因为通过MgH₂-ZrTi@10nmAl₂O₃在30 bar纯氢气和35 bar 10% CH₄ + 90% H₂下的氢化曲线重叠得到证实。然而,无Al₂O₃壳的MgH₂-ZrTi在10% CH₄ + 90% H₂下的吸附密度远低于纯氢气,在1小时内仅吸附3.91 wt% H₂(图S10),而纯氢气下为4.71 wt%(图S10),且其吸附容量随循环次数增加而衰减,第二次和第三次循环分别吸附3.48 wt%和3.18 wt%。此外,吸氢后CH₄与MgH₂-ZrTi颗粒反应,MgH₂-ZrTi表面出现鱼鳞状无定形碳结构。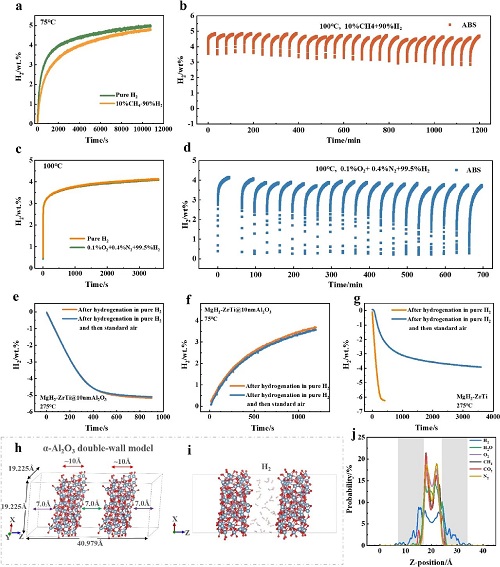
图3. (a) MgH₂-ZrTi@10nmAl₂O₃在75 °C下、纯H₂和10% CH₄+90% H₂气氛(30 bar)中的等温吸附曲线。(b) MgH₂-ZrTi@10nmAl₂O₃在100 °C下、10% CH₄+90% H₂气氛中的等温循环吸附曲线。(c) MgH₂-ZrTi@10nmAl₂O₃在纯H₂和0.1% O₂+0.4% N₂+99.5% H₂气氛(16 bar,100 °C)中的等温吸附曲线。(d) MgH₂-ZrTi@10nmAl₂O₃在100 °C下、0.1% O₂+0.4% N₂+99.5% H₂气氛中的等温循环吸附曲线。(e) 等温脱氢和 (f) 再氢化曲线:MgH₂-ZrTi@10nmAl₂O₃在纯H₂氢化后,于75 °C下在21% O₂+79% N₂中处理1 h(蓝线),与仅在纯H₂中(橙线)的情况对比。(g) 在275 °C下,MgH₂-ZrTi在纯H₂中氢化后(橙线),以及在纯H₂氢化后于75 °C下在21% O₂+79% N₂ 中处理1 h(蓝线)后等温脱氢曲线。(h) 双层α-Al₂O₃模型,由两个平行平板组成;(i) 模拟H₂分子在两个 Al₂O₃平板之间的渗透;(j) 不同气体分子沿z方向的比例分布。
MgH₂-ZrTi@10nmAl₂O₃在10% CH₄ + 90% H₂气氛下于75°C、100°C和125°C均展现出优异的吸附性能,1小时内分别吸收3.86 wt%、5.33 wt%和5.85 wt% H₂,且在100°C和125°C下吸附曲线约在4分钟达到拐点,分别吸收4.33 wt%和4.84 wt% H₂。此外,该材料在含甲烷气氛中具有出色的循环稳定性,其第1次和第5次吸附曲线几乎完全重叠,75°C下第1和第5次循环分别吸收3.98 wt%和3.89 wt% H₂;在100°C下经历30次循环后仍保持高容量,第10、20和30次循环分别吸收4.86 wt%、4.72 wt%和4.71 wt% H₂,容量保持率高达96.9%(图3b)。因此,MgH₂-ZrTi@10nmAl₂O₃在10% CH₄ + 90% H₂ 的杂质氢气氛围中具有优异的选择性吸氢性能。
MgH₂-ZrTi@10nmAl₂O₃在含O₂和N₂的氢气气氛中也展现出优异的选择性吸附性能。其在0.1% O₂ + 0.4% N₂ + 99.5% H₂(100°C, 16 bar)下的等温再氢化曲线与纯氢气下的曲线重叠(图3c),1小时内吸附约4.10 wt% H₂;而无Al₂O₃壳的MgH₂-ZrTi在相同杂质气氛下性能显著衰减。其循环稳定性也较为优异,在100°C下进行的三次氢化曲线几乎重叠,并且第10次和第20次循环仍分别吸附3.94 wt%和3.70 wt% H₂,第20次循环容量保持率达89.4%(首次氢化容量为4.14 wt%,图3d)。而MgH₂-ZrTi的循环性能显著下降,在第1、2和3个循环中,在1小时内分别吸收了2.52、1.93和1.33 wt%的H₂。XRD分析表明,氢化后的MgH₂-ZrTi@10nmAl₂O₃仅检测到MgH₂和Mg,而无保护的MgH₂-ZrTi则检测到MgO,证明Al₂O₃壳层能有效阻止MgH₂/Mg与O₂反应生成MgO,从而在含O₂和N₂气氛中实现出色的选择性氢吸附。
在高氧浓度环境下,为避免氢气与氧气直接混合引发爆炸风险,本工作采用两步法进行测试:先在纯H₂氛围下加热样品,再于同样温度条件下置于21% O₂ + 79% N₂混合气中加热,随后测试其脱氢与再氢化性能。结果显示,包覆10nmAl₂O₃的MgH₂-ZrTi@10nmAl₂O₃样品在经过该高氧氛围处理后,其等温脱氢与再氢化曲线与纯氢环境下几乎完全重叠(图3e-f),说明Al₂O₃壳层有效阻止了氧气渗透与氧化反应的发生,保持了氢化/脱氢的完全可逆性。相反,未包覆的MgH₂-ZrTi样品在纯氢加热后,经同样的高氧气氛暴露1 h后性能明显退化。其275°C脱氢仅释放2.59 wt% H₂(图3g),容量下降近一半。因此,可以推断在高氧气氛下,Al₂O₃包覆层起到关键的化学屏蔽作用。无定形Al₂O₃致密且惰性,阻断了O₂与MgH₂之间的接触反应途径,使得复合体系在强氧化环境中仍能维持稳定的氢化脱氢性能。该结果进一步验证了Al₂O₃层对O₂的极高阻隔能力,是维持材料长期稳定性的核心因素。
在二氧化碳存在的氢气环境中,传统MgH₂极易与CO₂反应生成碳酸镁(MgCO₃)等产物,从而导致储氢反应不可逆。本研究对比了有无Al₂O₃壳层的两类样品在含CO₂杂质气体中的吸氢行为。未包覆的MgH₂-ZrTi样品在纯H₂气氛(100°C,30 bar)下0.5h可吸附约5.25 wt% H₂(图S21a,绿线);但在0.1% CO₂ + 0.4% N₂ + 99.5% H₂气氛中,其首轮吸氢量骤降至1.66 wt%,第二轮仅0.75 wt%(图S21a,蓝线和橙线),几乎失去储氢能力。而包覆有10 nm Al₂O₃的MgH₂-ZrTi@10nmAl₂O₃样品在相同气氛条件下表现出优异的选择性吸附性能。其吸氢曲线与纯氢气下几乎重合,三轮循环吸氢量分别为4.05 wt%、4.01 wt%、3.92 wt%,无明显衰减,也未检测到MgCO₃或MgO的形成。这一结果清楚表明,非晶Al₂O₃壳层能有效阻隔CO₂分子进入储氢颗粒内部,防止其与MgH₂反应;同时其内部微孔结构允许H₂快速渗透,从而实现“氢气通行、CO₂阻断”的选择性渗透特性。
进一步通过分子动力学模拟也支持该结论:在双层α-Al₂O₃模型中(图3h),为了加速气体渗透,在每种情况下,在两个Al₂O₃板之间插入 40 个气体分子(图3i)。模拟在800 K下进行。仅H₂分子能穿透两层间距约7 Å的壳层,而CO₂、CH₄、O₂、N₂等分子被限制在表面或浅层区域,说明H₂在该结构中的扩散自由能最低。因此,在含CO₂的复杂氢气环境中,MgH₂-ZrTi@Al₂O₃复合材料仍能保持稳定吸氢能力,实现高纯度氢的选择性存储与释放。
IV 非晶态Al₂O₃涂层下MgH₂-ZrTi的整体储氢性能
MgH₂-ZrTi@Al₂O₃复合体系在纯氢气中表现出优异的储氢热力学与动力学性能。其中,MgH₂-ZrTi@5nmAl₂O₃和MgH₂-ZrTi@10nmAl₂O₃(图4a,红色和绿色)的脱氢起始温度为185°C,明显低于纯MgH₂(约290°C),并且其TPD曲线在185°C到275°C几乎重叠,说明Zr/Ti组分的引入有效降低了氢化物的反应势垒且MgH₂-ZrTi@5nmAl₂O₃和MgH₂-ZrTi@10nmAl₂O₃的脱氢性能类似。除此之外可以观察到,由于Al₂O₃没有储氢能力,随着沉积的Al₂O₃厚度增大,MgH₂-ZrTi@Al₂O₃的最大储氢容量和脱氢速率逐渐减小,起始脱氢温度逐渐升高(图4a-b)。就MgH₂-ZrTi@5nmAl₂O₃和MgH₂-ZrTi@10nmAl₂O₃来看,储氢性能比MgH₂-ZrTi@20nmAl₂O₃都高,分别为6.39 wt%和6.00 wt%。尽管MgH₂-ZrTi@5nmAl₂O₃的最大储氢容量和脱氢速率等动力学因素比MgH₂-ZrTi@10nmAl₂O₃较好些,然而前者的屏蔽效应比后者差(图4a-b)。综合考虑到动力学,储氢密度和屏蔽效应,可以认为MgH₂-ZrTi@10nmAl₂O₃的整体储氢性能最好。
随着温度从225℃升高到300℃,MgH₂-ZrTi@10nmAl₂O₃的脱氢速率显着加快(图4c)。发现 MgH₂-ZrTi@10nmAl₂O₃在250°C下的脱氢几乎在30分钟内完成,释放出约5 wt%的H₂,起始脱氢率为0.297 wt% min⁻1(在前600秒内)。在275°C,10分钟内释放了约5.13 wt%,起始脱氢速率(前600秒内)高达0.683 wt% min⁻1。当温度进一步升高到300°C时,MgH₂-ZrTi@10nmAl₂O₃的脱氢曲线在3分钟内达到拐点,释放4.93wt%H₂。MgH₂-ZrTi@10nmAl₂O₃在10%CH₄+90%H₂和0.1%O₂+0.4%N₂+99.5%H₂气氛中再氢化后的脱氢能力略低于在纯H₂气氛中再氢化后的脱氢能力(图S26),这归因于在100℃吸氢过程中吸氢能力有限。MgH₂-ZrTi@10nmAl₂O₃也获得了优异的加氢性能(图4d)。ZrTi@10nmAl₂O₃在125°C下的氢化动力学(图4d,红色)与 100°C下的氢化动力学相似。MgH₂-ZrTi@10nmAl₂O₃已被证明在75至100°C之间快速加氢的能力,这在未来可以通过有效利用太阳能来实现。在相同的数据截取条件下,MgH₂-ZrTi@10nmAl₂O₃的转变点之前的平均加氢速率和前10分钟内的初始脱氢速率均已被证明比报道的空气稳定镁基复合材料好得多(图4e,f)
长期循环实验表明,MgH₂-ZrTi@10nmAl₂O₃在275°C脱氢、275°C再氢化的条件下连续50次循环后,储氢容量仍然保持在95%左右,无明显滞后现象。脱氢峰温与强度在多次循环后几乎不变,而未包覆样的主峰逐渐上移并衰减,说明Al₂O₃壳层有效防止表面氧化(图4g)。SEM/EDS结果显示循环后包覆层仍连续致密,Al、O元素分布均匀,无裂纹剥落(图4h)。这些结果说明Al₂O₃包覆不仅提升了化学稳定性,也增强了颗粒结构完整性。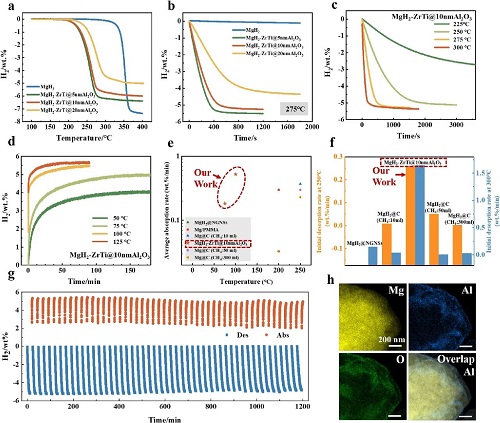
图4. (a)MgH₂、MgH₂-ZrTi@5nmAl₂O₃、MgH₂-ZrTi@10nmAl₂O₃和MgH₂–ZrTi@20nmAl₂O₃的TPD和(b)等温脱氢(275 °C)曲线。MgH₂-ZrTi@10nmAl₂O₃在不同温度下的等温(c)脱氢和(d)再氢化(30 bar H₂)。(e) MgH₂-ZrTi@10nmAl₂O₃的平均再氢化率和 (f) 初始脱氢率(250 °C和300 °C)与已知的优异空气稳定性镁基复合材料相比。(g) MgH₂-ZrTi@10nmAl₂O₃ 的等温脱氢(275 °C/0.05 bar)和再氢化(275 °C/30 bar H₂)循环曲线。(h) 50次循环后 MgH₂-ZrTi@10nmAl₂O₃的EDS元素图分析。
V MgH₂-ZrTi@Al₂O₃选择性吸附的机理分析
为探究MgH₂-ZrTi@10nmAl₂O₃的脱氢动力学,采用动力学模型快速筛选法拟合其在275 ℃下的等温脱氢曲线(图4c、S24a、S25a)。结果表明,R2(二维相界)模型最符合纯H₂下再氢化样品的脱氢过程,其斜率(1.017)与截距(-0.0048)最接近理想值(图5a)。基于275 ℃脱氢数据,对样品在30 bar 10% CH₄ + 90% H₂及16 bar 0.1% O₂+0.4% N₂+ 99.5% H₂气氛中再氢化后的动力学进行拟合,R2模型仍表现最佳,说明再氢化气氛对动力学影响不大。
进一步依据30 barH₂中再氢化样品的等温脱氢数据,采用R2模型计算表观活化能(图5b、c)。三组g(α)-时间曲线均呈良好线性,验证了R2模型的适用性。所得脱氢活化能Ea为105.92 kJ mol⁻1,略高于MgH₂-ZrTi的97.77 kJ mol⁻1,与其脱氢速率稍慢(图4a、b)相符。MgH₂-ZrTi@10nmAl₂O₃在多种气氛(30 bar H₂、10% CH₄ + 90% H₂、0.1% O₂ + 0.4% N₂ + 99.5% H₂)下的动力学均符合R2模型。
研究证明,在无定形ZrO₂和FL-Ti₃C₂的协同作用下,MgH₂和Mg之间的转化反应在MgH₂颗粒表面快速发生,并建立了有效的氢通道。H₂分子首先通过无定形Al₂O₃壳扩散,在储氢颗粒表面形成MgH₂/Mg界面,并通过氢通道以均匀的速度移动到颗粒内部。MgH₂/Mg界面的移动由无定形ZrO₂和FL-Ti₃C₂的共同催化以及H₂分子穿过无定形Al₂O₃壳层的渗透速率决定,这是MgH₂-ZrTi@10nmAl₂O₃脱氢动力学的关键因素。通过TEM以及HRTEM图像在再氢化/脱氢后在MgH₂-ZrTi@10nmAl₂O₃的表面上清楚地观察到无定形Al₂O₃壳(图5d & e),这种防止MgH₂-ZrTi与杂质反应的现象体现了MgH₂-ZrTi@10nmAl₂O₃鲁棒特性。从脱氢MgH₂-ZrTi@10nmAl₂O₃的HRTEM图像中观察到对应于Mg(102)面的0.19 nm晶面间距(图5e),而在再氢化过程中观察到对应于MgH₂(101)面的晶面间距为0.25 nm。再氢化/脱氢后仍然观察到无定形Al₂O₃壳(图5e),进一步证实了它们在再氢化/脱氢过程中的稳定性。Al₂O₃壳的非晶态特征与其XRD特征非常一致(图5f)。通过HAADF-STEM和相应的元素分析进一步验证了MgH₂-ZrTi@10nmAl₂O₃在再氢化/脱氢过程中的结构稳定性(图5g)。经过脱氢(图5g)和再氢化后,在MgH₂-ZrTi@10nmAl₂O₃颗粒表面仍然清晰地观察到由Al和O元素组成的壳状结构,进一步证实了Al₂O₃壳的坚固性。没有观察到MgH₂-ZrTi@10nmAl₂O₃颗粒的尺寸变化,表明脱氢或再氢化处理没有发生颗粒熔化或生长。稳定的结构特别有利于MgH₂-ZrTi@10nmAl₂O₃的稳定动力学,与MgH₂-ZrTi@10nmAl₂O₃优异的循环性能具有很好地一致性(图4g)。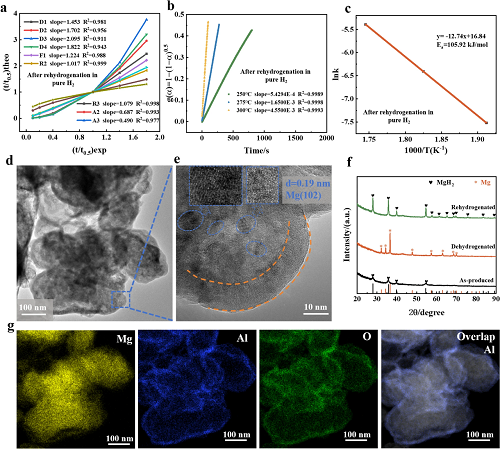
图5. (a)各种动力学模型275 °C下MgH₂-ZrTi@10nmAl₂O₃的(t/t0.5)theo 与(t/t0.5)exp的关系。(b) MgH₂-ZrTi@10nmAl₂O₃在不同温度下R2模型g(α)的时间依赖性。(c) MgH₂-ZrTi@10nmAl₂O₃脱氢动力学的Arrhenius图。脱氢后 MgH₂-ZrTi@10nmAl₂O₃的(d) TEM、(e) HRTEM和(g)相应的元素图谱分析。(f) MgH₂-ZrTi@10nmAl₂O₃再氢化/脱氢前后的XRD图谱。
VI 总结
本研究通过原子层沉积(ALD)技术在镁基固态储氢材料(MgH₂-ZrTi)颗粒表面成功构建了纳米级非晶Al₂O₃封装层,实现了在含CH₄、O₂、N₂和CO₂等杂质气体的氢气环境中对H₂的高效选择性吸附。该复合结构不仅有效阻隔了H₂O、O₂、CO₂和CH₄等杂质气体的渗透,防止材料中毒与氧化,同时保持了优异的储氢密度(>6 wt%)与快速的吸/脱氢动力学。系统实验表明,10 nm厚的Al₂O₃包覆层在空气中暴露数月仍能维持结构完整性与储氢性能,并在含杂质氢气中展现出良好的循环稳定性。分子动力学模拟进一步揭示了非晶Al₂O₃层对H₂的选择性渗透机制。该研究突破了传统固态储氢对氢气纯度的高要求,为实现低成本、一体化的氢气纯化-存储-再利用提供了可行的技术路径,对推动工业副产氢的高效利用具有重要应用价值。
作者简介

关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 西交大张锦英等:原子层非晶态Al₂O₃封装实现固态储氢材料的氢气选择性吸附
 Nano-Micro Letters
Nano-Micro Letters 南科大曾林/韩美胜等综述:水凝胶电解质赋能锌离子电池的新进展
南科大曾林/韩美胜等综述:水凝胶电解质赋能锌离子电池的新进展 韩国忠南大学Sangbaek Park等:核壳MOF限域锂离子溶剂化构筑高温长效锂金属电池
韩国忠南大学Sangbaek Park等:核壳MOF限域锂离子溶剂化构筑高温长效锂金属电池 上海交大朱利民&沈道智&苏言杰等综述:可吸收环境水分子能量的吸湿性新材料
上海交大朱利民&沈道智&苏言杰等综述:可吸收环境水分子能量的吸湿性新材料 NML封面文章 | 三波段调节与分体式设计智能光伏窗构建全季候绿色节能建筑
NML封面文章 | 三波段调节与分体式设计智能光伏窗构建全季候绿色节能建筑