研究背景
随着全球患病率的上升和巨大的经济影响,糖尿病带来了重大的医疗保健挑战,需要有效的管理策略。可穿戴技术的快速发展为无创糖尿病监测提供了有前途的方法,利用皮肤界面可采集的生物体液,可反映表明代谢健康的各种生化标志物。新兴的可穿戴生物传感器越来越多地采用多路复用传感功能,可以同时检测多种生化和生理信号。微流体技术、生物相容性和柔性材料以及传感器小型化的进步显着提高了这些设备的准确性、舒适性和实用性。为了持续监测健康并对疾病进行分析预测,利用人工智能算法可实现实时分析、预测建模和个性化健康洞察,为糖尿病管理提供主动干预机会。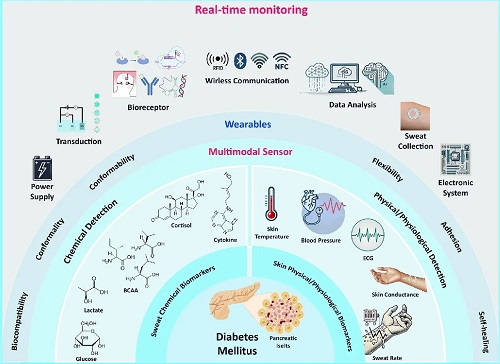
Noninvasive On-Skin Biosensors for Monitoring Diabetes Mellitus
Ali Sedighi, Tianyu Kou, Hui Huang & Yi Li*
Nano-Micro Letters (2026)18: 16
https://doi.org/10.1007/s40820-025-01843-9
本文亮点
1. 对基于汗液的生化和生理生物标志物的无创糖尿病监测的最新进展进行全面评估。
2. 重点强调多模态传感器设计、材料科学、生物识别元件和集成技术方面的创新,以提高实时糖尿病管理的准确性、情境感知和可靠性。
3. 深入分析了人工智能驱动的生物传感系统、标准化协议以及监管和伦理框架,以实现自主、安全和个性化的糖尿病护理。
内容简介
糖尿病是一个重大的全球健康问题,推动了对传统血糖监测方法的无创替代方案的需求。可穿戴技术的最新进展引入了能够分析汗液和皮肤生物标志物的皮肤接口生物传感器,为糖尿病诊断和监测提供了创新的解决方案。英国曼彻斯特大学Yi Li等人全面讨论了无创可穿戴生物传感器的当前发展,强调同时检测生化生物标志物(如葡萄糖、皮质醇、乳酸、支链氨基酸和细胞因子)和生理信号(包括心率、血压和出汗率),以实现准确、个性化的糖尿病管理。作者探索多模态传感器设计、材料科学、生物识别元件和集成技术方面的创新,强调高级数据分析、人工智能驱动的预测算法和闭环治疗系统的重要性。此外,本综述还解决了生物标志物验证、传感器稳定性、用户合规性、数据隐私和监管考虑方面的持续挑战。基于此,下一代可穿戴生物传感器实现的整体、多模式方法在改善患者预后和促进糖尿病管理中的主动医疗保健干预方面具有巨大潜力。
图文导读
I 概述
图1. 用于糖尿病监测的皮肤接口可穿戴传感器概述图。
图1展示了用于糖尿病监测的皮肤界面可穿戴传感器整体框架,清晰呈现该类传感器从生物识别到数据应用的核心工作流程与关键组成。其核心包含生物受体(如酶、抗体等),可特异性识别汗液中的葡萄糖、皮质醇等糖尿病相关生物标志物;信号转换模块将生物识别信号转化为可测的电信号或光信号;多模态传感器集成了生化检测(如葡萄糖、乳酸)与生理信号监测(如心率、血压、皮肤电导率)。同时,图中体现了传感器的关键性能要求,如贴合性、柔韧性、生物相容性以确保长期佩戴舒适;还涵盖数据采集、无线传输至终端设备,再经数据分析生成健康反馈的全链路,最终为糖尿病患者提供实时、个性化的健康管理支持,直观展现了多技术融合实现无创糖尿病监测的原理与应用逻辑。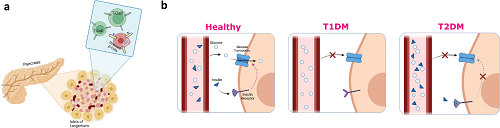
图2. 糖尿病的病理机制。a T1DM糖尿病的示意图;b 正常生理、T1DM 和 T2DM 的比较示意图。
图2聚焦糖尿病(T1DM 与 T2DM)的病理机制,通过对比清晰呈现健康状态与两种糖尿病类型的生理差异。图2a 为 1 型糖尿病(T1DM)示意图:T 细胞经血液进入胰腺胰岛,在高胰岛素需求或炎症作用下对胰岛 β 细胞产生损伤,最终导致 β 细胞被自身免疫破坏,无法分泌胰岛素,进而引发胰岛素缺乏与高血糖。图 2b 对比正常生理状态、T1DM 与 T2DM 的核心差异:健康状态下,胰岛素可激活葡萄糖转运体,促进血液中葡萄糖的清除;T1DM 患者因 β 细胞功能衰竭,完全无法产生胰岛素,葡萄糖无法被细胞摄取;T2DM 患者则因长期胰岛素过量分泌,导致胰岛素受体脱敏,即便有胰岛素分泌,细胞对葡萄糖的摄取能力仍会受损,直观揭示了两种糖尿病的不同致病路径与生理影响。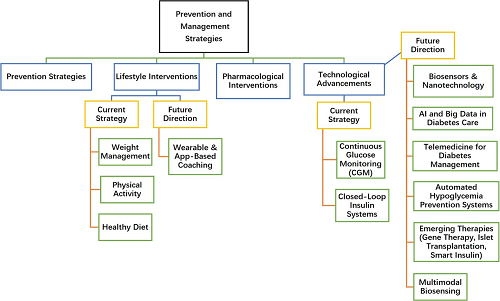
图3. 糖尿病预防和管理策略综合框架及当前策略和未来方向。
图 3 展示了糖尿病预防与管理策略的综合框架。在当前策略层面,涵盖生活方式干预(体重管理、体育锻炼、健康饮食)、药物干预(传统胰岛素注射、口服降糖药等),以及初步技术应用(可穿戴设备与 APP 监测、连续血糖监测 CGM)。未来方向则聚焦创新突破,包括多模态生物传感技术、闭环胰岛素输送系统、人工智能与大数据在糖尿病管理中的应用,还有胰岛移植、智能胰岛素等前沿疗法。通过整合现有干预手段与新兴技术,形成从预防(如前期筛查)到管理(实时监测、个性化治疗)的全链条方案,旨在解决传统管理中患者依从性低、监测不及时等问题,为精准化、主动化的糖尿病医疗提供方向。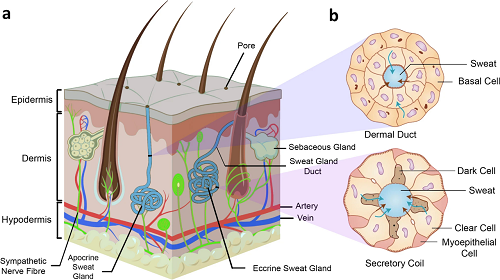
图4. 皮肤和汗液分泌的生理学。a人体皮肤结构示意图;b真皮管和分泌线圈横截面图。
图4 围绕皮肤生理结构与汗液分泌机制展开,。图4a 为人体皮肤三层结构示意图,主要包括表皮(保护屏障)、真皮(含毛囊、汗腺等,是汗液生成核心)、皮下组织(保温缓冲)等结构。图4b为汗腺结构细节,主要为分泌卷曲部与导管:分泌卷曲部由暗细胞、亮细胞和肌上皮细胞构成,暗细胞参与汗液生成,亮细胞主要分泌水和电解质,肌上皮细胞收缩可推动汗液排入导管;导管由基底细胞衬里,负责将汗液输送至皮肤表面或毛囊(顶泌汗腺),直观揭示汗液从生成到排出的生理过程,为汗液采样与生物标记物检测提供机制支撑。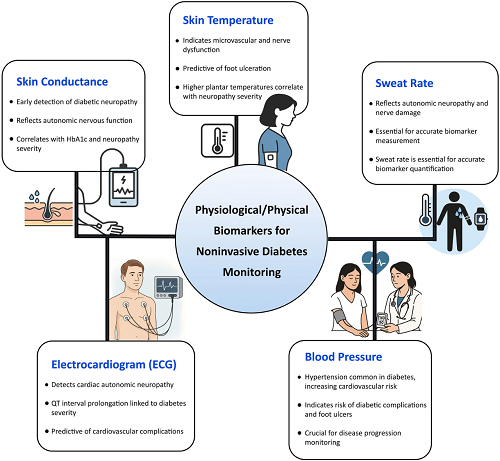
图5. 与糖尿病管理的无创可穿戴监测相关的关键生理和物理生物标志物概述。
图 5 聚焦无创糖尿病监测相关的关键生理与物理生物标志物,系统梳理各标志物的功能,涵盖皮肤温度(反映微血管与神经功能,可预测足部病变,助力早期发现糖尿病神经病变)、皮肤电导率(体现自主神经功能,与神经病变严重程度相关)、出汗率(反映自主神经病变与神经损伤,和糖化血红蛋白及神经病变程度相关,且对生物标志物精准测量至关重要),还有心电图(检测心脏自主神经病变,QT 间期延长与糖尿病严重程度相关)、血压(糖尿病患者常伴高血压,可提示心血管风险及足部溃疡风险,对病情进展监测关键)。这些标志物从不同维度为糖尿病管理提供互补信息,支撑个性化诊疗。
II 可穿戴化学生物传感器
2.1 酶传感器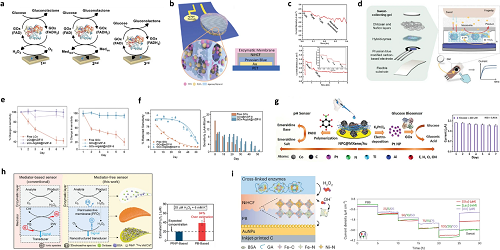
图6. 酶传感器。a 电化学葡萄糖生物传感器的发展世代;b 纳米纹理葡萄糖传感器的示意图;c 工作电极及葡萄糖传感器;d 基于葡萄糖氧化酶(GOx)的传感器组件及基于触摸式指尖汗液的葡萄糖检测装置;e 一周内乳酸与葡萄糖检测灵敏度的变化情况;f 50 天储存期内葡萄糖检测灵敏度的变化情况;g 包含葡萄糖传感器与 pH 传感器的工作电极功能化修饰流程及葡萄糖生物传感器的长期稳定性数据;h 基于普鲁士蓝(PB)的电酶传感器与无介体电酶传感器的反应示意图;i 酶促代谢物传感器的作用机制;在磷酸盐缓冲液(PBS)与汗液样本中,酶促葡萄糖传感器、乳酸传感器及尿酸(UA)传感器的长期稳定性数据。
图 6a 呈现电化学葡萄糖生物传感器的三代发展:第一代依赖酶促反应产物(如过氧化氢)检测,受氧气浓度影响大;第二代用人工氧化还原介体(如二茂铁、普鲁士蓝)传递电子,降低氧气依赖;第三代借助纳米材料(碳纳米管、MOFs)实现酶与电极直接电子转移,无需介体,提升灵敏度与稳定性。图6 b、c 的纳米纹理电极与多孔膜设计,解决酶逃逸问题,保障长期检测稳定性;图6d-f 的 GOx-Argdot@mZIF-8 纳米复合材料,通过扩大孔径提升分析物接触效率,增强传感器灵敏度;图6g-i 的纳米多孔碳 – MXene 异质结构、铂纳米颗粒修饰多壁碳纳米管及普鲁士蓝稳定策略,分别实现酶活性保护、抗干扰检测与多标志物(葡萄糖、乳酸、尿酸)长期稳定监测,直观呈现酶促传感器在材料创新、结构设计上的突破,为可穿戴汗液检测设备提供技术参考。
2.2 基于抗体的生物传感器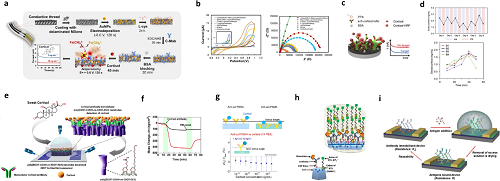
图7. 基于抗体的生物传感器。a线程式电化学皮质醇免疫传感器工作电极的制备示意图及b循环伏安曲线(CV)与电化学阻抗谱(EIS);c基于亲和作用的电化学皮质醇传感器的构建及传感策略;d 一名健康受试者 6 天内的汗液皮质醇昼夜节律,以及 3 名未经过体能训练的受试者与1名经过训练的受试者在恒负荷骑行运动中的皮质醇监测数据;f 皮质醇传感器、涂覆聚(EDOT-COOH – 共 – EDOT-EG3)的有机电化学晶体管(OECT)通道层及涂覆聚(EDOT-COOH – 共 – EDOT-EG3)纳米管的 OECT 通道层的质量变化;g 抗体嵌入聚苯乙烯 – 甲基丙烯酸(PSMA)聚合物基质的结构示意图,以及抗皮质醇 PSMA 在不同皮质醇浓度下的阈值电压变化(ΔVR);h 基于汗液的可穿戴诊断生物传感器示意图;i 该生物传感技术的总结图示。
图7 聚焦抗体基生物传感器,展示其在糖尿病相关生物标志物(如皮质醇、细胞因子)检测中的设计、结构及应用,含多类传感器示意图与性能数据。图7a呈现线程式电化学皮质醇免疫传感器的电极制备流程,通过 L – 半胱氨酸、金纳米颗粒等修饰提升表面积与电子传递效率,实现皮质醇精准检测;另有基于激光诱导石墨烯电极的传感器,借竞争性免疫法降低检测限。还有有机电化学晶体管、场效应晶体管等平台,通过功能化修饰增强对皮质醇、细胞因子的检测灵敏度与特异性,部分设计可适配汗液检测场景,为无创监测糖尿病相关炎症或应激状态提供技术方案。
此外,图7f中还包含有机电化学晶体管(OECT)、场效应晶体管(FET)等平台:OECT 通过纳米结构化 PEDOT 衍生物双层通道增大抗体结合面积,实现皮质醇 1fg/mL-1μg/mL 宽范围检测;FET 则借助聚苯乙烯 – 甲基丙烯酸共聚物基质嵌入抗体,解决高离子强度汗液中的德拜长度问题,提升检测稳定性。同时,部分设计拓展至细胞因子(如 IL-1β、IL-6)检测,通过离子液体稳定抗体或硫醇交联剂固定抗体,保障在汗液环境中的特异性与灵敏度,为无创监测糖尿病相关炎症状态、应激反应提供技术支撑。
2.3 基于核酸的传感器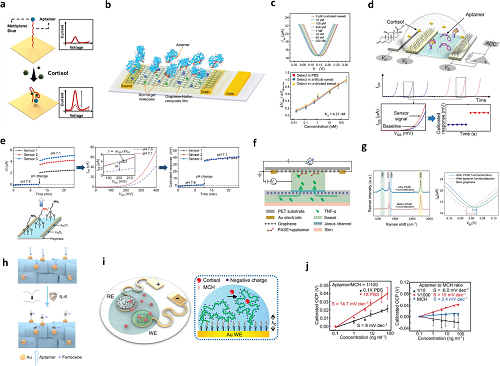
图8. 汗液适配体传感器。a 功能化波纹状传感器表面的示意图;b 适配体型石墨烯场效应晶体管(GNFET)生物传感器的示意图;c 转移特性曲线;d 适配体场效应晶体管(FET)传感器检测皮质醇的示意图,及e响应曲线;f 肿瘤坏死因子 -α(TNF-α)检测传感器的原理图;g 聚烯丙胺盐酸盐(PASE)修饰前后石墨烯的拉曼光谱,以及电流 – 电压曲线的变化;h 基于碳纳米管(CNT)/ 石墨烯复合纤维上适配体构象变化实现白细胞介素 – 6(IL-6)检测的传感机制示意图;i 抗皮质醇适配体功能化电极的传感机制示意图:适配体与皮质醇结合后发生构象变化;j 工作电极在不同皮质醇浓度溶液中的校准曲线(左侧);不同适配体 / 巯基己醇(MCH)比例下工作电极的校准曲线(右侧)。
图8 聚焦汗液适配体传感器,展示其在糖尿病相关标志物(如皮质醇、细胞因子 IFN-γ、IL-6)检测中的设计原理、结构优化及性能提升策略,包含多类传感器的工作机制与应用数据。呈现了皮质醇适配体传感器:通过在波纹状传感器表面修饰适配体,结合亚甲蓝氧化还原报告分子,实现对皮质醇的特异性检测,背景信号低(图8a);还设计假结辅助适配体,限制其仅在结合靶标时发生构象变化,进一步提升信号特异性。另有适配体场效应晶体管(FET)传感器(图8d),如石墨烯 – Nafion FET,通过适配体与 IFN-γ 的特异性结合改变器件 Dirac 点电压,检测限达飞摩尔级;为降低器件间差异,引入自参考方法,通过归一化源漏电流变化与转移曲线斜率,提升读数一致性。
此外,图8中展示碳纳米管 / 石墨烯复合纤维适配体传感器(图8h),通过适配体结合 IL-6 后的构象变化,导致二茂铁氧化还原信号降低,实现实时监测;还研究适配体与巯基己醇(MCH)的比例优化,发现 1/100 的比例可平衡灵敏度与静电斥力干扰,保障检测准确性。这些设计为汗液中低浓度标志物的无创、精准检测提供技术方案,支撑糖尿病相关炎症与应激状态监测。
2.4 基于MIP的传感器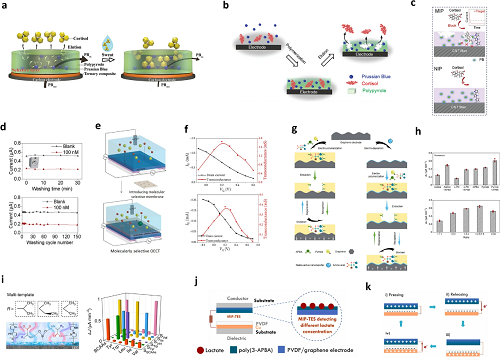
图9. 基于MIP的传感器。a 皮质醇传感器的传感机制示意图;b 在印刷碳电极上共电沉积普鲁士蓝(PB)、皮质醇与吡咯的过程示意图;c 皮质醇检测的示意图;d 传感器清洗前后的电流响应曲线;e 将分子印迹敏感膜(MSM)集成到有机电化学晶体管(OECT)器件的示意图;f 集成 MSM 前后,通过转移曲线展示的器件特性;g 传感器的制备及检测机制示意图;h 基于不同单体 / 目标物组合(上方)及不同目标物 / 交联剂 / 单体比例(下方)的色氨酸(Trp)分子印迹聚合物(MIP)传感器的峰值电流密度(ΔJ);i 多分子印迹聚合物(multi-MIP)氨基酸传感器的示意图(左侧),以及不同氨基酸传感器对其他氨基酸的选择性(右侧)。j 乳酸传感器的示意图;k 电信号电生成的工作原理。
图9围绕分子印迹聚合物(Molecularly Imprinted Polymers,MIP)基传感器展开,系统呈现其在糖尿病相关标志物(如皮质醇、乳酸、支链氨基酸等)检测中的设计、机制优化及应用场景,涵盖多种传感器结构示意图与性能验证数据。图9a-c展示皮质醇 MIP 传感器:通过聚吡咯(PPy)与 MXene、碳纳米管等复合,或在电极共电沉积普鲁士蓝(PB)、皮质醇模板与吡咯,利用 MIP 的特异性结合位点识别皮质醇,结合 PB 的氧化还原特性,通过电流变化量化目标物浓度,部分设计实现低检测限与良好稳定性。图9e-f基于有机电化学晶体管(OECT)的 MIP 传感器,将 MIP 集成于 PEDOT:PSS 通道层,通过皮质醇结合调控离子传输,改变器件电学输出。
此外,图9j中呈现乳酸 MIP 传感器,以 3 – 氨基苯基硼酸(3-APBA)为功能单体电聚合形成 MIP 层,结合摩擦纳米发电机(TENG)实现自供电检测,通过机械运动转化的电信号直观反映乳酸浓度;还借助密度泛函理论(DFT)优化单体与交联剂选择,提升 MIP 对支链氨基酸(BCAAs)的选择性,部分设计可在复杂汗液环境中实现精准检测,为无创、稳定的糖尿病代谢监测提供技术方案。
III 物理/生理生物传感器
3.1 汗液率传感器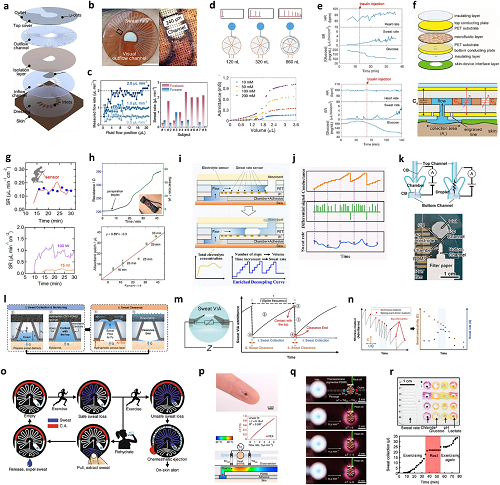
图10. 汗液率传感器。a 微流控器件的分层结构视图;b 运动过程中微流控器件的实物照片,以及汗液在微通道内流动的光学显微图像;c 不同流体填充位置下测得的流速(左侧);8 名健康受试者在 10-20 分钟运动期间测得的汗液率(右侧);d 阻抗式汗液率传感电极,以及该电极对含氯化钠(NaCl)溶液的导纳响应;e 同时测量 1 名糖尿病受试者的汗液分泌率、心率及组织液(ISF)葡萄糖水平;f 汗液率传感器的示意图;g 受试者以 75 瓦强度骑行时运动期间测得的汗液率及汗液率响应;h 45 分钟高强度骑行期间汗液动态的实时监测(左侧);可穿戴传感器与局部吸水贴片法测得的汗液流失量对比(右侧);i 汗液贴片通过液滴分离策略实现汗液信息解耦的原理示意图;j 将电导 “阶跃” 信号解耦以提取汗液率信息的示意图;k 汗液率传感器的示意图及实物照片;l 汗液传感器的结构及工作原理示意图;m 传感器的等效电路,以及汗液传感器产生的尖峰导纳曲线示例;n 尖峰事件驱动的数据传输示意图;o 器件工作流程示意图;p 手指上的热流式传感模块实物照片及汗液流经通道时温度分布的有限元分析图;q 流体通道上的热执行器图像;r 集成了多个比色检测法和毛细管破裂阀的表皮流体系统。
图10聚焦汗液率传感器,系统呈现其设计原理、检测技术及实际应用,为汗液中生物标志物精准定量提供关键支撑,包含多类传感器结构示意图与性能数据。图10a-c展示微流控汗液率传感器,如垂直集成微流控模块,通过计算机视觉算法追踪汗液在微通道中的流动,实时计算汗液体积与速率,还可结合pH缓冲模块降低个体差异对检测的影响;另有圆形微流控通道设计,实现高效汗液采样与尿酸、酪氨酸等标志物同步监测。
图10中涵盖阻抗式、电容式、化学电阻式等多种检测技术。阻抗式(图10d)通过叉指电极测量汗液接触时的导纳变化,精准测定汗液体积与流速;电容式(图10f)利用汗液与空气介电常数差异,通过平行电极电容变化推算汗液率;化学电阻式(图10h)基于单壁碳纳米管吸水后电阻变化实现检测。同时,部分设计优化汗液收集(如锥形垂直通道、疏水微通道)与抗干扰能力(如隔离电子元件),还通过热流传感、比色法等拓展检测方式,为运动、临床场景下的汗液率监测及糖尿病相关代谢评估提供技术方案。
3.2 血压传感器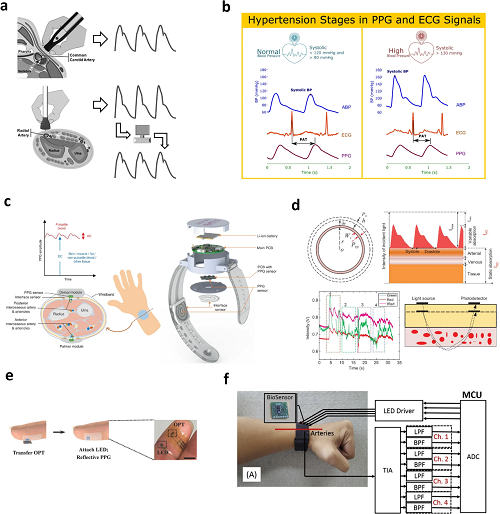
图11. a 采用动脉张力测定法评估中心血压与脉搏波分析的方法;b 不同高血压阶段下的脉搏传导时间;c 基于光电容积描记法(PPG)的腕部手表式监测设备示意图;d (左上)利用虚功原理分析血压变化的理论模型示意图;(右上)采用光透射法检测动脉搏动血流的示意图;(左下)运动伪影对 PPG 信号及光路产生的影响;(右下)外部压力导致的光路及组织变化示意图;e 表皮混合式 PPG 传感器的组装流程示意图,以及手指佩戴该表皮混合式 PPG 传感器的实物照片;f 所提出的原型系统框图。
图11围绕无创血压监测技术展开,聚焦糖尿病患者心血管风险评估,呈现血压测量原理、方法对比及技术创新,含多类监测系统示意图与临床数据。图11a解析动脉张力测定法:分 “直接法”(通过颈动脉脉搏波直接反映中心主动脉压)与 “间接法”(利用桡动脉波形结合传递函数估算中心压),通过手持设备捕获脉搏波形,计算收缩压、舒张压及平均动脉压,避免传统袖带法不适。另有光电容积描记法(PPG)相关设计,如腕部双 PPG 设备,结合接触压、皮肤温度传感器与机器学习,降低个体差异影响;还有皮肤状光电子系统,通过双通道 PPG 与光学频域微分技术,抑制运动伪影,在 ICU 患者中实现高精准血压监测。此外,图中展示表皮柔性近红外 PPG 传感器,结合有机光电晶体管与无机 LED,精准追踪心率变异性与脉压;还探索 ECG 与 PPG 信号融合用于血糖监测,通过时空决策融合提升准确性,同时呈现基于 PPG 与生理参数的无创血糖估算系统框架,为糖尿病患者心血管与代谢状态综合监测提供技术方案。
IV 多模态传感器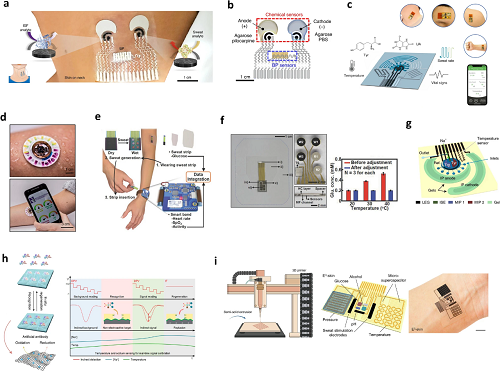
图12. 多模态传感器。a 用于组织液(ISF)与汗液检测的声学传感器及酶促化学传感器示意图;b 声学与电化学传感组件的示意图,以及用于汗液刺激与组织液提取的水凝胶;c 传感器的多种功能,如对尿酸(UA)和酪氨酸(Tyr)的超高灵敏度检测、汗液率估算、温度传感及生命体征监测;传感器佩戴在身体不同部位的实物照片;d 出汗过程中器件的工作示意图及手机交互界面;e 可穿戴健康管理系统总览:该系统包含用于葡萄糖检测的一次性汗液分析试纸,以及用于监测心率、血氧饱和度和身体活动量的可穿戴智能手环;f 葡萄糖传感器与温度传感器的集成方案;在对葡萄糖传感器的温度依赖性进行校正前后,不同温度下的汗液葡萄糖浓度数据;g 多功能可穿戴传感器的示意图;h 传感器的原位再生与校准技术;在人体佩戴使用过程中,对基于间接检测机制的分子印迹聚合物(MIP)- 氧化还原活性报告分子(RAR)- 激光雕刻石墨烯(LEG)传感器采用的原位校准策略;i 基于应变传感弹性体(SSE)的 3D 打印技术示意图、3D 打印传感器的结构示意图,以及该传感器的光学图像。
图12聚焦多模态传感器在糖尿病监测中的设计与应用,呈现其整合生化检测与生理监测的技术方案,包含多类传感器系统示意图及性能数据。图12a-d展示表皮贴片式多模态传感器,如集成超声换能器与电化学传感器的贴片,可同步监测血压、心率(超声技术)及组织液葡萄糖、汗液乳酸等(电化学技术),通过水凝胶实现汗液刺激与组织液提取;另有激光雕刻传感器,能检测汗液尿酸、酪氨酸,同时监测温度、呼吸频率,微流控模块可减少汗液污染与蒸发。此外,图12c中呈现混合传感系统,如结合电化学传感器与比色法的微流控设备,同步分析乳酸、葡萄糖等,通过染料变色追踪出汗率;还有集成血糖与温度传感器的可穿戴系统,通过温度校准提升血糖检测准确性。部分设计引入原位再生与校准技术(如高压安培法清除结合物),结合机器学习优化数据解读,还探索 3D 打印技术实现传感器微型化与柔性化,为糖尿病患者提供实时、全面的代谢与生理状态监测方案。
图13. 无创皮肤生物传感器在糖尿病监测中的挑战和前景
图13分为挑战与展望两部分,系统梳理无创皮肤生物传感器在糖尿病监测中的核心问题与发展方向。图13a 部分指出关键挑战,如生物标志物在汗液与血液中关联不稳定、存在时滞,传感器灵敏度与稳定性不足,缺乏标准化校准方案,多模态数据同步与分析难度大,还涉及用户接受度低、隐私伦理等问题。图13b 部分提出解决路径,包括开发自适应校准算法、整合多维度生物标志物、构建 AI 驱动的预测模型,推进闭环治疗系统,同时完善监管标准与可持续材料应用,助力实现个性化糖尿病管理。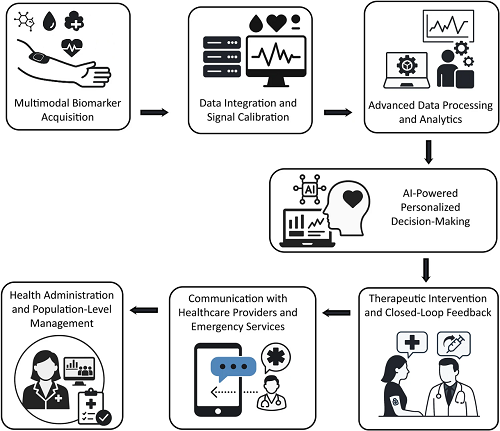
图14. 通过皮肤界面生物传感器进行糖尿病管理的未来。
图14呈现基于皮肤界面生物传感器的未来糖尿病管理概念框架,清晰展现从实时传感到个性化健康干预的全流程。该框架以多模态生物标志物采集为起点,经数据整合与信号校准后,通过先进数据处理和 AI 驱动分析生成决策支持,一方面为患者提供个性化健康管理建议,另一方面实现与医疗服务提供者的信息交互,必要时联动应急服务。同时,还涵盖群体层面的健康管理,形成个人健康监测与群体健康数据分析的闭环,最终通过闭环反馈与治疗干预,构建从实时监测到精准干预的糖尿病管理体系。
V 总结
本文聚焦无创皮肤生物传感器在糖尿病监测中的研究进展,旨在解决传统有创血糖监测的局限。本文介绍糖尿病相关生物标志物,包括汗液中的葡萄糖、乳酸等生化标志物,以及皮肤温度、出汗率等生理标志物,说明其与糖尿病病理机制的关联。随后重点分析可穿戴传感器技术,涵盖化学传感器(酶基、抗体基、适配体基、分子印迹聚合物基)和物理/生理传感器(汗液率、血压传感器等),详述各类传感器的设计原理、结构优化及性能,如酶基传感器的三代发展、抗体基传感器的检测限优化等。还探讨传感器材料特性,强调生物相容性、柔韧性等对佩戴体验和检测准确性的影响。同时,文章介绍多模态传感器的整合应用,通过融合多类检测技术提升监测全面性与准确性,并提及 AI 算法、数据传输与分析在传感器系统中的作用。最后指出当前挑战,如生物标志物关联不稳定、传感器稳定性不足等,展望未来方向,包括个性化校准、闭环治疗系统及监管伦理完善,为无创糖尿病监测技术发展提供全面参考。
作者简介

关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 英国曼彻斯特大学Yi Li等综述:无创皮肤生物传感器用于糖尿病的监测
 Nano-Micro Letters
Nano-Micro Letters 南洋理工大学Jong-Min Lee等综述:偶极子及相互作用在高能量电池中的发展及优势
南洋理工大学Jong-Min Lee等综述:偶极子及相互作用在高能量电池中的发展及优势 湖南大学郑建云等:基于太阳能的废旧电池高纯锂金属光电化学回收新策略
湖南大学郑建云等:基于太阳能的废旧电池高纯锂金属光电化学回收新策略 哈尔滨工业大学娄帅锋团队:“一箭双雕”-Sb/Nb协同TiNb₂O₇助力高性能低温锂离子电池
哈尔滨工业大学娄帅锋团队:“一箭双雕”-Sb/Nb协同TiNb₂O₇助力高性能低温锂离子电池 合肥理工学院吴玉程、李兆乾等:三氯蔗糖调控Zn²⁺溶剂化结构和(002)面取向实现高放电深度水系锌离子电池
合肥理工学院吴玉程、李兆乾等:三氯蔗糖调控Zn²⁺溶剂化结构和(002)面取向实现高放电深度水系锌离子电池