研究背景
临床难治性伤口(包括压疮、糖尿病溃疡及关节损伤相关创面等)会延缓愈合并加重医疗与社会负担。传统敷料有引发二次损伤的风险,而导电水凝胶敷料优势显著:其电活性成分可调控伤口愈合,还能将创面微环境信号转为电信号,在伤口愈合与监测领域展现出优异的适用性;结合AI模型整合多源数据构建评估体系,对优化难治性伤口预后和提升护理标准意义重大。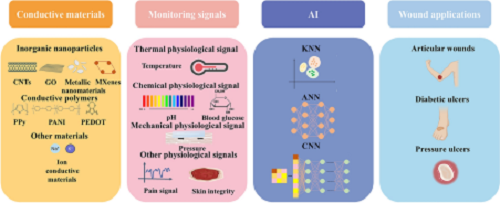
Artificial Intelligence‑Assisted Conductive Hydrogel Dressings for Refractory Wounds Monitoring
Yumo She, He Liu, Hailiang Yuan, Yiqi Li, Xunjie Liu, Ruonan Liu, Mengyao Wang, Tingting Wang, Lina Wang, Ye Tian* & Kai Zhang*
Nano-Micro Letters (2025)17: 319
https://doi.org/10.1007/s40820-025-01834-w
本文亮点
1. 导电材料的优势及筛选策略:本综述详细探讨了导电聚合物、无机纳米材料等导电材料的优势,并对其筛选策略进行了阐述。
2. 导电水凝胶敷料的信号输出与AI监测应用:总结了导电水凝胶敷料用于伤口状态监测的信号输出类型,重点强调了基于人工智能的伤口监测与预测技术。
3. 导电水凝胶敷料在难治性伤口监测中的应用与前景:综述分析了导电水凝胶敷料在不同类型难治性伤口监测中的应用现状、当前面临的挑战及潜在发展前景。
内容简介
临床难治性伤口(包括压疮、糖尿病溃疡及关节损伤等)不仅显著延缓患者愈合进程,更对医疗系统及社会层面造成沉重的经济负担与资源压力。传统伤口敷料在临床应用中存在诱发继发性创面损伤的风险,而导电水凝胶敷料因其独特性能,在伤口愈合与监测领域展现出优异的适用性:其电活性组分可通过刺激内源性电流生成,在伤口愈合进程中发挥关键调控作用;同时,导电水凝胶传感器或智能材料可以将创面微环境中的动态信号转化为电脉冲信号。人工智能(AI)模型通过整合导电水凝胶传感器所采集的多源数据,构建全面的评估体系,这对于优化难治性伤口患者的预后效果及提升护理标准具有重要意义。
为应对上述临床挑战,东北大学田野教授团队与中国医科大学附属盛京医院张凯教授团队展开联合研究,对导电水凝胶敷料在伤口监测与愈合领域的作用机制、材料筛选策略及信号输出形式进行了系统梳理。该综述重点剖析了基于传感器数据信号输出、借助人工智能模型实现伤口愈合状态预测的相关研究进展,并对临床难治性伤口的监测与愈合过程进行了深入探讨。通过对上述关键领域的全面涵盖,该综述强调了集成导电水凝胶伤口监测与治疗系统在高级伤口监测及个性化医疗领域的潜在发展方向与研究机遇,为该领域的科研工作者及临床医务工作者提供了重要的启示与指导。
图文导读
I 导电水凝胶敷料的常见材料、监测机制和应用
如图1所示,文章系统阐释了用于伤口监测和愈合的导电水凝胶敷料的机理、导电水凝胶敷料的材料选择,重点介绍了用于监测伤口状况的导电水凝胶敷料的信号输出类别,以及基于传感器衍生数据的AI技术预测伤口愈合状态的相关研究。此外,讨论了与涉及压疮、糖尿病溃疡和关节伤口的慢性难治性伤口相对应的伤口监测和愈合过程。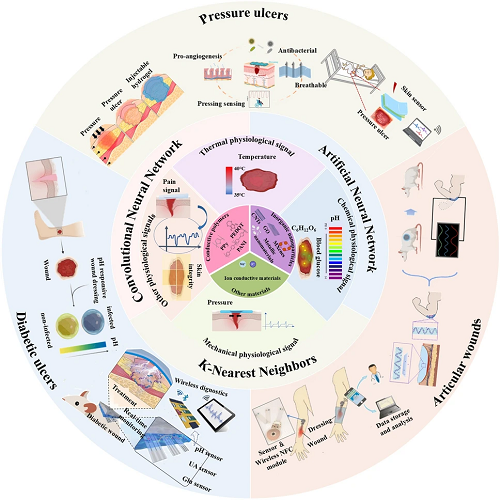
图1. 导电水凝胶敷料的常见材料、监测机制和应用。
最近几年人们对导电水凝胶传感器与人机界面相结合的综合监测和处理能力越来越感兴趣,相关研究蓬勃发展。如图2所示2018年智能绷带与计算机和智能手机无线通信结合,以监测伤口的pH值并调节温度以根据需要在伤口局部释放抗生素。2019年:与导电水凝胶敷料集成的温度传感器收集伤口温度,通过蓝牙通信实时传输到智能手机,并使用UV-LED远程控制抗生素的原位释放。2020年:导电水凝胶敷料可以通过比色法同时监测糖尿病伤口的pH值和葡萄糖水平,并通过智能手机收集并转换为RGB信号以量化伤口参数。2021年:通过集成传感器阵列的平台,用于测量炎症介质、微生物负荷和物理化学参数,并使用智能手机的无线数据读取信息。2022年:上图:基于接触pH响应电压输出结合深度ANN深度学习监测慢性皮肤伤口愈合。下图:导电水凝胶敷料通过比色法和基于CNN算法的个性化伤口管理实现伤口pH值监测。2023年:电阻式导电水凝胶敷料与无线蓝牙模块集成用于实时监测伤口温度。2024年:上图:通过3D打印导电水凝胶敷料实现伤口温度监测。下图:具有可视化pH监测特性的导电水凝胶与智能手机集成,实现图像可视化,并使用KNN算法进一步实现伤口pH评估。2025:上图:通过光电双信号同时监测伤口渗出液中的葡萄糖和汗液葡萄糖。下图:导电水凝胶敷料通过电阻变化和红外图像监测伤口的温度变化。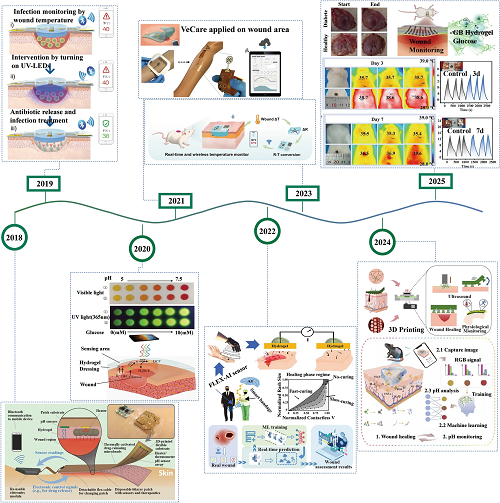
图2. 导电水凝胶敷料的发展编年史。
II 伤口监测机制
近年来,由于对用于伤口监测和治疗的集成传感器的需求不断增长,致力于开发智能敷料的研究大幅增加。对于创面综合监测和治疗,导电水凝胶敷料的信号输出种类大致可分为热生理信号-温度、化学生理信号-pH和葡萄糖、机械生理信号-压力和其他生理信号。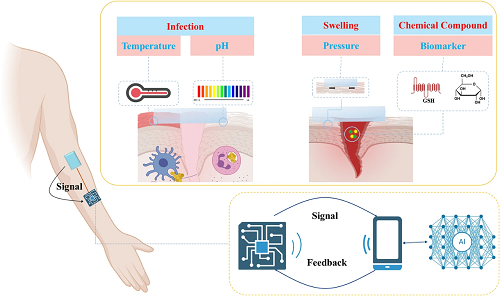
图3. 不同伤口中导电水凝胶敷料监测和信号传输的示意图。
炎症、炎症化学物质引起的血管舒张和免疫反应都会导致皮肤伤口组织温度在整个愈合过程中升高。这种温度升高比正常皮肤高出大约1.5°C(图4a)。此外,感染可能导致伤口温度进一步升高。因此,在伤口愈合过程中密切监测温度被证实具有重要意义和优势。通过各种信号输出,不仅可以实时了解伤口愈合状态,还能够对包括伤口感染在内的不良状况进行及时干预与处置。目前已经开发了许多技术用于温度监测,包括比色传感器、红外测温仪和电子温度响应敷料(图4b-e)。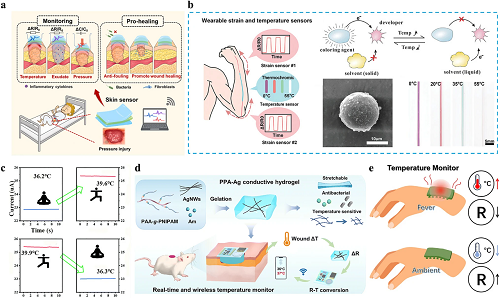
图4. 导电水凝胶敷料监测伤口热生理信号—温度的机制。a 伤口温度变化会影响水凝胶温度变化,从而允许远程监测伤口。b 用于双应变和温度传感器的混合光纤示意图。c 设计导电和温度敏感的水凝胶敷料策略,与无线蓝牙模块集成,用于实时伤口温度监测。d 通过不同温度下的电阻变化实现连续温度监控。e “人工发热”前后的电流变化。
健康皮肤的pH值在4.8到5.7之间,呈微酸性。当皮肤受损时,伤口部位会形成渗出液,包括炎症、胶原蛋白生成和血管生成在内的许多病理事件,渗出液的pH值会发生变化。因此,从治疗的角度来看,监测整个伤口愈合过程中的pH值变化非常重要。根据pH值变化的趋势,除了快速评估伤口的健康状况外,还可以为临床医生提供最佳治疗方案。目前,对于伤口pH值的监测,大多数方法都依赖于通过比色法进行目视检查。通过在伤口敷料中添加pH响应物质,这些物质会触发颜色变化,从而可以检测和感知伤口微环境中的酸碱状况(图 5a和5b)。电压型pH传感器通过伤口部位不同电压值的输出同样可以监测伤口部位的pH值变化(图 5c)。
除了pH值的动态监测之外,组织修复过程中的血糖特异性成为糖尿病伤口管理的关键生物标志物。持续的代谢波动和高血糖水平直接影响血管生成效率和细胞外基质(ECM)重塑过程。目前,用于跟踪血糖水平的导电水凝胶敷料不仅可以通过监测电阻的变化来有效地实时跟踪伤口的葡萄糖水平,还可以加速慢性伤口的愈合(图 5d和5e)。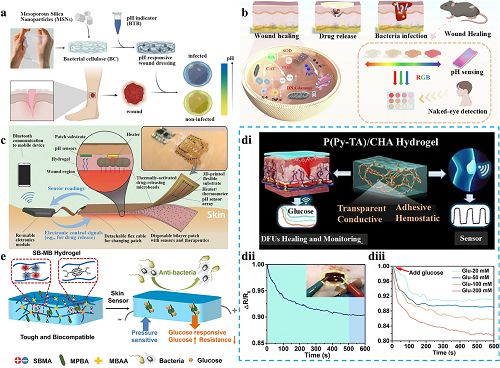
图5. 导电水凝胶敷料监测伤口化学生理信号的机制。a 通过用负载pH响应染料的二氧化硅纳米颗粒浸渍纳米纤维素,获得pH响应纳米复合伤口敷料。b 使用水凝胶监测和治疗细菌感染伤口的示意图。c 自动智能绷带的示意图和概念图。绷带由一系列灵活的pH传感器和一个加热器组成,用于触发含有抗生素的热响应性药物载体。电子模块与计算机和智能手机结合进行无线通信。 di P(Py-TA)/CHA水凝胶贴剂在DFU愈合和血糖监测中的应用。dii 伤口对葡萄糖的实时抵抗反应曲线。diii P(Py-TA)/CHA水凝胶的相对电阻变化曲线,葡萄糖浓度从20 mM变化到200 mM。e SB-MB皮肤传感器的分子设计和示意图,可以连续监测伤口部位的血糖变化。
监测伤口局部压力以实现早期干预对治疗结局至关重要,这在糖尿病患者及压疮患者中具有特殊临床价值。感染、水肿、血肿等病理因素可诱发局部异常高压,而外部干预(如加压包扎)则可能减少受损组织的血液灌注与营养供应。压疮及关节损伤患者在创面愈合阶段,更易因外力作用(如伤口牵张、压迫)或肢体活动引发继发性损伤,显著延缓愈合进程。因此,早期识别并及时处理伤口异常状态,是改善愈合预后的关键。
基于导电水凝胶的传感器可将伤口愈合过程中的机械信号(压力)转化为可量化的电信号(以电阻为主),从而实现对人体生理状态的动态监测(图 6a,6c-d)。通过光信号(颜色变化)与电信号(电阻变化)的双信号响应,该类传感器能够提供应力与应变的定性及定量分析结果,这对实时追踪伤口愈合过程中的外部损伤具有重要意义。(图 6b)。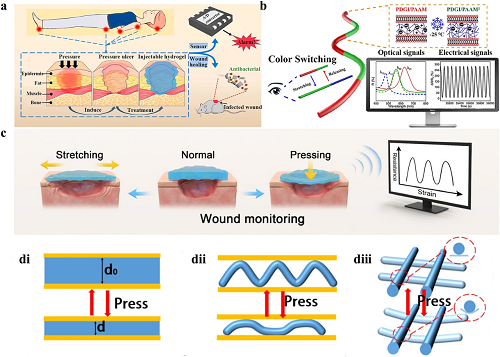
图6. 导电水凝胶敷料监测伤口机械生理信号的机制。a 3D混合支架实时监测施加在伤口上的压力以防止形成压疮并具有抗菌部分,可促进感染伤口的愈合。b 描述交互式可穿戴传感器HSCEF的结构和应用的示意图。c 压疮的监测是通过利用伤口拉伸和按压引起的应力变化来实现的。di-diii 具有块状结构、对齐纤维结构和交叉纤维结构的导电水凝胶的压力传感机制示意图。
除了血糖水平外,还可以监测糖尿病伤口的疼痛感知。随着伤口的愈合,疼痛感会逐渐消失。导电水凝胶敷料对伤口疼痛信号的跟踪灵敏度,可通过测试中电阻变化的量化分析得以验证。该类敷料能够实时捕获伤口局部的疼痛相关信号,并即时反馈至医疗人员,从而实现对伤口局部变化的快速精准处置。(图 7a和7b)。生物组织对交流电的抵抗力称为生物阻抗。当伤口区域的细胞受损时,离子和电流很容易流过细胞膜,增加电导率并降低阻抗,生物阻抗测量系统提供了一种定量、客观且无干扰的方式来跟踪伤口愈合过程。通过阻抗测量可以确定伤口部位皮肤的完整性(图 7c-f)。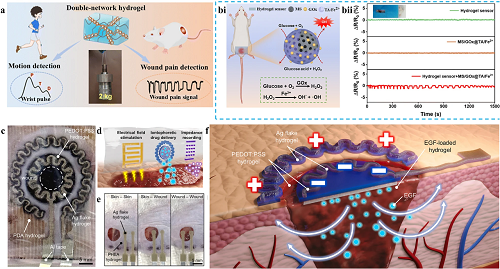
图7. 导电水凝胶敷料监测伤口其他生理信号的机制。a 示意图描述了DN水凝胶在伤口疼痛信号检测中的应用。bi 使用DN水凝胶传感器对级联反应引起的疼痛进行原位监测的示意图演示。bii DN水凝胶传感器的实时电阻信号。c 应用于小鼠皮肤伤口的离子电渗疗法的e-skin贴剂的图像。d e-skin贴片的代表性水凝胶图案,显示了电场刺激、离子电渗药物递送和阻抗记录的各种应用。e 在不同部位使用e-skin贴片进行阻抗测量的图像。f 用于离子电渗药物递送的e-skin贴片示意图。
III AI 辅助伤口监测
随着新兴柔性电子技术的快速发展,集成多通道柔性导电传感器的新一代智能创面敷料已成为研究与应用的重要方向。这使其能够通过温度、pH值、血糖、压力等多种生理信号对伤口状态进行实时监测。除原位伤口传感与按需治疗外,在精准化、个性化医疗的发展趋势下,人工智能、大数据及图像处理等技术为开发更可靠且兼具用户适配性的智能伤口治疗方案提供了可行路径与广阔前景。鉴于机器学习在数据处理方面的高效性,其可通过快速解析海量监测数据并提取有效信息,显著提升伤口监测的效能。深度学习模型(如ANN、CNN等)能够从大量生物监测数据中自主挖掘复杂特征与模式,精准识别各类伤口状态,并对新输入数据进行实时处理与评估,从而为实现实时化、个性化的伤口监测提供了技术支撑。
KNN简单方便,通过识别与目标数据点相似程度最高的几个相邻数据点来执行预测。基于KNN的伤口监测首先使用移动设备捕获带有金属纳米颗粒的水凝胶的颜色变化,随后测量RGB值,确定RGB值与伤口pH值之间的线性关系。最后采用KNN模型评估不同pH值下水凝胶RGB信号的准确性,预测准确率可达96%(图 8a-c)。通过定量和定性数据监测,及时预警异常情况,适用于初级保健和家庭护理。
ANN通过自适应加权节点系统模拟生物神经元互连性,在处理异构生物医学数据流方面表现出特别的功效。与机器学习相比,该计算框架能够在伤口监测过程中对高维传感器输出进行实时分析。为了实现智能实时伤口监测,研究人员将导电水凝胶传感器与深度学习ANN算法相结合。导电水凝胶敷料可区分各种伤口类型,预测伤口愈合阶段,并测量非接触电位与时间之间的关系。根据用于愈合阶段识别的相关混淆矩阵,各种皮肤病伤口的非接触式测量准确率为94.6%(图 8d和8e)。通过在临床评估前监测患者的伤口状态,避免临床准备不足,并在皮肤病无法用皮肤科药物治疗时寻求适当的干预,受此启发的可穿戴导电水凝胶敷料让医护人员在临床干预前对伤口愈合情况有更透彻的判断,有利于临床治疗的发展。
CNN作为一种专门的ANN架构,通过自动特征学习和提取,在处理具有网格结构的缠绕图像数据方面表现出非凡的熟练程度。此功能可实现伤口图像的高精度分类和愈合进展的预测分析。CNN技术与pH响应水凝胶监测系统的集成,将色度转变(RGB变化)与伤口修复过程中的生化变化相关联,为智能伤口管理平台提供了巨大的临床潜力。更重要的是,通过使用CNN深度学习算法进行信号分析,有效地展示了个性化的伤口管理,在评估伤口感染和愈合方面取得了94.47%的准确率(图 8f和8g)。 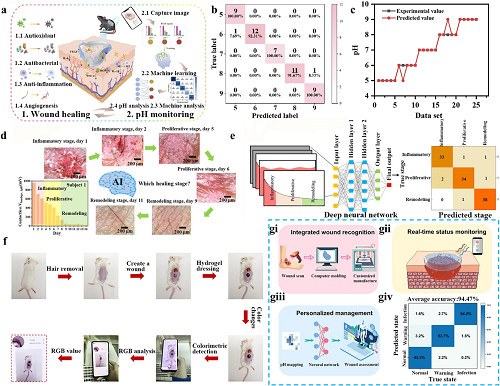
图8. AI 辅助伤口监测。a糖尿病伤口愈合的潜在应用机制。b pH 5-9的KNN预测混淆矩阵。c KNN模型的预测值与pH值的实验值比较。d 从发炎的皮肤受试者处智能对的非接触式测量中,输出预测的愈合阶段。e用于对深度ANN算法计算的炎症、增殖和重塑阶段进行分类的混淆矩阵。f 智能伤口监测下体内伤口愈合的实验过程。以多功能水凝胶为伤口敷料的智能伤口监测示意图,包括 gi 伤口识别、gii 实时状态监测和 giii 个性化伤口管理。giv 伤口pH映射的混淆矩阵显示了CNN的准确性。
IV 难治性伤口临床应用
难治性伤口是指那些在常规愈合期内无法通过标准治疗技术愈合的伤口。常包括压疮、糖尿病溃疡和关节伤口。压疮通常表现在骨骼突出的区域,如骶骨、臀部和足跟。长时间的压力、摩擦力或剪切力会破坏流向受影响区域的血流并导致组织缺血缺氧,从而产生压疮。失去知觉、瘫痪、行动不便或长时间卧床的患者患此类压疮的风险更高。这些患者无法完全释放压力区域,长时间暴露于特定身体部位的压力可能会破坏局部血液循环,导致某些生化变化,从而导致溃疡和组织损伤。在已经或可能发生压疮的几个部位,患者佩戴无线导电水凝胶敷料,通过使用A/D转换器,这些传感器将跟踪伤口随时间推移的压力变化,并将数据转换为数字信号,然后无线发送到医疗保健系统的基站。当传感器检测到伤口部位有高压,对组织有害时,会立即提醒医务人员重新安置患者。目前的导电水凝胶敷料还可在治疗压疮的同时连续、远程和实时监测温度、压力、渗出液和其他指标(图 9a-e)。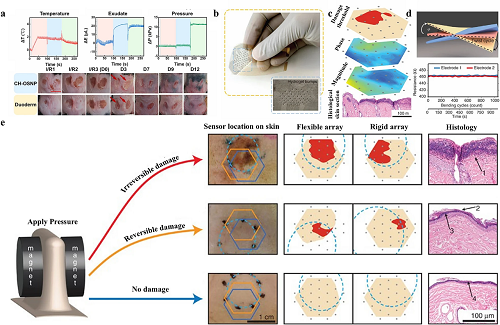
图9. 用于压疮的导电水凝胶敷料。a 温度(T)、渗出物(E)和压力(P)指标的连续实时监测和区分。在不同时间用水凝胶皮肤传感器敷料形成和加工的压疮 的照片。b 该设备制作的预制阵列上打印的水凝胶凸块的示意图。c 将阵列放置在体内伤口上,并收集每对相邻电极的电阻抗。阻抗幅度、相位角和损伤阈值(此处以红色显示)的映射是根据每个测量对的位置构建的。d 对水凝胶阵列阻抗传感进行了机械稳定性测试,结果显示高度稳定。e 早期发现压力引起的组织损伤。显示了指示传感器位置的代表性伤口图像、使用柔性和刚性传感器阵列从这些伤口获得的损伤参数图以及每种情况的组织学结果。浅蓝色虚线圆圈表示施加到皮肤上的压力位置,橙色和深蓝色六边形分别表示伤口上柔性和刚性阵列的位置,灰点代表电极。比例尺,1 cm(用于伤口照片)和 100 μm(用于组织学图像)。
监测伤口内的葡萄糖浓度在糖尿病溃疡的治疗中具有重要意义。一种极其透明的导电水凝胶贴片与多种浓度的葡萄糖接触时,电阻变化率表现出规律的下降趋势,并将其无线传输到移动设备,因此实时监测伤口处的葡萄糖水平可以反映血糖水平。由于导电水凝胶具有出色的透明度,从宏观和微观角度均进行了伤口愈合监测(图 10a)。氧化微环境除了影响该部位的葡萄糖水平外,还阻碍糖尿病皮肤病变的愈合。在葡萄糖存在下,内源性氧化还原酶葡萄糖氧化酶(Gox)可以启动产生ROS的级联过程。ROS会影响疼痛的感知方式,糖尿病溃疡产生的疼痛信号有助于实时监测伤口愈合状态。当纳米颗粒被添加到水凝胶系统中时,它们可以识别由糖尿病伤口级联反应引起的轻微疼痛信号,并将该信号的变化输出为电阻波形变化。因此,跟踪阻力波形的变化可以帮助确定伤口处的ROS如何变化,解释疼痛信号的变化,并间接表示伤口的当前状态(图 10b-e)。该敷料对伤口变化表现出快速、精确的实时响应性和出色的抗菌性能,使其对治疗糖尿病溃疡伤口非常有益。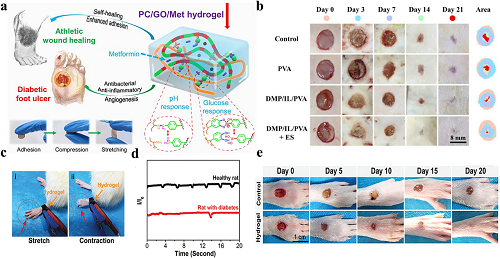
图10. 用于糖尿病溃疡的导电水凝胶敷料。a PC水凝胶的结构、pH值和葡萄糖反应机制及其在糖尿病足溃疡和运动伤口愈合中的应用示意图。b 用于治疗糖尿病伤口和监测伤口大小的水凝胶敷料。c、d 由于神经损伤,与正常大鼠相比,糖尿病大鼠对环境刺激的反应较慢。所设计的导电水凝胶敷料能可靠地反映糖尿病大鼠在连续热刺激过程中较低的运动反射频率。e 用PBS和导电水凝胶敷料治疗后糖尿病足的代表性照片,导电水凝胶敷料组显著促进伤口愈合。
由于手指、肘部和膝关节的活动度很高,这些区域的伤口往往愈合缓慢,治疗难度更大。可以使用具有运动监测功能的导电水凝胶敷料感应和自主修复关节伤口。当应用于关节伤口时,它可以防止重复运动导致敷料脱落或失去对伤口部位的紧密粘附,增加开裂甚至再撕裂和继发感染的风险,这会延长愈合过程并产生更多不适。用于关节损伤的导电水凝胶敷料随着关节弯曲角度的增加,输出的电信号变化更显著。关节处不同的运动都可以根据电阻的变化或电脉冲的变化来区分。这种能力有助于医生评估患者的运动并加速他们的运动技能的恢复。并且通过改变电脉冲,这种传感器可以识别细菌感染,还可以实时做出决策并跟踪关节伤口的愈合情况。如果在病变愈合期间发现细菌感染,可以使用原位光热灭菌,该细菌感染诊疗一体化系统具有良好的临床应用前景(图 11a和11b)。 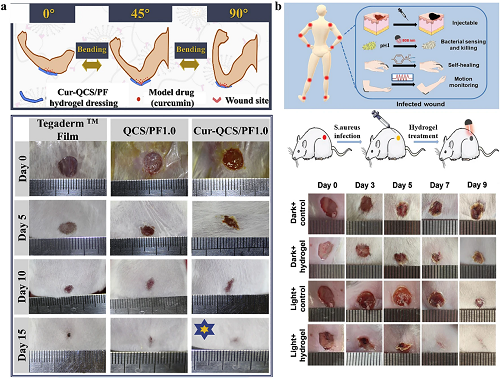
图11. 用于关节伤口的导电水凝胶敷料。a 含有姜黄素的导电水凝胶敷料不仅可以通过关节运动状态监测伤口,还可以通过伤口部位的pH值变化释放姜黄素以达到治疗目的。b 水凝胶敷料实现对身体关节伤口的实时监测防止人体关节伤口再次撕裂,并通过改变电信号和光热疗法实现原位细菌感应和杀灭功能。
V 总结
在该综述中,研究团队系统阐述了用于伤口监测与愈合的导电水凝胶敷料的作用机制及材料选择策略,重点解析了此类敷料在伤口状态监测中的信号输出类型,以及基于传感器数据信号输出结合人工智能技术实现伤口愈合状态预测的相关研究进展。此外,针对压疮、糖尿病溃疡及关节创面等慢性难治性伤口,系统探讨了其对应的监测与愈合过程。最后,通过对上述关键领域的全面涵盖,该综述强调了集成导电水凝胶伤口监测与治疗系统在高级伤口监测及个性化医疗领域的潜在发展方向与研究机遇,例如必须提高传感器的稳定性,并保证导电水凝胶敷料的安全性;还要整合来自多维监测的信号,增加可以使用导电水凝胶敷料监测的伤口类型;同时研究更复杂的AI算法,以便在多个维度上检查错综复杂的伤口特征。为保证个性化的研究,必须鼓励临床使用定制的伤口护理和监测系统。为该领域的科研工作者及临床医务工作者提供了重要的启示与指导。
文章呼吁导电水凝胶敷料和物联网(IoT)结合起来提高伤口监测的可及性和连续性。这将使患者能够在他们的护理中发挥积极作用,并使医疗专业人员能够更彻底地监测伤口。随着现代技术的不断革新,人工智能辅助的导电水凝胶敷料为慢性难治性伤口的有效治疗开辟了新路径,为临床治疗领域带来了广阔的应用前景。
作者简介


关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 东北大学田野等综述:人工智能辅助的导电水凝胶敷料用于难治性伤口监测
 Nano-Micro Letters
Nano-Micro Letters 西北工业大学张秋禹&张和鹏&王天帅等:改性不可逆键COFs实现高效CO₂还原
西北工业大学张秋禹&张和鹏&王天帅等:改性不可逆键COFs实现高效CO₂还原 中科院宁波材料所叶继春&苏州大学杨阵海等:蒸镀超薄spiro-OMeTAD助力n-i-p钙钛矿/晶硅叠层太阳能电池效率与稳定性突破
中科院宁波材料所叶继春&苏州大学杨阵海等:蒸镀超薄spiro-OMeTAD助力n-i-p钙钛矿/晶硅叠层太阳能电池效率与稳定性突破 南京航空航天大学姬广斌:多尺度跨波段防护系统实现可见光、动态红外伪装与电磁屏蔽一体化
南京航空航天大学姬广斌:多尺度跨波段防护系统实现可见光、动态红外伪装与电磁屏蔽一体化 广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机
广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机