研究背景
肿瘤治疗中,铜死亡、铁死亡和细胞凋亡的疗效受限于多重挑战:肿瘤细胞内铜、铁离子水平不足,存在缺氧微环境,且谷胱甘肽(GSH)高表达,这些因素严重阻碍了上述细胞死亡途径的激活。热电技术作为医学治疗领域的新兴前沿,旨在生物系统的窄温度范围内实现高效的热和电传输特性,为肿瘤治疗提供了新思路。然而,现有热电材料多存在结构复杂、合成难度大、生物相容性差等问题,且光热转换效率低,难以形成有效温度梯度,限制了其应用。铜硫族化合物因合适的带隙和声子-液体特性,在热电应用中具有潜力。此外,掺杂和缺陷工程被认为是改善热电性能的关键策略,掺杂能够引入缺陷、优化结构,为构建高效肿瘤治疗体系提供了可能。基于此,本研究旨在设计一种整合光热电催化、酶催化和饥饿疗法的多功能纳米平台,以解决现有肿瘤治疗的瓶颈。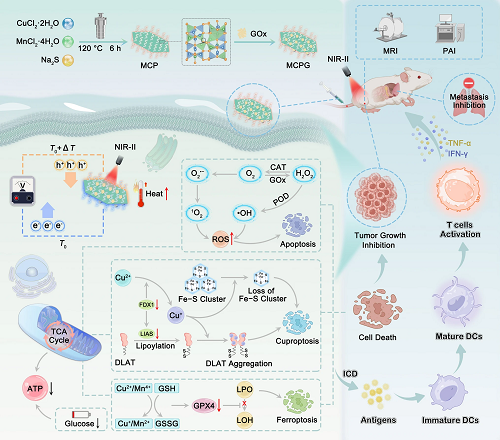
Designing a Sulfur Vacancy Redox Disruptor for Photothermoelectric and Cascade-Catalytic-Driven Cuproptosis-Ferroptosis-Apoptosis Therapy
Mengshu Xu, Jingwei Liu, Lili Feng*, Jiahe Hu, Wei Guo*, Huiming Lin, Bin Liu, Yanlin Zhu, Shuyao Li, Elyor Berdimurodov, Avez Sharipov, Piaoping Yang*
Nano-Micro Letters (2025)17: 321
https://doi.org/10.1007/s40820-025-01828-8
本文亮点
1. 级联催化与活性氧供应:Cu₂MnS₃₋᙮-PEG/GOx(MCPG)的糖代谢与酶活性可实现级联催化反应,持续补充肿瘤微环境中缺乏的 H₂O₂和O₂,为活性氧的产生提供充足底物。
2. 掺杂增强催化活性:密度泛函理论计算表明,锰掺杂可促进硫空位位点的结构重构与演化,显著提高Cu₂MnS₃₋᙮的催化活性。
3. 光热电催化激活:在 1064 nm 激光照射下,富含硫空位的MCPG可驱动电荷载流子从高温区向低温区扩散,产生电势差,从而激活光热电催化作用。
内容简介
在肿瘤治疗领域,铜死亡、铁死亡和细胞凋亡的疗效常受限于细胞内铜铁离子不足、缺氧及谷胱甘肽高表达等问题。针对这些挑战,哈尔滨工程大学杨飘萍/冯莉莉、哈尔滨师范大学郭伟等人构建了具有硫空位的可生物降解的MCPG纳米片。该纳米片通过光热电催化、光热增强酶催化及饥饿疗法协同作用,触发肿瘤细胞死亡。锰掺杂促进硫空位形成,经密度泛函理论计算证实可显著提升催化活性。在 1064 nm 激光照射下,MCPG产生温度梯度,激活光热电催化,驱动电荷载流子扩散形成电势差,促进活性氧生成。同时,其通过级联催化利用糖代谢补充H₂O₂和O₂,缓解缺氧并形成自增强机制,还能够消耗谷胱甘肽,破坏氧化还原稳态,诱导免疫原性细胞死亡,抑制肿瘤转移。体内外实验表明,该系统具备良好的抗肿瘤效果及生物安全性,为相关治疗提供了新思路。
图文导读
I 形貌和组成
MCPG的主要制备步骤如图1a所示。采用改进的一锅水热策略制备了富含SV的超薄Cu₂MnS₃₋᙮-PEG(MCP)纳米片。透射电子显微镜(TEM)图像显示,MCP纳米片的长度约为80 nm,宽度约为60 nm(图1b)。在高分辨率TEM(HRTEM)图像中,可以看到立方相(103)晶体平面的晶格间距为0.28 nm(图1c)。元素映射分析显示Cu、S和Mn在MCP纳米片上均匀分散(图1d)。原子力显微镜(AFM)图像显示MCP的厚度约为4–5 nm(图1e, f)。Mn的掺杂没有改变晶体结构,也没有引入新的杂质峰(图1g)。然而,样品的结晶度下降,这是由于合金反应过程中晶体结构的无序性增加和畸变。整合GOx后,通过X射线光电子能谱(XPS)观察到清晰的N信号(图1h),并且由于Cu2⁺向Cu⁺的转变,MCPG中的Cu 2p分裂峰向低结合能移动(图1i和S2)。对于MCPG的S 2p峰,163.2 eV和162.1 eV的结合能分别对应S 2p1/2和S 2p3/2(图1j和S₃)。此外,利用能量色散X射线能谱(EDS)证实了MCPG中存在Cu、S、Mn、N、O和C(图S4)。此外,Mn掺杂后,Cu₂MnS₃₋᙮在g = 2.003处表现出更明显的SV信号,验证了Mn的掺入可以产生丰富的SV(图S5)。测定了MCP、GOx和MCPG的Zeta电位值,表明MCPG纳米片的成功合成(图1k)。此外,采用Bradford法测定MCPG中GOx的加载效率为24.62%(图S7)。在30–600 °C的加热条件下,MCPG的重量减轻了25.82%(图S8)。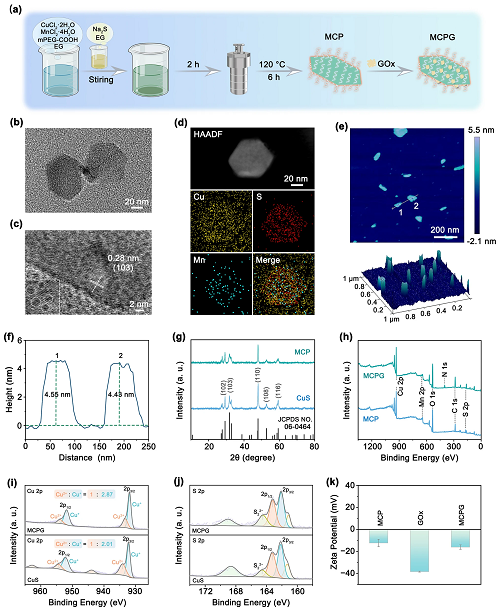
图1. (a) MCPG制备过程示意图;MCP的 (b) TEM,(c) HRTEM,(d) EDS元素图,(e) AFM图像,和 (f) 高度分布图;(g) CuS和MCP的XRD谱图;(h) MCP和MCPG的XPS全谱;CuS和MCPG中(i) Cu 2p和 (j) S 2p的XPS高分辨率光谱;(k) MCP、GOx和MCPG的Zeta电位。
II 光热性能与酶催化活性
mPEG-COOH通过Cu-羧酸盐配位偶联与Cu₂MnS₃₋᙮结合。对于GOx和MCPG,在1660 cm⁻1附近的峰代表蛋白质的酰胺I(图2a)。MCPG纳米片在近红外II区(NIR-II)有明显的吸收(图2b),且样品的吸收强度与MCPG的浓度线性相关,说明样品没有任何聚集现象(图2c)。根据Lambert-Beer定律,从拟合曲线中计算出MCPG在1064 nm处的为4.06 L g⁻1 cm⁻1(图2d)。通过1064 nm激光器(0.7 W cm⁻2)照射MCPG的温度变化曲线和相应的图像证实了MCPG优异的光热转换能力(图2e, f),计算出MCPG的光热转换效率为43.77%(图2g)。在三个加热/冷却循环中,MCPG的光热性能没有明显变化(图2h)。这些结果证明了由于SV引起的NIR-II区域的强等离子体吸收,MCPG纳米片具有出色的光热性能。
通过TMB、OPD和ABTS评估了MCPG的POD样酶活性(图2i)。峰强度随温度升高而增加,说明热效应促进了•OH的产生(图2j)。同样,OPD(图2k)和ABTS(图2l)比色结果与上述结果一致。之后,通过5,5-二甲基-1-吡咯啉n -氧化物(DMPO)探针,用电子自旋共振(ESR)测定•OH的生成(图2m)。在MCPG和H₂O₂同时存在的酸性条件下,1:2:2:1的峰强度证明了•OH的产生。随后,以H₂O₂为底物,研究热疗对MCPG催化特性的影响(图S11a, b)。根据Michaelis-Menten曲线和Lineweaver-Burk图,在25 °C和50 °C条件下,MCPG的Kₘ分别为21.69 mM和19.67 mM,Vₘₐₓ分别为4.83 × 10⁻⁸ M s⁻1和6.90 × 10⁻⁸ M s⁻1(图2n,o)。综上所述,具有空位缺陷的MCPG纳米片具有明显的酶活性,温度升高和掺杂有利于增强其酶活性。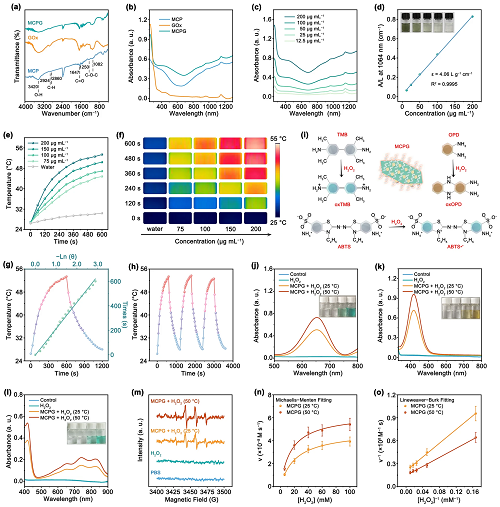
图2. MCP、GOx和MCPG的 (a) 红外光谱与 (b) 紫外-可见吸收光谱;(c) 不同浓度MCPG溶液的紫外-可见吸收光谱;(d) MCPG在1064 nm处的消光系数;在1064 nm激光照射下不同浓度MCPG的 (e) 光热曲线和 (f) 红外热成像图;(g) MCPG溶液的加热和冷却过程;(h) 1064 nm激光照射下MCPG的光热稳定性;(i) TMB、OPD和ABTS的催化氧化示意图;不同处理后 (j) oxTMB,(k) oxOPD,和 (l) oxABTS的紫外-可见吸收光谱;(m) ESR光谱检测•OH的产生;(n) MCPG在25 °C和50 °C下的Michaelis-Menten曲线和Lineweaver-Burk图。
III DFT计算
采用 VASP 进行DFT计算,以评估POD模拟活性的催化机制。由于Mn取代可以加速结构重建,因此在表面构建了独特的Mn−S−Cu排列(图3a)。理想CuS₁₋᙮表面形成SV所需能量为1.16 eV,而Cu₂MnS₃₋᙮表面形成SV所需能量显著降低至0.80 eV,证明Mn掺杂后SV更容易形成(图3b)。建立了理想CuS、CuS₁₋᙮、Cu₂MnS₃和Cu₂MnS₃₋᙮四种计算表面模型,阐明它们的微观电子结构(图3c)。Cu₂₈和Cu₂₀分别作为CuS₁₋᙮和Cu₂MnS₃₋᙮吸附H₂O₂的活性位点(图3d)。Cu₂MnS₃₋᙮的绝对值较小,对H₂O₂的亲和力高于CuS₁₋᙮。此外,通过CuS₁₋᙮和Cu₂MnS₃₋᙮检测掺杂对投射态密度(PDOS)的影响(图3e–g)。Cu₂MnS₃₋᙮表现出比CuS₁₋᙮更窄的能带,这主要归因于额外的缺陷水平。这些缺陷态可以有效地减小带隙,从而降低电子跃迁所需的能量。根据Cu 3d光谱的PDOS确定不同表面上Cu的d带中心(图3h)。Cu₂MnS₃₋᙮中Cu的d带中心出现了明显的下移,这可能是由于形成了大量的SV并取代了Mn。这种取代显著提高了中间体的吸附能,从而提高了催化活性。
为了从热力学角度阐明相应的反应机理,利用优化后的表面对复杂的类POD酶催化过程进行了全面的研究(图3i)。H₂O₂分子在CuS₁₋᙮和Cu₂MnS₃₋᙮上的ΔGads分别为−0.52 eV和−1.04 eV(图3j)。因此,H₂O₂很容易吸附在Cu₂MnS₃₋᙮表面。Cu₂MnS₃₋᙮表面生成2OH*所需的ΔGads仅为−3.33 eV,低于CuS₁₋᙮的−2.06 eV。这些结果表明,Mn掺杂和足够SV缺陷的形成阻碍了H₂O₂分子在Cu₂MnS₃₋᙮表面的稳定,从而导致它们直接解离成低能的2OH*。因此,Mn的取代以及SV的重构和进化,导致Cu₂MnS₃₋᙮的类POD酶催化活性显著提高。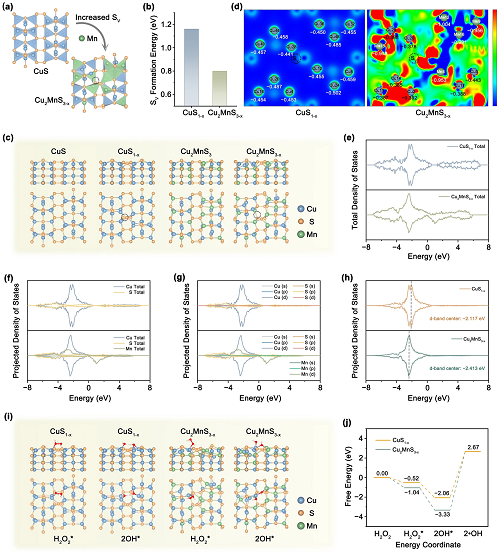
图3. (a) Cu₂MnS₃₋᙮中SV形成的示意图;(b) CuS和Cu₂MnS₃₋᙮的SV生成焓;(c)理想的CuS、CuS₁₋᙮、Cu₂MnS₃和Cu₂MnS₃₋᙮的结构优化;(d) 利用Bader分析程序计算CuS₁₋᙮和Cu₂MnS₃₋᙮优化后的电荷密度以及相应的表面原子有效电荷;(e–g) DOS和PDOS剖面图;(h) CuS₁₋᙮和Cu₂MnS₃₋᙮的Cu 3d态;(i) CuS₁₋᙮和Cu₂MnS₃₋᙮类POD催化过程中初始态(IS, H₂O₂)和终态(FS, 2OH*)的表面结构;(j) Cu₂MnS₃₋᙮类POD酶催化途径的能量图。
IV 降解特性与PTEC机制
通过监测pH值、oxTMB吸收峰强度和亚甲基蓝(MB)降解实验,证明MCPG纳米片促进了葡萄糖氧化成葡萄糖酸和H₂O₂(图4a–c)。根据紫外-可见漫反射光谱计算出MCPG的带隙值为1.07 eV(图4d)。根据莫特-肖特基图,由于负斜率,MCPG显示出p型半导体的特性(图4e)。计算出MCPG的CB/VB值为−0.41/0.66 V(图4f)。在电化学阻抗谱(EIS)中,MCPG的圆弧直径更小,导致电荷转移电阻低(图4g)。因此,Mn的掺杂及其产生的SV可以显著增加光生载流子的密度,提高e⁻–h⁺的分离效率,最终促进催化反应过程。
为了解释MCPG的体外热电偶联酶催化活性,基于等离子体热和塞贝克效应研究了PTEC机制(图4h)。用1064 nm激光照射MCPG纳米片后自然冷却至室温,通过5个开/关激光周期研究了PTEC的作用机理。NBT用于评估PTEC产生的O₂˙⁻的水平(图4i)。随着循环次数增加,特征峰强度逐渐增大(图4j)。随后,采用DPBF指示剂验证了NIR-II→等离子体吸收→热→电→ROS的一系列步骤(图4k)。ESR光谱中六重态和三重态峰进一步表明MCPG可以在冷热交替循环中产生O₂˙⁻和1O₂(图41, m)。此外,过量的内源性GSH可以消耗ROS,抑制抗肿瘤作用,DTNB的峰值下降表明MCPG成功消耗了GSH(图4n, o)。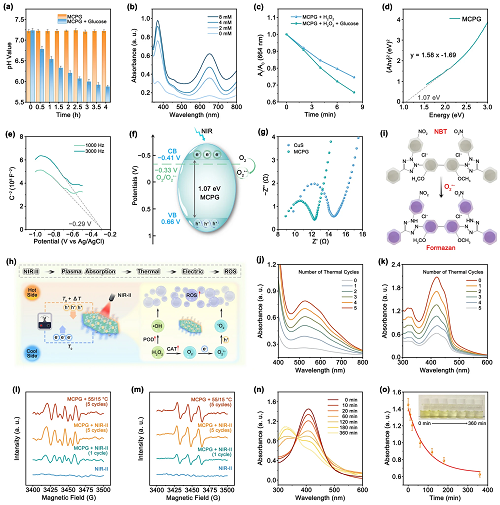
图4. (a) 添加或不添加葡萄糖时MCPG溶液的pH变化;(b) MCPG与不同浓度葡萄糖培养的oxTMB光谱;(c) 添加或不添加葡萄糖时MCPG对MB的降解;(d) 根据紫外-可见漫反射光谱测定MCPG的Tauc图;(e) MCPG的莫特-肖特基图;(f) MCPG能带结构示意图;(g) EIS奈奎斯特图;(h) PTEC机理示意图;(i) NBT与O₂˙⁻氧化还原反应示意图;激光照射周期中MCPG在 (j) NBT和(k) DPBF溶液中的紫外可见吸收光谱;(l) O₂˙⁻和(m) 1O₂的ESR光谱;(n, o) 随时间变化的GSH耗竭。
V 体外抗肿瘤能力
基于MCPG纳米片的突出性能,评估了其治疗效果(图5a)。首先,通过MTT法评估MCPG对L929成纤维细胞、4T1乳腺癌细胞、HepG2肝癌细胞和A549肺癌细胞的生物相容性和细胞毒性。结果表明MCPG具有良好的生物相容性,并且在激光照射下表现出明显的肿瘤细胞损伤(图5b)。随着MCPG与4T1细胞孵育时间的延长,绿色荧光强度逐渐增加,表明MCPG被4T1细胞内吞(图S₃4和图5c)。通过ImageJ软件和激光共聚焦显微镜(CLSM)分析MCPG的亚细胞共定位(图5d)。通过DCFH-DA测定细胞内ROS生成,MCPG + NIR-II组的绿色荧光最明显,证明其优异的ROS生成能力(图5e)。线粒体对细胞凋亡至关重要,通过JC-1染色试剂盒测定了线粒体膜电位(m)(图5f)。在MCPG和NIR-II激光照射下,4T1细胞显示出最明显的绿色荧光,证实线粒体膜电位大部分去极化(图5g)。为了评估细胞膜的完整性,进行了LDH实验。MCPG + NIR-II组出现明显的渗漏,是对照组的1.5倍(图5h)。葡萄糖被广泛认为是肿瘤增殖的关键营养物质,可用于抑制糖酵解,从而降低细胞内ATP水平。细胞内ATP水平随着样品浓度的增加而下降,激光照射后抑制效率更显著,证实了葡萄糖消耗诱导饥饿治疗(图5i)。
图5j描述了通过干扰细胞内氧化还原代谢失调对铜死亡/铁死亡/细胞凋亡的协同治疗。将C11-BODIPY581/591探针插入脂质膜并被脂质过氧化物(LPO)氧化(图5k)。MCPG + NIR-II组表现出明显的绿色荧光,表明LPO的高效积累。通过铜增生调节细胞死亡是一种独特的机制,其特征是过量的铜离子和脂化的DLAT聚集。一般来说,过量的Cu2⁺通过FDX1酶还原为有毒的Cu⁺。然后Cu⁺直接附着在脂化的DLAT末端,导致脂化的DLAT聚集。通过免疫印记检测FDX1、LIAS和DLAT(图5l)。荧光成像也显示了DLAT的寡聚化(图5m)。通过流式细胞术进一步评估纳米片诱导细胞凋亡的能力(图5n和图S43),其中MCPG + NIR-II组细胞凋亡率最高,为76.7%。免疫原性细胞死亡(ICD)的关键标志是高迁移率族蛋白(HMGB1)。与对照组和NIR-II组相比,MCPG + NIR-II组的荧光可以忽略不计(图5o)。因此,协同治疗可有效触发铜死亡/铁是死亡/细胞凋亡,进而刺激免疫系统并诱导免疫应答。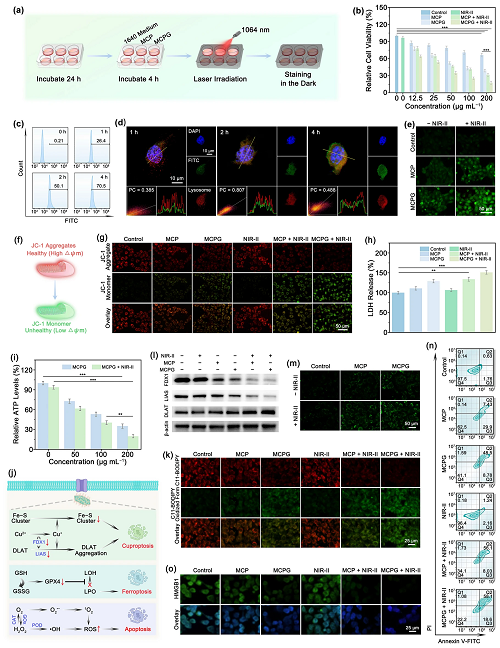
图5. (a) 细胞治疗的示意图;(b) 不同处理后4T1细胞的细胞活力;FITC修饰MCPG的 (c) 流式细胞术检测和 (d) 溶酶体共定位;(e) 细胞内ROS评估;(f) JC-1显色机制;(g) 4T1细胞JC-1检测;(h) 不同处理后LDH释放量的定量分析;(i) 不同方案处理后细胞内ATP的相对百分比;(j) MCPG触发铜死亡/铁死亡/细胞凋亡示意图;(k) 4T1细胞C11-BODIPY581/591染色实验;(l) FDX1、LIAS和DLAT的WB检测;(l) 不同组DLAT成像;(n) 流式细胞术测定细胞凋亡率;(o) 不同组HMGB1表达。
VI 体外和体内成像性能
由于MCPG纳米片强大的光热特性,评估了不同浓度MCPG在体外光声(PA)成像中的潜力(图6a)。随着浓度的增加,PA信号强度增强(图6b)。随后,在给药MCPG后,分别在注射后0、1、3、6、12和24 h采集肿瘤部位的PA图像(图6c)。由于MCPG的积累,信号强度在静脉注射后12 h达到峰值。同时,注射MCPG 12 h后,NIR-II激光照射10 min内肿瘤温度升高至51.7 °C(图S46和图6d)。此外,由于铜(II)中存在未配对电子,它可以作为T1加权核磁(MR)成像的造影剂(图6e)。随着MCPG浓度升高,MR成像信号强度逐渐增强(图6f)。静脉注射MCPG纳米片后,小鼠在12 h时表现出最大信号强度(图6g)。因此,MCPG在PA和MR成像引导下的肿瘤协同治疗中应用效果显著。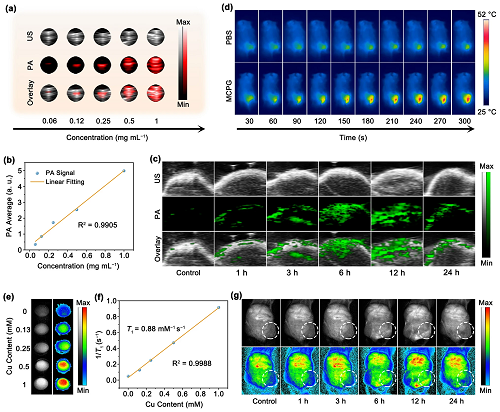
图6. (a, b) 体外PA成像及与MCPG浓度的线性拟合;(c) 注射后不同时间MCPG的体内PA成像;(d) 注射MCPG和PBS后12 h的红外热像图;(e, f) 体外MR成像及与MCPG浓度的线性拟合;(g) 注射后不同时间点MCPG的体内T1加权MR成像。
VI 体内抗肿瘤治疗效果
为了评估MCPG纳米片在体内的抗肿瘤能力,对携带4T1肿瘤的雌性BALB/c小鼠建立了异种移植模型(图7a)。由于网状内皮系统捕获,在肝脏和脾脏均观察到Cu水平升高。注射后12 h,肿瘤区域Cu浓度峰值为6.02% IDg⁻1,表明MCPG在肿瘤部位的积累(图7b)。血液循环半衰期t1/2() = 0.32 h, t1/2() = 3.94 h(图7c, d)。体内代谢行为证实MCPG通过粪便和尿液从小鼠体内排出,从而避免了长期毒性(图S48)。将小鼠分为6组,其中MCPG + NIR-II组表现出最有效的肿瘤生长抑制(图7e, f)。通过第14天的肿瘤重量评估和相应的数码照片进一步证实各治疗组的抑瘤效果(图7g和图S49)。在14天的治疗期内,各组小鼠的体重均略有增加,表明MCPG对小鼠整体健康状况的影响可以忽略不计(图7h)。不同时间点处理小鼠的血液学分析也表明MCPG纳米片具有良好的生物相容性和生物安全性(图7i)。各组主要脏器苏木精和伊红(H&E)染色显示MCPG无明显副作用(图S50)。在肿瘤切片中,MCPG + NIR-II组肿瘤坏死最明显。FDX1和GPX4表达的显著下调以及TUNEL实验中明显的红色荧光信号都证实了铜死亡/铁死亡/细胞凋亡通路的激活(图7j)。
诱导抗肿瘤免疫应答依赖于ICD的关键作用。取小鼠脾脏制备细胞悬液,用流式细胞术检测共刺激分子CD80和CD86的水平。与对照组(6.14%)相比,MCPG + NIR-II组中DCs成熟度最高(15.6%)(图S51)。通过ELISA获得相关的免疫调节细胞因子水平,包括TNF-和IFN-。MCPG + NIR-II组细胞因子水平最高,验证了协同治疗在增强树突细胞成熟和促进免疫激活方面的功效(图7k, 1)。治疗21天后观察肺转移情况,对照组肺转移结节最多,而MCPG + NIR-II组肺转移结节最少。H&E染色对代表性肺组织的组织学检查显示,MCPG + NIR-II治疗组显著抑制肿瘤转移(图7m)。综上所述,具备PTEC、光热增强酶催化和饥饿协同治疗作用的MCPG纳米片不仅表现出显著的抗肿瘤功效,而且还促进了对肿瘤转移的免疫反应。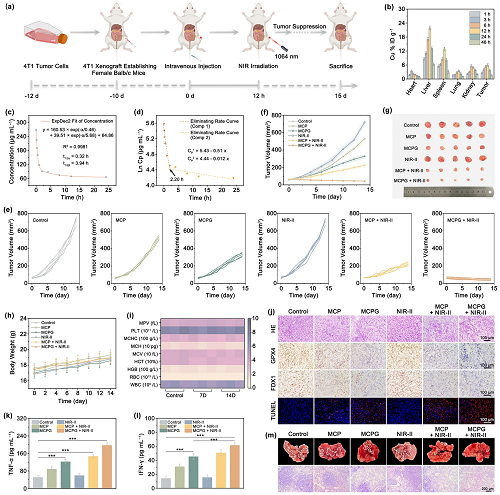
图7. (a) MCPG抗肿瘤治疗示意图;(b) 不同时间间隔下Cu的生物分布;MCPG的 (c)血液循环曲线和 (d) 消除率曲线;肿瘤的 (e, f) 体积变化曲线和 (g) 照片;(h) 小鼠平均体重;(i) 静脉注射MCPG后7和14天小鼠血液学指标变化;(j) 肿瘤组织H&E、GPX4、FDX1、TUNEL染色成像。ELISA法测定血浆中 (k) TNF-和 (l) IFN-细胞因子水平;(m) 肺转移结节代表性图像及H&E染色成像。
VII 总结
合成了可生物降解的富含SV的MCPG纳米片,通过破坏细胞内氧化还原稳态来治疗肿瘤。MCPG通过PTEC、光热增强酶催化和饥饿治疗触发铜死亡/铁死亡/细胞凋亡和抗肿瘤免疫反应。具有丰富SV的MCPG表现出优异的光热转换效率(43.77%),导致局部温度升高。由此产生的材料内部温度梯度驱动载流子从热端向冷端扩散,随后产生电位差,促进ROS的产生。利用类POD和类CAT酶活性,可以产生•OH和O₂。O₂的生成可以改善肿瘤缺氧,通过糖代谢补充耗尽的H₂O₂,并放大ROS生成,形成级联催化反应,建立正反馈循环机制。密度泛函理论计算表明,掺杂诱导的空位缺陷显著提高了酶催化活性。氧化应激促进的铜死亡/铁死亡/细胞凋亡由热、ROS和铜聚集激活,破坏线粒体代谢并增强治疗效果。此外,该系统可以刺激ICD,从而诱导免疫反应,抑制肿瘤转移。
本研究介绍了一种独特的研究策略,通过触发细胞死亡途径来利用能量转换纳米材料进行肿瘤治疗。本研究不仅为成像引导的铜死亡/铁死亡/细胞凋亡三重诱导剂提供了一种策略,而且拓展了铜基热电材料在生物医学领域的应用范围和深度,从而为未来癌症免疫治疗的发展提供了一个有希望的发展方向。
作者简介




Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 哈工程杨飘萍等:硫空位氧化还原干扰剂的设计,用于光热电与级联催化驱动的铜死亡-铁死亡-细胞凋亡肿瘤疗法
 Nano-Micro Letters
Nano-Micro Letters 西北工业大学张秋禹&张和鹏&王天帅等:改性不可逆键COFs实现高效CO₂还原
西北工业大学张秋禹&张和鹏&王天帅等:改性不可逆键COFs实现高效CO₂还原 中科院宁波材料所叶继春&苏州大学杨阵海等:蒸镀超薄spiro-OMeTAD助力n-i-p钙钛矿/晶硅叠层太阳能电池效率与稳定性突破
中科院宁波材料所叶继春&苏州大学杨阵海等:蒸镀超薄spiro-OMeTAD助力n-i-p钙钛矿/晶硅叠层太阳能电池效率与稳定性突破 南京航空航天大学姬广斌:多尺度跨波段防护系统实现可见光、动态红外伪装与电磁屏蔽一体化
南京航空航天大学姬广斌:多尺度跨波段防护系统实现可见光、动态红外伪装与电磁屏蔽一体化 广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机
广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机