In Situ Synthesis of Fluorescent Mesoporous Silica–Carbon Dot Nanohybrids Featuring Folate Receptor-Overexpressing Cancer Cell Targeting and Drug Delivery
Nano-Micro Lett. (2019) 11: 32
https://doi.org/10.1007/s40820-019-0263-3
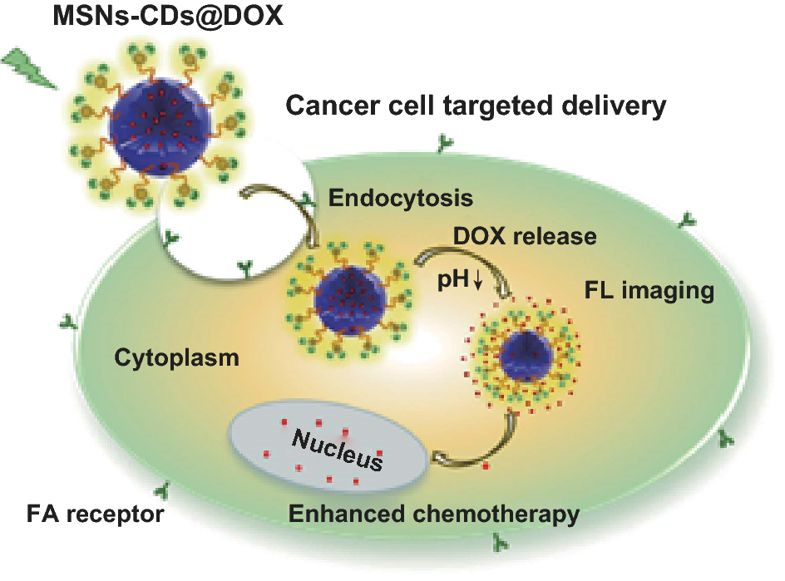
2 所制备的MSNs‒CDs纳米杂化物展现出稳定且明亮的黄光发射、良好的生物相容性及对叶酸受体过表达的癌细胞具有靶向的功能,可作为一种荧光成像引导下的药物载体,有效地向肿瘤部位递送抗癌药物。
目前,化疗仍是大多数癌症的主要治疗选择。然而,化疗效果易受系统毒性、非特异性相互作用和多药耐性的影响,这些因素同时会造成严重的毒副作用。为了降低化疗毒副作用并提高治疗效果,研究者们将关注的重点转向了药物递送系统(drug delivery systems, DDSs)。
在多种以纳米材料为基础的DDSs中,介孔硅纳米颗粒(MSNs)以其独特的性质,包括介孔结构、大的比表面积与孔体积、高的生化和理化稳定性、特别是良好的生物相容性等,已被证明是细胞内药物递送的优良载体。
为了进一步提高DDSs的治疗效果,学者们期望能够同时赋予其诊断与靶向的能力。碳点(carbondots, CDs),作为一种新型的荧光碳基纳米材料,近年来受到了广泛的关注。与有机染料、半导体量子点和上转换纳米颗粒相比,CDs具有制备简便、水溶性好、发光性能可调、光稳定性高及生物相容性好等优点。基于这些优越的特性,CDs已被用于制备具有诊断功能的荧光MSNs。
此外,叶酸受体(folate receptor, FR)在某些人类癌细胞表面过度表达,因此叶酸(folic acid, FA)常被用于与荧光染料和纳米颗粒结合,实现靶向癌细胞的选择性成像。
👇
中科院宁波材料所林恒伟&北京理工大学束庆海通过FA与氨基功能化的MSNs之间的溶剂热反应,开发出了一种原位制备荧光MSNs‒CDs纳米杂化物的简便方法。
制备的MSNs‒CDs纳米杂化物不仅表现出强而稳定的黄光发射,还保留了MSNs的独特性质,进一步展现了荧光成像引导下递送抗癌药物的能力。
特别地,该MSNs‒CDs纳米杂化物可选择性地靶向FR过表达的癌细胞,例如人宫颈癌细胞(HeLa),能够在有效增强抗癌药物化疗效果的同时降低毒副作用。
荧光MSNs‒CDs纳米杂化物的光学、载药和药物控制释放性能
图3表明,随着激发波长从420 nm增加到520 nm,MSNs‒CDs纳米杂化物的发射波长只有轻微的红移,这种发射主要是由于FA前驱体在溶剂热反应过程中发生碳化,最终形成荧光CDs而产生。
通过计算,MSNs‒CDs纳米杂化物的DOX负载量高达250 mg/g,随后进行的不同pH下的DOX释放实验表明MSNs‒CDs纳米杂化物具有pH响应的控制释放行为。结合光稳定性的研究结果,MSNs‒CDs纳米杂化物可作为荧光成像引导下的载体用于抗癌药物的递送。
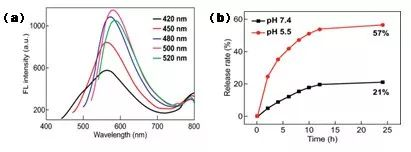
图3(a) 不同激发波长下MSNs‒CDs纳米杂化物的荧光发射光谱图;(b) 37℃和不同pH条件下MSNs‒CDs@DOX的体外释放曲线图。
👇
荧光MSNs‒CDs纳米杂化物的癌细胞靶向能力
如图4所示,对MSNs‒CDs纳米杂化物的生物相容性和靶向能力进行了细胞水平上的研究。
细胞毒性实验表明MSNs‒CDs纳米杂化物有良好的生物相容性,而不同类型细胞之间的细胞毒性差异可能来源于两方面:一是不同类型细胞对MSNs‒CDs纳米杂化物的摄取能力不同,二是不同类型细胞对外源物质的耐受性存在差异。
共聚焦荧光成像(CLSM)和流式细胞术结果一致证实了细胞摄取MSNs‒CDs的效率依赖于FR表达程度,即MSNs‒CDs能够选择性地靶向FR过表达的癌细胞,特别是HeLa细胞
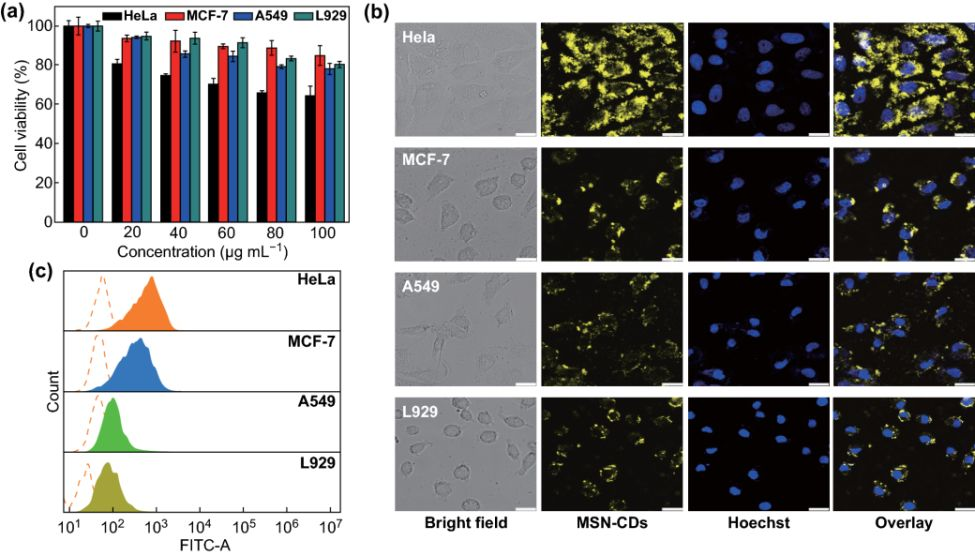
图4 (a) 不同浓度(0、20、40、60、80和100 μg/mL)MSNs‒CDs纳米杂化物对四种细胞(HeLa、MCF-7、A549和L929)的细胞毒性;(b)-(c):与200 μg/mL MSNs‒CDs纳米杂化物孵育4h后,不同细胞的CLSM图像和流式细胞术分析结果。
图5所示的竞争实验进一步的证实了MSNs‒CDs纳米杂化物内化进入HeLa细胞主要是通过FR介导的内吞作用。
细胞水平上的结果表明MSNs‒CDs纳米杂化物可在荧光成像引导下将抗癌药物选择性地递送到FR过表达的癌细胞。
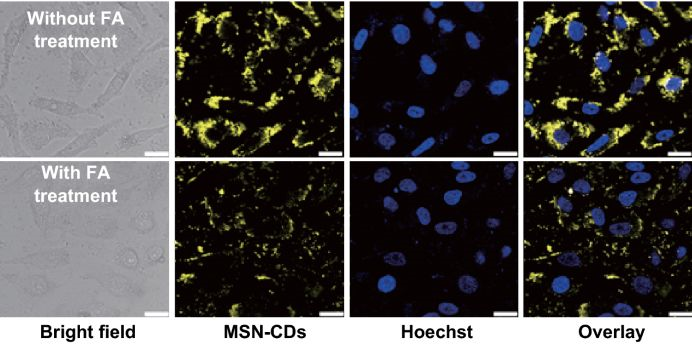
图5 (a) HeLa细胞与200μg/mL的MSNs‒CDs纳米杂化物孵育4 h的CLSM图像;(b) 作为对比,HeLa细胞首先用过量FA预处理使FR饱和,然后与200 μg/mL的MSNs‒CDs孵育4 h的CLSM图像。
👇
DOX负载的MSNs‒CDs纳米杂化物在细胞层面的治疗效果
如图6所示,我们初步评估了负载DOX后的MSNs‒CDs纳米杂化物(MSNs‒CDs@DOX)对肿瘤细胞的增强化疗效果。
结果表明,与当量浓度的DOX相比,MSNs‒CDs@DOX对HeLa细胞具有更高的疗效;此外,同样经过MSNs‒CDs@DOX处理,L929这类正常细胞的存活率明显高于HeLa和MCF-7两种癌细胞(尤其是HeLa细胞),表明MSNs‒CDs@DOX对正常细胞或组织具有更低的毒副作用。
上述结果表明,MSNs‒CDs纳米杂化物可作为抗癌药物的有效载体,能够在提高化疗效率的同时降低毒副作用。
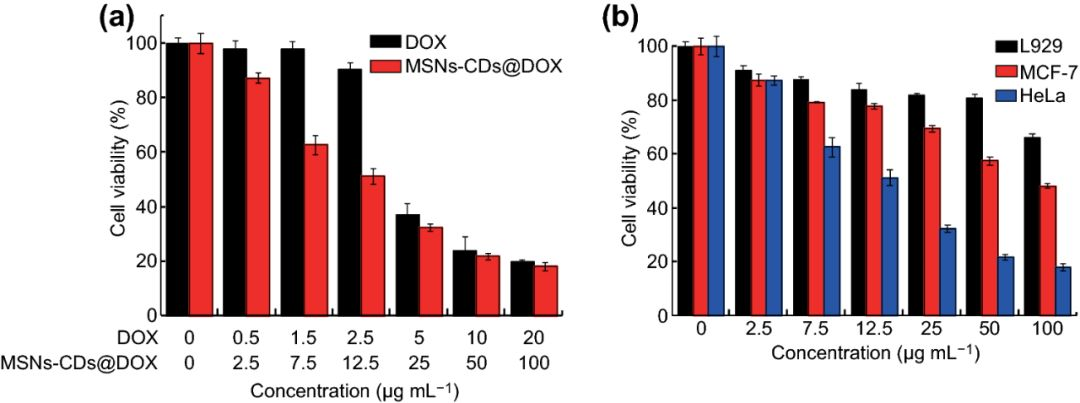
图6(a)不同浓度的MSNs‒CDs@DOX和对应当量浓度的DOX对HeLa细胞的治疗效果;(b)不同浓度的MSNs‒CDs@DOX对L929、MCF-7和HeLa细胞的治疗效果。

束庆海
特聘研究员
北京理工大学材料科学与工程学院
分子实验室的构建及其在环境检测、生物示踪、爆炸物检测方面的应用等。
Email: qhshu121@bit.edu.cn

林恒伟
研究员
中国科学院宁波材料技术与工程研究所
碳基纳米发光材料的性能调控与应用,新型传感技术开发与应用等
Email: linhengwei@nimte.ac.cn

赵帅
博士研究生
北京理工大学材料科学与工程学院
中科院宁波材料技术与工程研究所联合培养
碳基纳米荧光材料的制备及其在生物医学领域的应用
E-mail: 2120161202@bit.edu.cn
癌症标志物检测:基于纳米牛血清白蛋白功能化的石墨烯生物传感器
E-mail:editorial_office@nmletters.org
Tel:86-21-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » NML研究文章|“智能快递员”:荧光介孔硅-碳点赋能药物递送
 Nano-Micro Letters
Nano-Micro Letters 综述:细胞膜仿生—纳米生物医药新技术
综述:细胞膜仿生—纳米生物医药新技术 NML综述 | 碳点的绿色合成、发光特性及其生物医学传感应用
NML综述 | 碳点的绿色合成、发光特性及其生物医学传感应用 NML研究文章 | 体内肿瘤的靶向检测与治疗:基于SiO2中空核-壳纳米结构的双模态PET/光学成像系统
NML研究文章 | 体内肿瘤的靶向检测与治疗:基于SiO2中空核-壳纳米结构的双模态PET/光学成像系统 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人