
Nanoparticle‑Loaded Polarized‑Macrophages for Enhanced Tumor Targeting and Cell‑Chemotherapy
Teng Hou, Tianqi Wang, Weiwei Mu, Rui Yang, Shuang Liang, Zipeng Zhang, Shunli Fu, Tong Gao, Yongjun Liu*, Na Zhang*
Nano‑Micro Lett.(2021)13:6
https://doi.org/10.1007/s40820-020-00531-0
1. 设计了基于巨噬细胞的药物递送体系,将细胞治疗与化学治疗相结合。
2. M1型巨噬细胞作为化疗药物的递送载体,可提高化疗药物的靶向递送。
3. M1型巨噬细胞递送体系具备多功能性,可同时发挥免疫治疗作用。
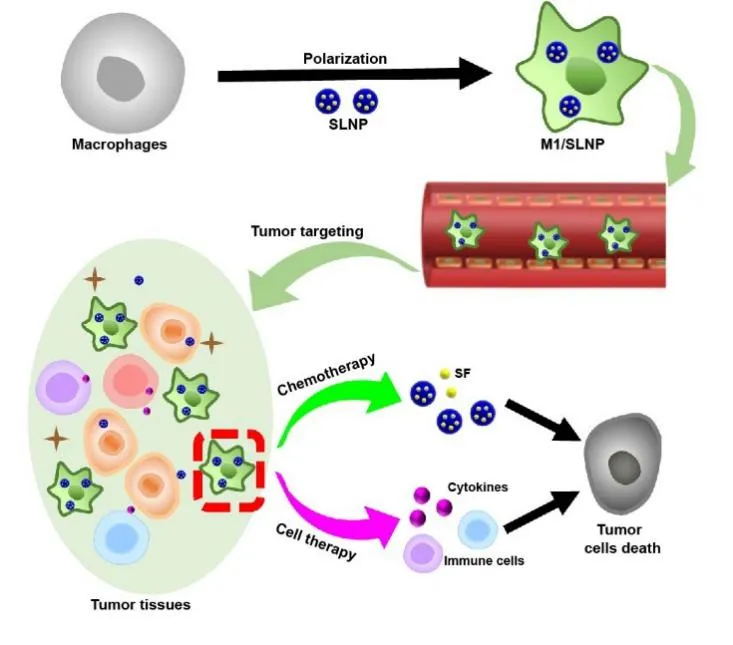
载化疗药物的纳米粒可提升癌症化疗效果;细胞治疗将具有治疗作用的免疫细胞输送至机体,具有特异性、靶向性和副作用小等优势,是一种极具潜力的肿瘤治疗方法。本研究将细胞治疗与化学治疗相结合,设计了载化疗药物纳米粒的巨噬细胞递送体系,该体系可增强化疗药物的肿瘤靶向递送,同时,极化的巨噬细胞可逆转肿瘤免疫抑制微环境,从而提高了肿瘤治疗效果。山东大学药学院药剂学研究所张娜教授团队结合细胞治疗与化学治疗的优势,以具有免疫治疗及肿瘤靶向双重作用的M1型巨噬细胞为基础,设计了载索拉非尼脂质纳米粒的M1型巨噬细胞递送体系(M1/SLNP)。M1型巨噬细胞作为化疗药物索拉非尼的递送载体,提高了索拉非尼在肿瘤部位的蓄积量,增强了化学治疗效果,同时M1型巨噬细胞作为细胞治疗的工具,逆转肿瘤免疫抑制微环境,具有显著的协同抗肿瘤效果。
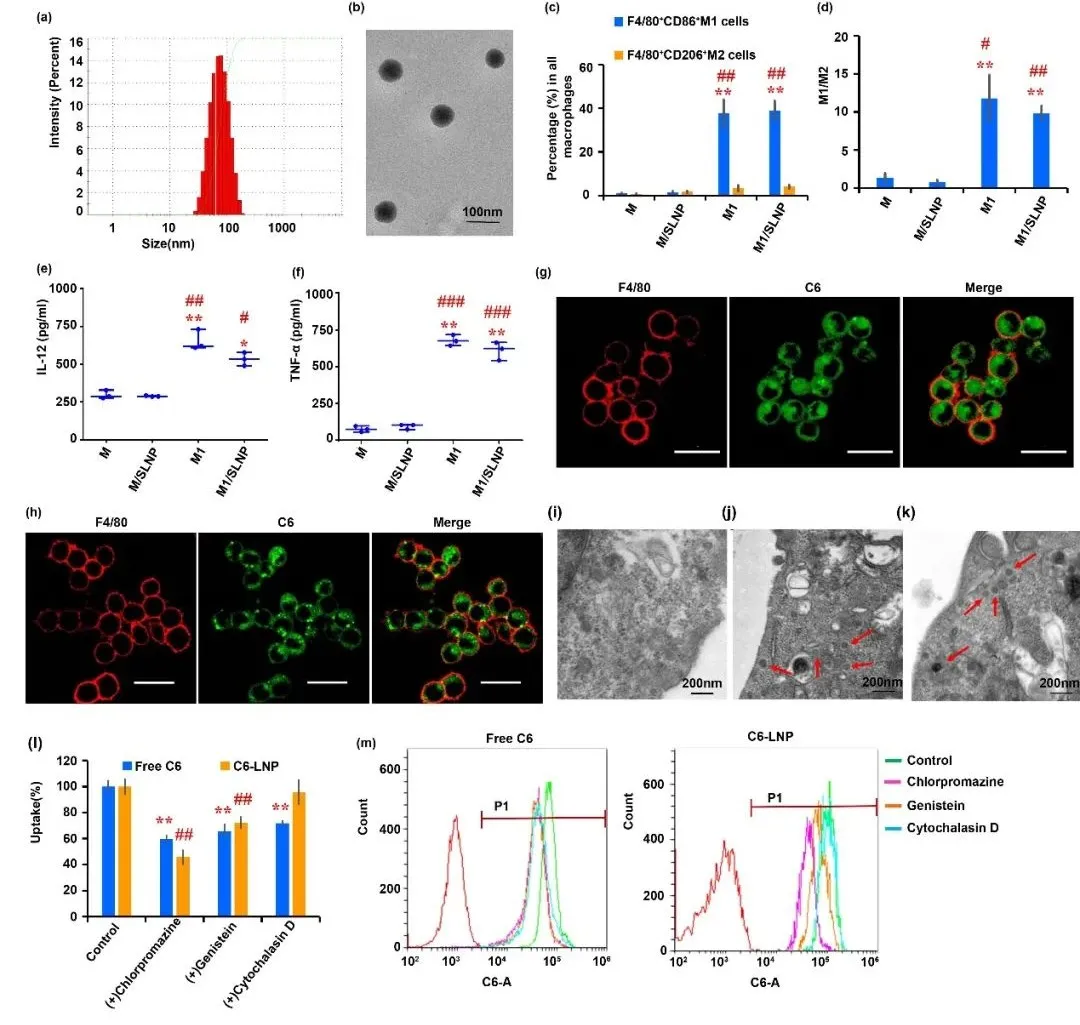
采用纳米沉淀法制备SLNP,形状圆整,分布较均匀,平均粒径为67.63±5.02 nm(图1a, b)。M1/SLNP中巨噬细胞被诱导极化为M1型巨噬细胞(图1c, d),具备分泌免疫促进性细胞因子IL-12和TNF-α的能力(图1e, f),为M1型巨噬细胞作为免疫治疗工具,发挥抗肿瘤免疫作用提供理论依据。激光共聚焦显微镜法和透射电镜结果表明M1/SLNP成功制备(图1g-k),表明细胞成功包载SLNP。
图1. M1/SLNP的表征。(a) SLNP粒径分布,(b) SLNP透射电镜图片,(c, d) 体外巨噬细胞表型分析,(e, f) 体外细胞因子检测结果,(g-k) 载药表征,(l, m) 内吞机制表征。
II SLNP能够从M1/SLNP中释放并具备肿瘤深层渗透能力
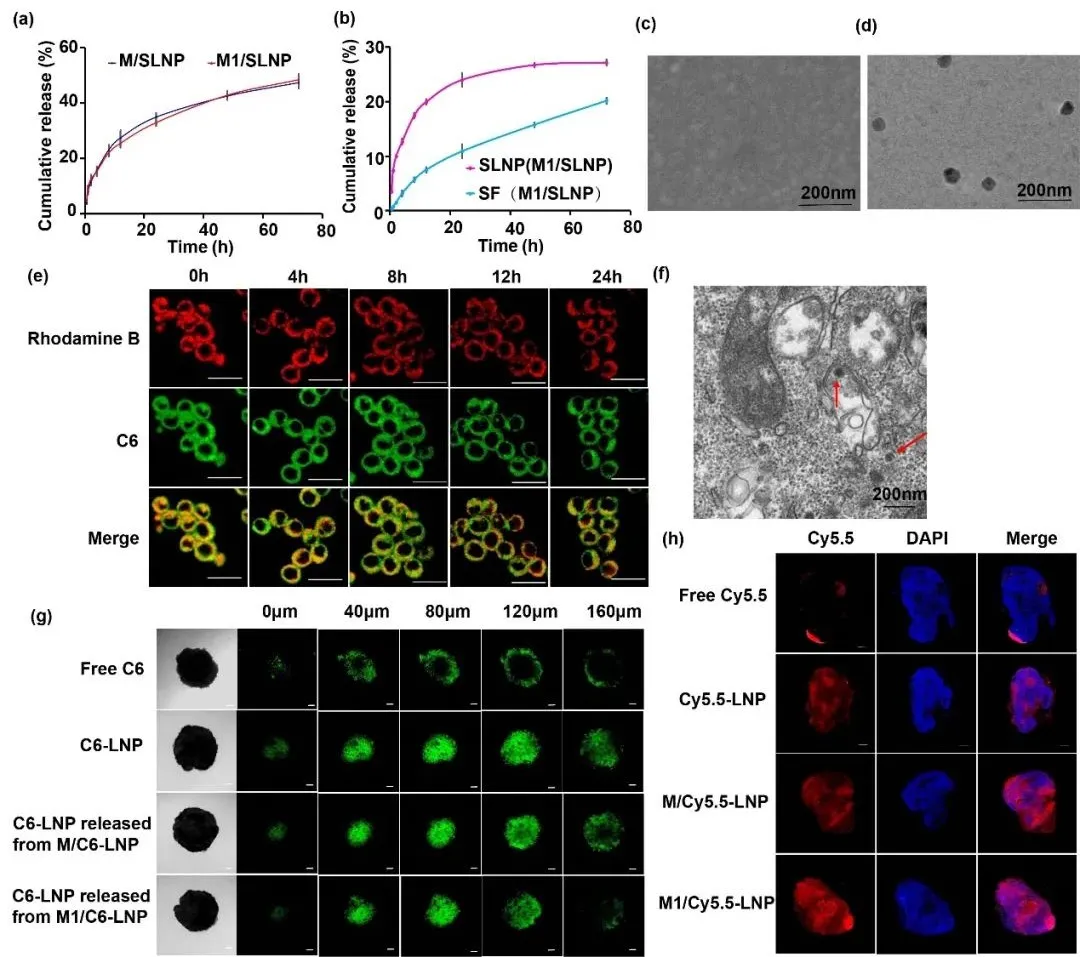
考察M1/SLNP的体外释放行为及SF的释放形式,结果表明SF能够从M1/SLNP中以游离SF或SLNP两种形式有效释放;从M1/SLNP中释放的SLNP具备肿瘤深层渗透能力。
图2. SLNP能够从M1/SLNP中释放并具备肿瘤深层渗透能力。(a) M1/SLNP释放曲线,(b-d) 释放行式考察,(e) M1/C6-LNP的激光共聚焦图片,(f) M1/SLNP在24 h时的透射电镜图片,(g, h) 肿瘤深层渗透性评价。
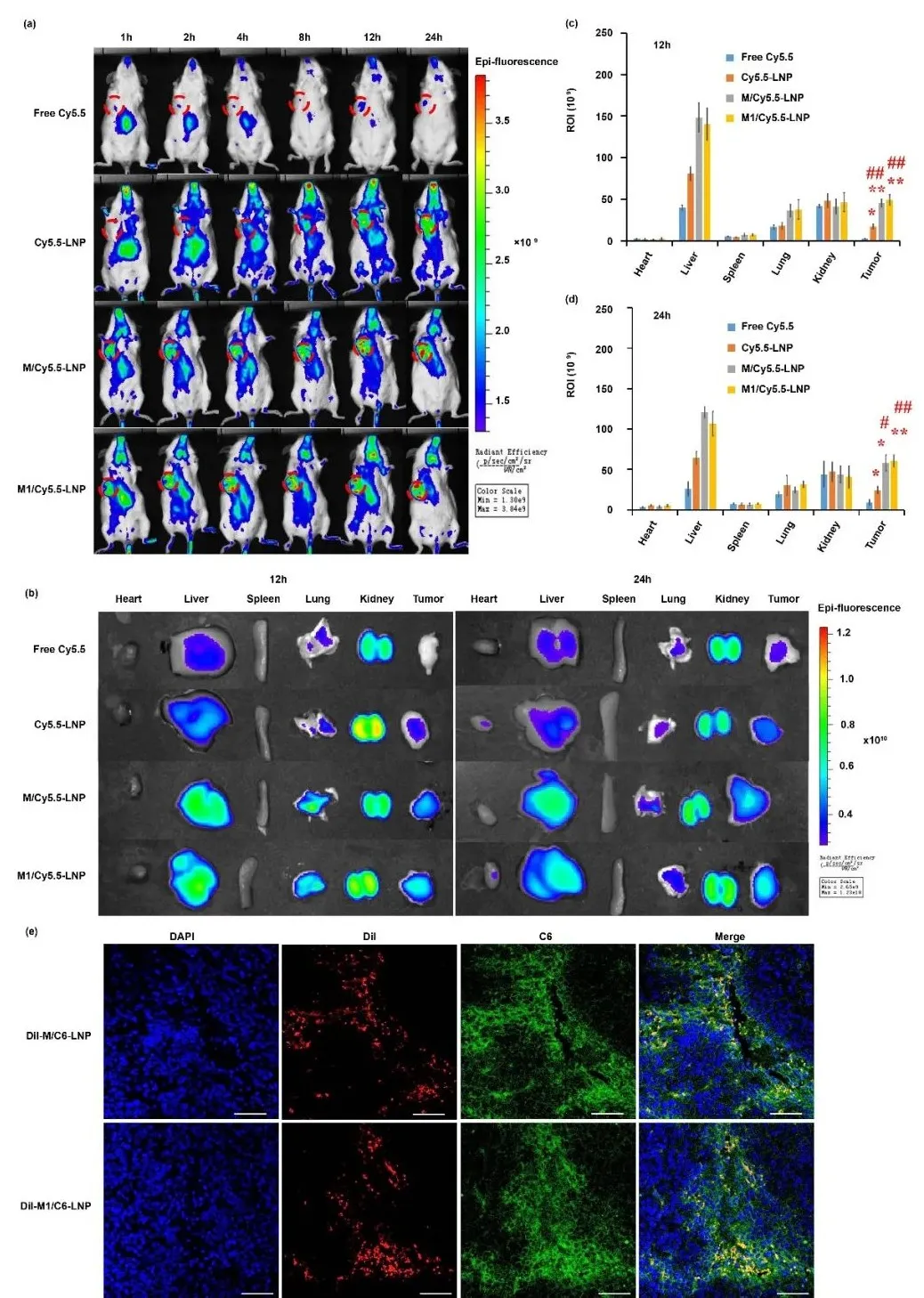
M1/SLNP能显著提高化疗药物SF在肿瘤部位的蓄积,被递送至肿瘤部位的药物能从细胞载体中释放,表明M1型巨噬细胞是有效的肿瘤靶向递送载体。
图3. SLNP能够从M1/SLNP中释放并具备肿瘤深层渗透能力。(a-d) 活体成像评价,(e) 肿瘤组织切片共聚焦图片。
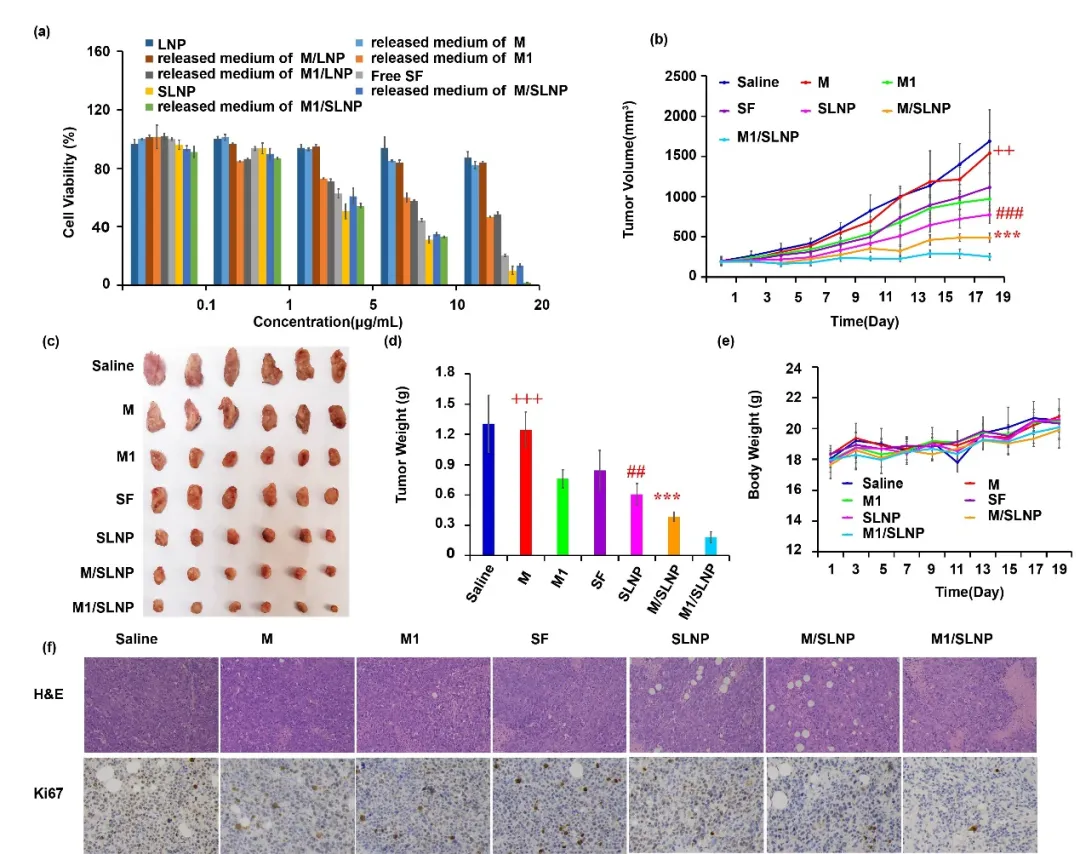
M1/SLNP组具有更好的体内抗肿瘤治疗效果,一方面M1型巨噬细胞作为药物靶向递送的载体,提高了SLNP在肿瘤部位的蓄积量,另一方面M1型巨噬细胞作为细胞治疗的工具发挥了抗肿瘤免疫治疗效果,通过两方面的共同作用,增强了抗肿瘤效果。
图4. M1/SLNP能够增强抗肿瘤效果。(a) 体外细胞存活率,(b) 瘤体积变化曲线,(c) 肿瘤照片,(d) 瘤重柱状图,(e) 体重变化,(f) 肿瘤组织的H&E及Ki67结果。
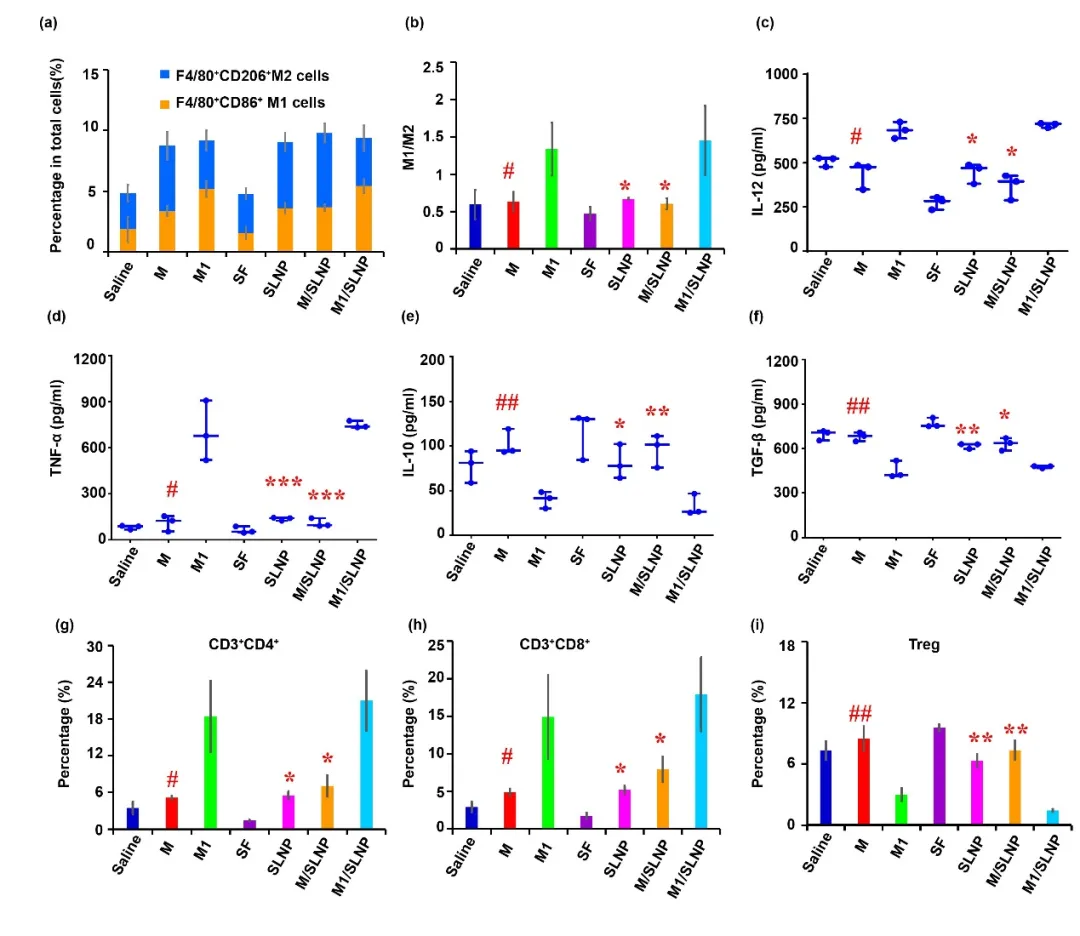
对治疗后小鼠肿瘤组织内巨噬细胞表型、血清中细胞因子水平、肿瘤组织CD3⁺CD4⁺T细胞、CD3⁺CD8⁺T细胞及Treg细胞含量进行分析,结果显示M1/SLNP能够增加肿瘤组织中M1型巨噬细胞的比例;提高血清中免疫促进性细胞因子IL-12和TNF-α含量,降低免疫抑制性细胞因子IL-10和TGF-β含量;提高肿瘤组织中CD3⁺CD4⁺T细胞和CD3⁺CD8⁺T细胞比例,降低Treg细胞比例。结果表明M1/SLNP能够逆转肿瘤免疫抑制微环境。
图5. M1/SLNP能够改善肿瘤免疫抑制微环境。(a, b) 肿瘤组织巨噬细胞表型流式分析,(c-f) 血清中细胞因子含量分析,(g-i) 肿瘤组织中CD3⁺CD4⁺T细胞、CD3⁺CD8⁺T细胞、Treg比例。
 张娜
张娜
本文通讯作者
山东大学 教授
新型纳米药物递送系统,肿瘤化学免疫联合治疗。
▍主要研究成果
教育部新世纪优秀人才,山东大学学科高峰计划药物动力学学科带头人。近年来主持科研课题17项,其中国家级课题9项。已发表研究论文110余篇,其中被SCI收录85篇,2014-2019年被国际爱思唯尔(Elsevier)科学文献出版社评为中国高被引学者。主编教材2部,参编教材10部。授权专利18项。
▍Email: zhangnancy9@sdu.edu.cn
 刘永军
刘永军
本文通讯作者
山东大学 副教授
纳米递送系统用于化疗药物肿瘤靶向递送、可控释放研究、癌症的早期诊断诊疗、化学免疫联合治疗研究。
▍主要研究成果
入选山东大学青年学者未来计划。近年来作为项目负责人主持国家自然科学基金青年基金,中国博士后科学基金57批面上项目等项目6项,参与承担国家自然科学基金、“重大新药创制”科技重大专项孵化基地项目等课题8项。已发表学术论文20余篇,授权专利5项,参编专著2部。
▍Email: liuyongjun@sdu.edu.cn

Nano-Micro Letters《纳微快报》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2019 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前15%)。2019 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
Tel:021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 封面文章:功能化巨噬细胞整合化疗提高癌症治疗效果

 张娜
张娜 刘永军
刘永军
 Nano-Micro Letters
Nano-Micro Letters 纳米药物递送系统:用于肿瘤化学免疫联合治疗的研究进展
纳米药物递送系统:用于肿瘤化学免疫联合治疗的研究进展 复旦大学王建新:一石四鸟—基于人参皂苷的新型多功能肿瘤靶向治疗脂质体
复旦大学王建新:一石四鸟—基于人参皂苷的新型多功能肿瘤靶向治疗脂质体 肿瘤免疫治疗:Bi2Se3@AIPH纳米结构NIR光热+光动力联合方案
肿瘤免疫治疗:Bi2Se3@AIPH纳米结构NIR光热+光动力联合方案 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人