研究背景
糖尿病足溃疡(DFU)是全球范围内严峻的公共健康挑战,高血糖导致伤口持续炎症与大量渗出液,形成细菌滋生、组织损伤的恶性循环。现有亲水性敷料吸收能力有限,易饱和粘连,无法实现高效持续的引流,严重影响愈合进程。自然界中,仙人掌刺凭借其梯度结构能定向输水,为这一难题提供了灵感。本研究受此启发,创新性地设计了一种仿生Janus纳米纤维膜。该膜如同“水二极管”,通过疏水(下层)到亲水(上层)的梯度润湿性与梯度孔径,赋予其持续、单向的自引流能力。更巧妙的是,上层引入的光敏剂氯醌e6 (Ce6)可利用外部光能,同步实现光热蒸发以增强引流动力,并产生活性氧进行高效杀菌(效率达99%)。这项研究将自然的智慧与材料科学结合,创造出一种兼具智能排水与主动抗菌的双功能平台,为开发新一代糖尿病伤口敷料提供了突破性策略。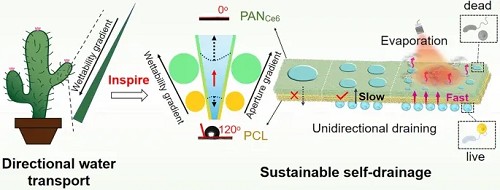
Cactus Thorn‑Inspired Janus Nanofber Membranes as a Water Diode for Light‑Enhanced Diabetic Wound Healing
Mei Wen, Nuo Yu, Xiaojing Zhang, Wenjing Zhao, Pu Qiu, Wei Feng, Zhigang Chen*, Yu Chen*, Meifang Zhu
Nano-Micro Letters (2026)18: 101
https://doi.org/10.1007/s40820-025-01904-z
本文亮点
1. 仿生协同,光驱引流:受仙人掌刺启发,构建了具有垂直方向梯度润湿性与梯度孔径的Janus膜,实现了持续、单向的自引流。
2. 双光协同,强效抗菌:创新性地将光热治疗与光动力治疗集成于Janus膜中。在光照下,不仅能产生热量促进水分蒸发,还可产生活性氧,实现对细菌的双重精准打击,杀菌效率高达99%。
3. 调控微环境,促伤口愈合:该膜的多功能协同不仅高效清除渗出液并消灭细菌,更能从根源上调控伤口微环境:及时移除炎性因子、引导巨噬细胞向修复表型极化,从而有效促进血管新生与组织再生,系统性加速糖尿病伤口愈合。
内容简介
针对糖尿病伤口因持续炎症与过量渗出液导致的感染难愈、甚至截肢等问题,临床亟需能同步解决引流与抗菌的智能敷料。东华大学陈志钢教授团队受自然界仙人掌刺梯度结构的启发,创新设计出一款仿生Janus纳米纤维膜,兼具“水二极管”般的定向引流与光响应双重杀菌功能。该敷料通过构筑上层亲水(小孔径)、下层疏水(大孔径)的垂直梯度结构,实现渗出液持续自引流,速率高达0.95 g cm⁻² h⁻¹。同时,上层负载的光敏剂氯醌e6 (Ce6)可在光照下同步发挥光热与光动力效应,在提升引流动力的同时高效灭菌,抗菌率达99%。实验表明,该膜不仅能有效排出炎性渗出液、清除细菌,还可调控巨噬细胞向修复型极化,促进血管新生,加速组织愈合。在动物实验中,使用该敷料的伤口在17天内愈合率达到96.5%。此项研究通过仿生设计与光能协同,为糖尿病慢性伤口治疗提供了“引流‑杀菌‑修复”一体化新策略,有望推动新一代智能伤口敷料的临床转化。
图文导读
I 仿生“光泵”敷料:结构-功能协同促伤口愈合新策略
如图1所示,受仙人掌刺的梯度结构启发,本研究设计了一种具有持续自引流与光响应杀菌功能的智能Janus纳米纤维敷料。该敷料通过将含光敏剂Ce6的亲水性PAN层(小孔径)沉积于疏水性PCL层(大孔径)之上,构建出垂直梯度润湿性与梯度孔径结构,利用毛细力与润湿力差异驱动渗出液自下而上单向、持续泵送。在此基础上,上层Ce6在光照下可同时产生热量与单线态氧,发挥光热效应(加速蒸发,增强引流)与光动力效应(产生活性氧),实现对细菌的协同高效杀灭,杀菌率达99%。通过这种协同作用,该膜既能及时移除富含炎性因子的渗出液,又能有效控制感染,从而调控伤口微环境,促使巨噬细胞由促炎M1型向促修复M2型极化,进而促进血管新生,系统性地加速糖尿病伤口愈合。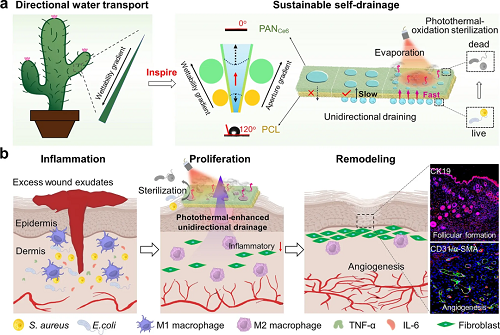
图1. Janus纤维膜PCL/PANx%Ce6的制备和其促进伤口愈合过程的示意图。
II 梯度构建与性能初证:Janus膜的仿生结构及光响应特性
通过静电纺丝技术成功制备了具有不同Ce6负载量(x=0, 0.8, 1.6, 3.3)的PCL/PANx%Ce6 Janus纳米纤维膜。纤维膜的微观结构是其功能实现的基础。扫描电镜结果显示,纤维表面光滑,底层疏水PCL纤维平均直径约为154.9 nm,上层亲水PAN纤维约为242.2 nm,负载Ce6后因溶液性质变化直径增至319.4 nm;该纳米纤维结构(50–500 nm)模拟了天然细胞外基质的胶原纤维尺度,有利于细胞相互作用,其纳米级孔隙也支撑了定向流体传输。进一步分析表明,纤维膜具有0.8-1.2 μm的多孔结构,且亲水层孔径(约0.9 μm)小于疏水层(约1.1 μm),形成关键的垂直梯度孔径,为后续渗出液的定向泵送提供了核心驱动力。光学性能表征显示,含Ce6的膜在400-800 nm范围内吸收显著增强,尤其在660 nm和710 nm附近,表明其具有良好的光热效应潜力;荧光光谱在675 nm处的发射峰及荧光显微镜下的均匀红色荧光均证实Ce6成功负载。
这些结果共同验证了该Janus膜具备理想的仿生梯度结构与光响应性能,为其实现“水二极管”式定向引流与光热/光动力协同治疗奠定了坚实基础。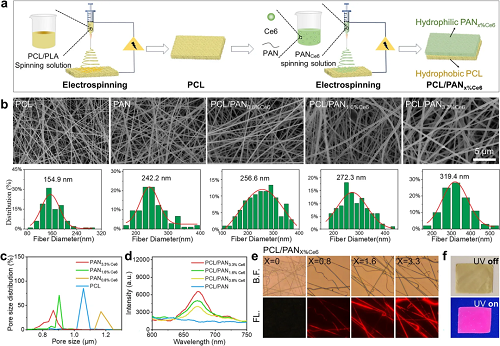
图2. 仿生Janus膜的构建及结构与光学性能表征。
III 定向输水与机制剖析:“水二极管”效应的实现与抗重力引流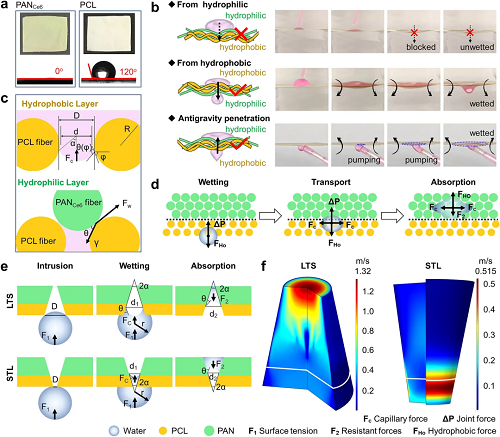
图3. Janus膜的单向输水性能与“水二极管”机制。
本节系统研究了Janus膜的润湿性、单向输水能力及其内在物理机制。水滴测试表明,底层疏水PCL接触角约110°,而上层亲水PANCe6层接触角迅速降至0°,形成显著的润湿性梯度。通过调整膜层取向的实验直接验证了其“水二极管”特性:当亲水层面向上时,疏水层能有效阻挡水渗透;当亲水面朝下时,水可自发从疏水侧向亲水侧传输,并能抗重力向上泵送。为阐明机制,研究分析了润湿力:水接触疏水层时,毛细力表现为阻力;一旦通过界面接触点进入亲水层,润湿力即驱动其铺展。从孔隙结构梯度角度,研究建立了理论模型:在“疏水大孔→亲水小孔”(LTS)结构中,水在疏水大孔处临界侵入压力低,易于进入;随后,上向合力克服下向压力,并由更强的毛细驱动力推动向亲水层迁移,且吸收阻力更小,使Janus膜能如“自泵”般高效抗重力移除液体。COMSOL模拟结果支持该结论:LTS结构中的水传输速度自下而上由慢变快,最大速率达1.32 m·s⁻¹,显著快于反向结构(STL,最大0.52 m·s⁻¹),这归因于LTS中毛细力沿传输方向的逐渐增强。这种独特的“水二极管”效应为开发高效引流的智能伤口敷料(如PCL/PAN1.6%Ce6膜)提供了理想解决方案,并在功能纺织品等领域具有应用前景。
PCL/PANx%Ce6膜继承了Ce6的光响应能力。光热测试表明,在660 nm激光照射下,PCL/PAN1.6%Ce6在干态下温度可达74°C,在湿润条件下可达46°C,并因水分蒸发出现二次升温平台(约58°C),展现出稳定的光热输出与蒸发潜力。该效应能显著增强单向引流:激光照射60分钟后,排水量达0.95 g cm⁻²,较无光条件提升约1.33倍,实现了光热驱动的持续排水。在活性氧生成方面,光照下含Ce6的膜可有效产生单线态氧(¹O₂),其产量与Ce6负载量正相关。研究进一步发现,高温环境(45°C)下¹O₂的生成量可达室温(25°C)的1.8倍,表明光热效应产生的局部升温能够协同增强光动力杀菌效果。综上,该Janus膜兼具高效的光热转换与光动力产生活性氧的能力,且两者可相互协同,为伤口渗出液的管理与高效灭菌提供了关键的功能保障。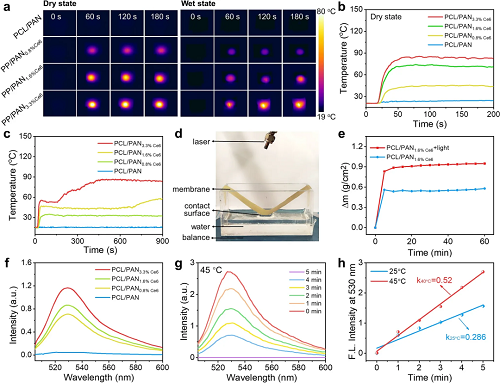
图4. Janus膜的光热-光动力性能及其对引流与灭菌的增强作用。
IV 光热-光动力协同抗菌:热氧化效应与高效杀菌验证
为验证Janus膜的抗菌性能,选用PCL/PAN与PCL/PAN1.6%Ce6作为模型,分别对大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)进行光照处理实验。在无光照条件下,两种膜均未表现出明显抗菌活性,细菌存活率均高于97%,菌落形态完整。然而,在激光照射下,PCL/PAN1.6%Ce6组菌落数量显著减少,菌体表面出现明显皱缩,表明其具备显著的光诱导抗菌能力。进一步对比不同光照模式的杀菌效果发现:单独使用光动力治疗(PDT)或光热治疗(PTT)虽能分别降低细菌存活率,但二者结合时可实现协同增强的“热氧化效应”。在PTT与PDT联合作用下,菌落数量急剧减少,菌体形态严重受损,内容物外泄,对E. coli的杀菌率达99.99%,对S. aureus亦达到99%。Syto 9/PI荧光染色结果进一步印证了该协同杀菌效果。综上,PCL/PAN1.6%Ce6膜通过光热-光动力协同作用,可在局部产生高温并促进活性氧渗透,从而高效杀灭细菌。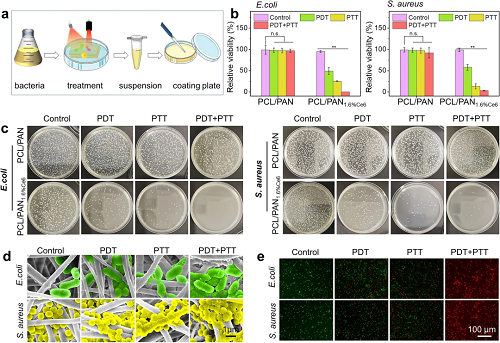
图5. Janus膜的光热-光动力协同抗菌性能。
V 仿生-光疗协同治疗:实现糖尿病创面愈合与免疫调节
为验证仿生Janus膜的体内治疗潜力,研究构建了糖尿病小鼠全层皮肤缺损感染模型,并分为五组进行干预。伤口愈合进程显示PCL/PAN1.6%Ce6联合光照组展现出最优异的促愈合效果:第3天愈合率即达72%,至第17天伤口闭合率高达96.45%,显著优于对照组及其他处理组。小鼠体重稳定,表明该治疗具有良好的生物相容性。组织学分析进一步揭示了愈合质量的差异。H&E染色显示,PCL/PAN1.6%Ce6+Light组的伤口长度最短。Masson染色结果显示,该治疗组诱导了致密且排列有序的波浪状胶原纤维沉积,胶原沉积率高达34%,远高于对照组,表明其能有效促进细胞外基质重建。伤口细菌培养计数证实,联合治疗组的菌落数量显著低于对照组,体现了其强大的体内抗感染能力。研究初步探讨了其免疫调控机制。第7天的免疫荧光染色显示,治疗影响了伤口处巨噬细胞的极化。持续的炎症是阻碍糖尿病伤口愈合的关键。该膜通过高效引流与光疗协同清除感染,可能正向调控巨噬细胞从促炎的M1表型向促修复的M2表型极化,从而抑制过度炎症、促进血管生成与组织再生。综上所述,PCL/PAN1.6%Ce6膜通过“引流-杀菌-免疫调节”的多功能协同,为糖尿病慢性伤口修复提供了一种高效的整合治疗策略。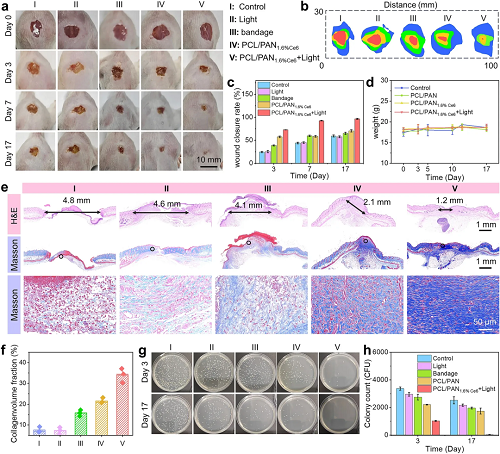
图6. PCL/PAN1.6%Ce6膜联合光照协同治疗糖尿病伤口模型。
为阐明Janus膜促进糖尿病伤口愈合的深层机制,研究进一步从免疫调控与组织再生角度进行了分析。流式细胞术结果显示,PCL/PAN1.6%Ce6联合光照治疗能显著调控巨噬细胞极化:使促炎的M1型巨噬细胞比例降至13.7%,并大幅降低M1/M2比值(从11.5降至0.7),有效推动了免疫微环境向促修复方向转变。这种免疫重塑伴随著炎症反应的显著减弱。免疫组化显示,治疗有效降低了中性粒细胞标志物MPO及基质金属蛋白酶MMP-9的表达;同时,关键促炎因子IL-6与TNF-α的水平也被显著抑制。这表明通过高效引流与光疗协同清除感染,能从根本上缓解糖尿病伤口的持续炎症。在组织再生层面,治疗展现了强大的促进修复能力。第17天的免疫荧光染色表明,治疗组伤口具有更多成熟血管(CD31⁺/α-SMA+),血管长度与管径更大,同时毛囊再生标志物CK19的表达也更强,证实了其能有效促进血管新生与皮肤附属器重建。综上所述,该仿生Janus膜通过“物理引流-光疗杀菌”协同作用,成功调控了伤口免疫微环境,并系统性加速了组织再生与功能恢复。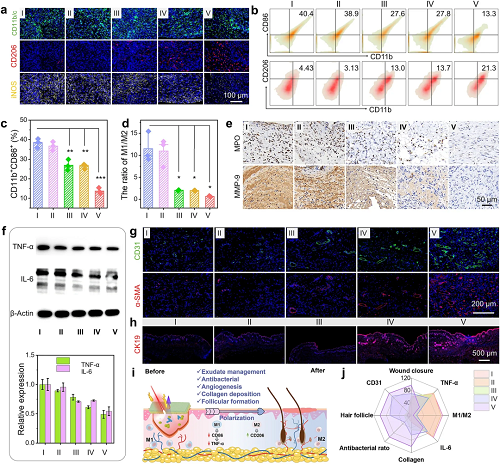
图6. 仿生-光疗协同调控免疫微环境与促进组织再生。
III 总结
本研究受仙人掌刺启发,成功开发出一种仿生Janus纳米纤维膜,为糖尿病慢性伤口提供了“引流-杀菌-修复”一体化解决方案。该膜通过将小孔径亲水性PANCe6层沉积于大孔径疏水性PCL层之上,构建了垂直方向的润湿性与孔径梯度,使其能像“智能水泵”一样,持续单向泵送渗出液,抗重力引流速率达0.95 g cm⁻² h⁻¹。
负载的光敏剂Ce6赋予其优异的光响应性能:在光照下可同步产生光热效应(加速蒸发,增强引流)与光动力效应(产生活性氧),对常见伤口病原菌的协同杀菌率超过99%。这种“物理引流”与“光能杀菌”的双重协同,快速优化了伤口微环境。
动物实验表明,该膜能有效调控巨噬细胞从促炎M1型向修复M2型极化,抑制炎症,并促进胶原沉积、血管新生及毛囊再生。在糖尿病小鼠模型中,联合光照组在第17天实现96.5%的伤口闭合率,展现出卓越的愈合能力。
该研究通过融合梯度润湿性与梯度孔径,强化了Janus膜的内生引流驱动力,不仅为新一代智能伤口敷料设计提供了新范式,也为临床应对糖尿病足溃疡等难愈伤口带来了具有转化前景的解决方案。
作者简介


(1) 新型无机、高分子、有机/无机杂化等光热转换材料的开发及其在癌症诊疗方面的应用 (2) 高效光热转换织物的制备及其在太阳能利用、海水淡化等领域中的应用 (3) 光致变色新型织物的构筑及其在智能可穿戴设备中的应用 (4) 纳米光催化材料的开发及其在污水净化和有机催化反应中的应用 (5) 新型生物纳米发电机的设计、构筑及应用。
▍个人简介

(1) 新型无机、高分子、有机/无机杂化等光热转换材料的开发及其在癌症诊疗方面的应用 (2) 高效光热转换织物的制备及其在太阳能利用、海水淡化等领域中的应用 (3) 光致变色新型织物的构筑及其在智能可穿戴设备中的应用 (4) 纳米光催化材料的开发及其在污水净化和有机催化反应中的应用 (5) 新型生物纳米发电机的设计、构筑及应用。
▍个人简介
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 东华大学朱美芳、陈志钢和上海大学陈雨:仙人掌仿生Janus膜的光导流愈合之道
 Nano-Micro Letters
Nano-Micro Letters 徐卫林院士&陈凤翔等综述:无机高性能纤维基电磁屏蔽材料—从界面调控到多功能集成
徐卫林院士&陈凤翔等综述:无机高性能纤维基电磁屏蔽材料—从界面调控到多功能集成 中国石油大学(华东)张彦振/张冬至: 受蛋壳天然层状结构启发的全仿生柔性传感器用于多模态人机交互
中国石油大学(华东)张彦振/张冬至: 受蛋壳天然层状结构启发的全仿生柔性传感器用于多模态人机交互 中科院苏州纳米所王锦团队:“轻水材料”新概念,让水成为超轻隔热与无源降温功能材料
中科院苏州纳米所王锦团队:“轻水材料”新概念,让水成为超轻隔热与无源降温功能材料 中科院宁波材料所陈亮/林贻超:超2000小时稳定!钌单原子稳定NiFeOOH实现高盐水电解
中科院宁波材料所陈亮/林贻超:超2000小时稳定!钌单原子稳定NiFeOOH实现高盐水电解