研究背景
纳米医学将纳米技术与医学相结合,使纳米材料在疾病的诊断和治疗中发挥关键作用。与传统药物相比,纳米药物具有更大的比表面积,便于表面功能化。此外,这些药物具有独特的物理化学性质,如低毒性、高生物利用度和改进的药代动力学,通常导致增强的治疗效果。近年来,随着研究技术的进步,纳米医学的研究取得了显著的进展。这一进展使得纳米材料及其应用的多样性大大增加。值得注意的是,纳米材料在炎症疾病诊断和治疗中的应用越来越广泛。
炎症性疾病在医学领域引起了极大的挑战和关注,因为炎症与几乎所有人类疾病有关。适当的炎症反应是一种重要的防御机制,通过免疫调节触发组织修复,以应对病原体入侵或组织损伤。持续性炎症演变为病理反应,导致机体不受控制的损害。此外,组织或器官坏死可引发进一步的炎症,从而形成恶性循环,加重病情。当组织暴露于外源性或内源性刺激时,炎症细胞释放炎症介质和细胞因子。这些介质作用于效应细胞,包括免疫细胞(单核细胞、巨噬细胞和中性粒细胞)和非免疫细胞(内皮细胞和平滑肌细胞)。这可能导致细胞表型极化或相关蛋白的过度表达,触发一系列可能导致组织和器官损伤的生物过程。此外,如果炎症反应没有得到适当的控制,就会引起慢性炎症和难治性炎症性疾病,从而对机体造成长期损害并增加治疗费用。这导致了各种抗炎和抗氧化纳米材料的发展。例如,纳米酶利用其催化性质产生或消除ROS,而某些金属纳米颗粒(NPs)表现出类似的性质,可以作为药物载体发挥作用,从而提高治疗效果。此外,外泌体可以运输天然药物或基因用于姑息治疗。尽管这些纳米材料在体外试验中显示出了显著的功效,但在复杂的生理环境中复制这些效应仍然具有挑战性。采用有效的靶向策略,如被动和主动靶向,将实现精确治疗并提高纳米药物的疗效。优化纳米材料的设计对于确保其治疗效果至关重要,而采用合适的合成方法对于降低毒性和提高效率至关重要。尽管纳米材料的多样性和广泛使用,以及其在治疗各种疾病方面优于传统疗法,但某些纳米材料的毒性仍然是其临床转化的主要障碍。因此,纳米药物的毒理学研究越来越受到重视,旨在为设计安全有效的纳米材料提供理论基础,重点研究其作用机制和影响因素。
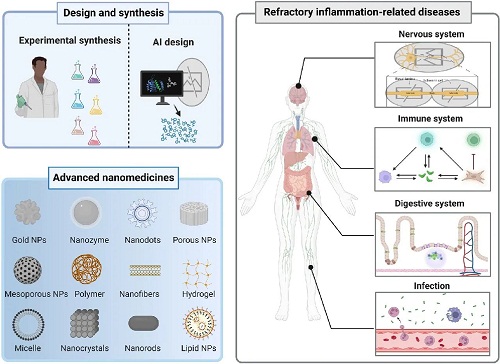
Advanced Nanomedicines for Treating Refractory Inflammation-Related Diseases
Xiuxiu Wang, Xinran Song, Wei Feng, Meiqi Chang, Jishun Yang, Yu Chen
Nano-Micro Letters (2025)17: 323
https://doi.org/10.1007/s40820-025-01829-7
本文亮点
1. 详细介绍了与炎症有关的相关疾病。
2. 概述了用于治疗各种炎症性疾病的纳米材料的分类。
3. 综述了纳米医学在炎症性疾病治疗中具有良好疗效的应用现状。
4. 对纳米医学在治疗炎症性疾病领域的发展提出了挑战和展望。
内容简介
上海大学陈雨等人综述了炎症作为一种生理防御机制对感染性因素、物理创伤、活性氧(ROS)和代谢应激的影响,这些因素在失调的条件下可能发展为慢性疾病。纳米医学将纳米技术与医学相结合,抑制炎症信号通路和过度表达的促炎细胞因子,如ROS,以解决炎症相关的病理学问题。系统分析了纳米材料设计和合成策略的最新进展,重点介绍了先进的“智能”方法的应用。然后,简要概述了纳米材料的毒性,包括机制、影响因素和评估方法,这些将作为促进纳米药物临床转化的毒理学研究的基础。此外,强调了多种功能纳米材料在治疗难治性炎症相关疾病中的应用,包括伤口愈合、消化系统疾病、免疫状况、神经系统疾病和循环系统疾病。还探讨了通过纳米医学实现这些疾病的靶向治疗的各种策略。最后,讨论了目前纳米药物应用于治疗炎症相关疾病的障碍,为开发新型纳米药物以提高疾病治疗效果做出了贡献。
图文导读
I 纳米材料的设计与合成
纳米材料的设计和合成是其物理化学性质和生物效应的基础。随着研究的不断深入,智能纳米材料的发展趋势越来越明显,如刺激响应型和仿生型纳米材料,这将提高纳米医学的精确性和效率,实现更具针对性的治疗。此外,随着智能技术的进步,人工智能(AI)等新兴领域正日益融入纳米医学。人工智能的应用,如机器模拟和高通量筛选(HTS),为设计安全有效的纳米材料提供了更精确和有效的方法。在纳米材料的合成中,采用适当的技术可以减少对化学品和极端条件的依赖,从而促进安全、节能和可控的大规模生产纳米材料。此外,诸如生物合成、仿生自组装和仿生矿化等智能方法可精确控制纳米材料的结构、性质和功能,促进其自主和响应性合成。
近年来,“智能”纳米材料被开发用于响应体内的生理刺激,或特异性靶向致病基因或蛋白质并与之相互作用。这使干预更加精确和有效,遏制疾病进展,促进健康恢复。此外,多靶点和分层靶向策略增强了纳米药物克服体内障碍的能力,确保了它们能够运送到预期的靶点进行有效治疗。因此,纳米材料的“智能化”显著提高了其在医药领域的性能。目前智能纳米材料的设计主要分为两类:刺激响应型纳米材料,促进药物在靶点的可控释放;仿生纳米材料,通过仿生策略功能化,以改善纳米药物对病理部位的靶向性(图1)。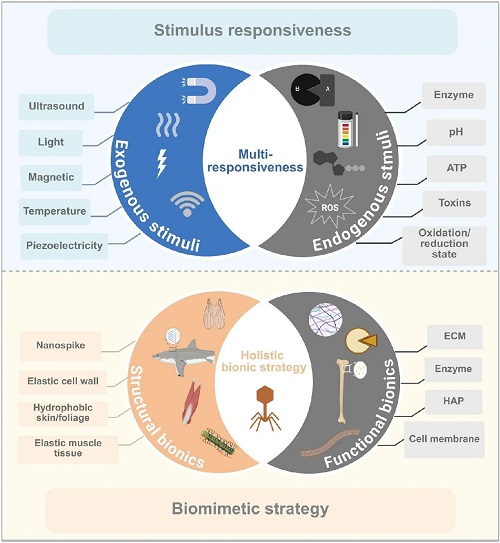
图1. 智能纳米材料设计方案示意图。该设计策略主要分为两类:刺激响应策略和仿生策略。
纳米药物或佐剂配体的种类增加了试错的成本,因为它们通常是根据文献研究或主观猜测来选择的,这与“智能”纳米材料设计的概念相矛盾。为了解决这一问题,具有强大数据处理和分析能力的计算技术越来越多地应用于纳米材料的智能设计。这些技术,如高通量方法或机器学习(ML),可以有效地总结现有的大量研究,阐明纳米材料与生物系统之间的相互作用模式,以及它们与生物分子配体之间的联系。这为合理有效地设计疾病特异性智能纳米药物提供了先进的技术支持,同时也解决了表征纳米材料的物理化学性质和生物效应的挑战。将计算技术增强的纳米材料设计定义为“计算纳米材料”。该方法利用计算技术,从疾病的生物学特性出发,通过材料-生物相互作用、材料-性质关系以及合适的配体或佐剂,确定最佳的纳米材料,模拟理想纳米药物的构建,准确分析其理化性质。本文概述了计算纳米材料的一般设计过程。因此,计算纳米材料可以显著降低与传统“验证猜测”方法相关的人力、财力和时间成本,从而推动纳米医学领域的发展。目前,纳米材料设计的计算技术和算法越来越多地应用于固体材料,包括高通量、人工智能和机器学习技术。这些工具可以预测各种纳米材料的物理化学性质及其与生物体的相互作用,能够预测纳米系统分布、生物活性和毒性,并最终促进筛选合适的纳米材料(图2)。然而,无论采用何种技术,设计计算纳米材料都需要从现有研究中收集、处理和分析大量数据。在数据驱动的范例中,HTS增强了数据样本加载和处理效率,同时支持自动数据生成、存储和分析。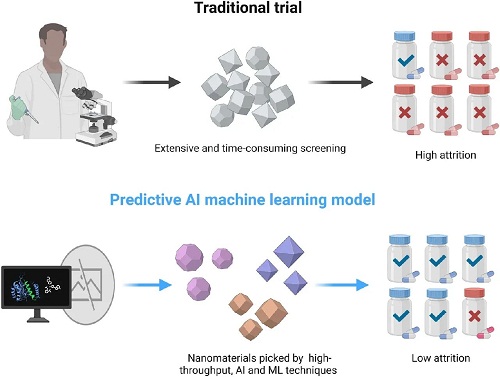
图2. 计算纳米材料的示意图。该方法包括使用高通量、AI和ML技术预测各种纳米材料类型的物理化学性质及其与生物体的相互作用。目的是推断纳米系统在体内的分布、生物活性和毒性,最终指导选择合适的纳米材料。
II 智能合成方法
“智能”纳米材料的合成技术的进步是实现智能纳米医学的关键一步。传统的自下而上和自上而下的合成方法分为化学法和物理法。化学合成中使用化学试剂存在安全问题,限制了其应用,而物理合成方法难以实现对纳米材料的精确控制,因此无法满足“智能”合成的各种要求。近年来,生物合成、仿生自组装、仿生矿化等纳米材料合成新概念已被实验证实并应用于复杂纳米系统的合成。例如,无机纳米材料是利用从植物提取物或微生物(如细菌)中提取的天然成分合成的。此外,可以使用生物分子模板(蛋白质、DNA)启动材料的自组装。这些合成方法消除了对大量化学稳定剂的需要和极端合成条件的使用。这些简单、安全、节能和温和的方法具有大规模生产纳米材料的潜力。此外,基于生物和生物大分子组分的智能合成可以精确调控材料的结构、性质和功能。同时,它还实现了材料的自主反应合成。
纳米材料的生物合成方法包括利用植物提取物、藻类、真菌、细菌和病毒来生产纳米尺寸的功能材料。与传统的化学和物理合成方法不同,生物合成提供了一种绿色合成途径,可有效利用自然生物资源,以生物组分为原料,在生物体内合成或组装具有特定功能的纳米材料(图3)。微生物,包括细菌、真菌、病毒和其他生物实体,具有纳米级成分,可执行多种过程,例如摄取外部目标、能量生产和代谢物合成。在复杂的生存条件下,这些行为作为微生物启动的自我保护机制。微生物从环境中吸收必需营养素后,通过胞吐或生物隔离将过渡金属离子等有毒物质排出体外,将非必需甚至有毒物质转化为无害物质。此外,微生物产生的各种代谢物和生物分子可能具有促进其他物质转化的生物活性。有趣的是,通过战略性地利用微生物的生物功能,这些生物体可以在适当的条件下利用环境物质构建相应的纳米材料,根据其合成位置将其分为胞外和胞内两类。在这一过程中,消除了有毒化学品和人为操纵的合成参数,使得纳米材料的合成既方便又环保。因此,生物合成纳米材料,或绿色合成,越来越多地用于构建可持续的纳米结构。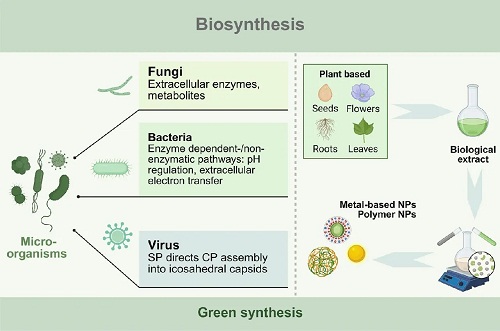
图3. 纳米材料生物合成方法示意图。这一过程涉及利用植物提取物和微生物(包括真菌、细菌和病毒)合成纳米级功能材料。
自组装技术是“自下而上”方法中的一个关键工具,在这种方法中,小的结构单元从有限数量的组件有序组装成协调的纳米材料。在自然界中,许多生物成分是通过自组装逐步形成的,如蛋白质、核酸和多糖——这三种主要的生物大分子分别由氨基酸、核苷酸和单糖等简单组成单元聚合而成。因此,纳米材料的自组装合成遵循仿生方法,模仿生物分子的自主构建行为。这一过程有效地利用结构单元自发形成具有特定结构和功能的稳定聚合系统。分别从三个方面介绍自组装的基本原理:组件、模板和组装驱动程序(图4)。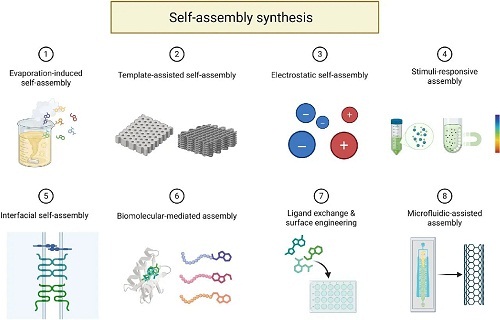
图4. 纳米材料自组装合成示意图。该过程模拟生物分子的自主组装行为,形成具有特定结构和功能的稳定聚集体系。利用装配组件和生物模板,由内生或外生力驱动装配。
III 毒性
纳米材料在食品安全和生物医学领域受到广泛关注。然而,随着研究的进展,对其潜在的不利影响的关注已经出现,为研究人员提出了新的挑战。当纳米材料与生物体相互作用时,它们可以触发一系列已被证实或尚未被理解的毒性机制。这些机制可能导致不同程度的毒副作用(器官、细胞和亚细胞),包括心脏毒性、肝肾毒性、胃肠毒性、发育和生殖毒性以及肺纤维化。表现出有毒副作用的材料范围很广,包括金属基NPs、碳基纳米材料和硅基纳米材料等。这突出了纳米材料毒性在纳米医学应用中的潜在局限性。然而,纳米材料的毒性并不是一个不可克服的挑战。直接和间接因素均可导致或加剧毒性,但通过控制关键变量,这些不利影响通常可以减轻。因此,准确评估和理解纳米材料的毒性和潜在机制对于指导设计和合成新型、安全、有效的纳米材料至关重要。该部分综述了纳米材料的毒性机理、影响因素及其评价方法(图5)。
在此背景下,纳米毒理学的新兴领域研究了纳米材料和纳米复合材料对生命系统的毒理学影响,为更安全的纳米材料的合理设计提供了有价值的见解和技术指导。纳米毒理学不仅研究影响人类健康的毒性机制,而且还研究对其他生物物种的毒理学效应。这种广谱的物种增强了毒理学效应的建模,从而提高了毒性评估系统的准确性和鲁棒性。因此,它有助于减少纳米材料的不利影响,拓宽其潜在的应用领域。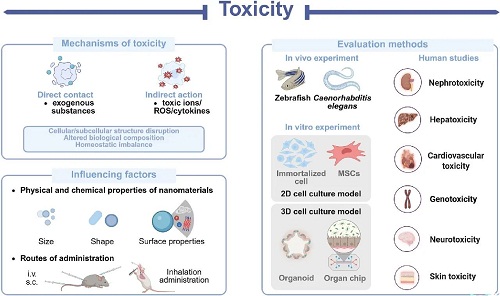
图5. 纳米材料毒性问题示意图。该图说明了毒性的内在机制,包括直接和间接因素,以及用于准确评估的方法。
IV 应用
创新的纳米材料通过调节ROS、实现靶向递送和提供多功能性来应对广泛的医学挑战。这些材料用于治疗感染、伤口愈合以及与神经退行性变、心血管健康、免疫和肝肾系统相关的疾病。在伤口修复中,纳米材料通过清除多余的ROS水平来调节ROS,同时保持适量,动态抑制感染并促进再生。对于神经退行性疾病,具有工程化表面的亚5 nm颗粒改善大脑分布并抑制蛋白质聚集,而集成抗氧化剂通过中和线粒体ROS破坏氧化应激循环。心血管治疗利用ROS反应性NPs中和oxLDL并减少单核细胞浸润,同时靶向给药以最小化全身副作用。在免疫紊乱管理中,滑膜靶向药物滞留抑制NF-κB,而光控平台使ROS的时空调节成为可能。在炎症性肠病(IBD)中,pH/酶反应载体将药物输送定位到肠道病变,而整合的NPs清除ROS,抑制NF-κB,并减少结肠炎复发。肝肾损伤疗法利用抗氧化剂-抗炎协同作用来修复损伤和防止纤维化,并结合大小依赖性肾脏排泄以避免累积。本文综述了软、硬纳米材料的分类及其在难治性炎症疾病中的应用,提出了新的治疗模式。
4.1 硬质纳米材料
硬质纳米材料(例如金属纳米颗粒、碳基材料、MSN)由于其机械强度、稳定性和表面性质而在生物医学应用中表现优异。它们在电磁响应、载药量和抗剪切性方面优于软材料,有效应对心血管疾病和血脑屏障(BBB)的挑战。尽管存在生物降解性方面的挑战,但表面功能化和复合材料有助于提供高硬度、精确的药物解决方案。
金属基纳米材料,包括金属和金属氧化物纳米颗粒,在各种医学应用中显示出独特的生物活性和工程潜力。在抗感染治疗中,金属氧化物NPs(例如二氧化铈)通过Ce3⁺/Ce⁴⁺氧化还原循环破坏细菌膜,同时与抗生素或AMP协同组合,例如ZnO@PEP-MPA纳米探针,提高杀菌效率。在伤口愈合方面,印楝叶提取物合成的Ag-ZnO纳米颗粒和用相思胶制备的ZnO纳米颗粒涂层缝合线显示出优异的伤口修复能力。对于神经系统疾病,Au NPs通过抑制β-淀粉样蛋白和增强BBB穿透表现出治疗潜力,植物合成的变体进一步减少神经炎症。磁离子促进靶向药物递送,如MSC引导的磁导航系统所示,其改善阿尔茨海默病(AD)治疗(图6a)。在免疫疾病干预中,铁-槲皮素配位NPs(Fe-Qur NCNs)通过抑制NF-κB途径减轻RA,而光控制纳米系统,如叶酸受体靶向Au-DEN-MTX@IR780,增强近红外辐射下ROS的生成,以提高治疗效果。
碳基纳米材料,包括石墨烯衍生物、碳纳米管和碳量子点,通过光动力、光热和光催化机制产生ROS,表现出强大的抗菌活性。这些材料破坏细菌膜并诱导氧化损伤,石墨烯涂层特别抑制变形链球菌等病原体,同时促进组织再生。协同策略增强功效:杂化复合物,如CeO₂ GO,通过氧化还原循环和电荷分离促进ROS的产生,而AMP功能化石墨烯纳米点实现膜破坏,降低细胞毒性(图6b,c)。将磁性成分(如Fe₃O₄)与生物活性剂(如nisin或Ag NPs)集成在一起的多功能纳米杂化物进一步实现了靶向和持续的抗菌作用。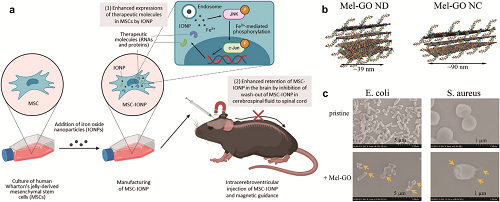
图6. (a)MSC-IONP的制备及其在AD治疗中的应用。(b)具有不同尺寸和数量纳米片层的Mel GO ND或NC复合物。(c)用Mel GONDS处理前后的大肠杆菌和金黄色葡萄球菌的扫描电镜图像。箭头表示细菌细胞膜损伤和塌陷。
在伤口愈合中,GO基水凝胶和纳米复合物通过调节氧化应激和细菌粘附来促进愈合。例如,NO释放GO NPs通过静电相互作用靶向多药耐药细菌,同时保持生物相容性(图7a,b)。
纳米酶通过金属或碳基纳米材料模拟天然酶(如OXD、POD)的催化活性。表面工程通过结合纳米材料的稳定性和酶的效率,增强了它们的类酶性质,尽管其成分与传统的类似物相似。这些低成本,多功能催化剂提供了优越的活性,尺寸控制,易于合成,与金属为基础的系统领先的医疗应用。例如,在抗菌治疗中,具有POD样活性的纳米酶可催化低浓度H₂O₂(<1 mM)转化为剧毒•OH以根除细菌。类OXD纳米酶可以催化O₂生成H₂O₂和高活性O₂•-/1O₂,表现出很强的抗菌性能。这个Pt@V2C由He等人开发的复合物具有双酶活性(POD和OXD),使NIR-II光热/化学动力学协同疗法能够对抗耐甲氧西林金黄色葡萄球菌(MRSA)感染,同时调节免疫微环境(图7c)。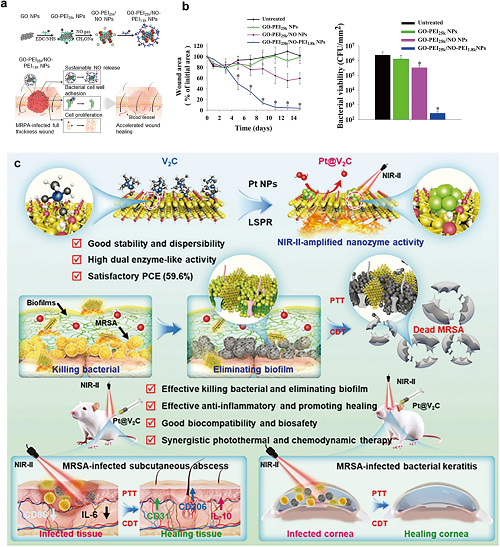
图7. (a)GO-PEI25k/NO-PEI1.8 k NPs的制备工艺和作用机理示意图。(b)GO-PEI25k NPs、GO-PEI25k/NO NPs和GO-PEI25k/NO-PEI1.8 k NPs对MRPA感染小鼠创面的愈合作用及抗菌活性。(c)利用光热和化学动力学疗法的Pt@V2C纳米平台的结构、抗菌特性和抗感染治疗的示意图。
金属基纳米酶的优势来源于金属活性中心(如Fe3⁺、Mn2⁺、Cu2⁺)在仿生催化中的独特优势,包括氧化还原电位可调、电子迁移率高以及模拟酶活性位点的精确工程。本文根据这些活性中心对金属基纳米酶进行了分类,并探讨了其在医学上的应用。具有过氧化氢酶(CAT)和SOD模拟活性的锰基纳米酶在神经退行性疾病中用作自由基清除剂,通过将•OH、O₂•−和H₂O₂转化为无毒H₂O和O₂来减少氧化损伤和神经炎症。Adhikari等人开发了柠檬酸功能化Mn₃O₄纳米酶(C-Mn₃O₄ NPs),用于ROS和保护线粒体免受氧化损伤,为治疗亨廷顿病提供了新策略。对于IBD的治疗,在同等剂量下,纳米酶的疗效优于一线药物,如氨基水杨酸盐。口服酵母制剂YMD@MPDA纳米复合物通过β-葡聚糖将MnO₂纳米酶/H₂S前体药物输送至炎症结肠。它通过清除ROS、促进M2极化、重塑微生物群、恢复屏障和抑制NOX4/p38 MAPK通路来缓解IBD,从而协同抗氧化剂和气体疗法(图8a,b)。
铈基纳米酶是一种典型的金属基催化材料,通过铈离子(Ce3⁺/Ce⁴⁺)的价态转变,表现出类酶活性。在神经系统疾病中,具有FUS增强BBB穿透能力和ROS清除能力的Q@CeBG纳米反应器(负载CeO₂/槲皮素,GSH修饰BSA)可缓解神经元应激并促进抗炎M2小胶质细胞极化,为帕金森病(PD)提供多靶点治疗策略(图8c,d)。由于与关节炎相关的高水平ROS,纳米酶有望成为高效的抗关节炎治疗药物。Cu/Pt掺杂的CeO₂纳米酶(PtCuOX/CeO₂-X)通过氧空位提高SOD/CAT活性,光热效率达到55.41%。这些纳米酶清除ROS/活性氮物种(RNS),保护线粒体,抑制ROS/Rac-1/NF-κB介导的炎症,证明在体内安全缓解骨关节炎(OA)(图9a,b)。为了提高纳米药物的治疗效率,靶向策略已被战略性地纳入到经典纳米酶的设计中。在心血管疾病中,巨噬细胞膜包裹的纳米酶(MM@Ce-CDsNPs)使活性氧响应性靶向治疗和调节AS斑块微环境,通过仿生传递减少炎症/活性氧并抑制泡沫细胞形成(图9c,d)。此外,RBCM@CeO₂/TAK-242 NPs(RBC膜工程,TAK-242负载)靶向受损肾脏,通过抗氧化和抗炎作用以及TLR4/NF-κB介导的巨噬细胞重编程抑制CaOx晶体和肾损伤。这种双重功效和生物安全性在乙醛酸诱导的小鼠中得到验证(图10a)。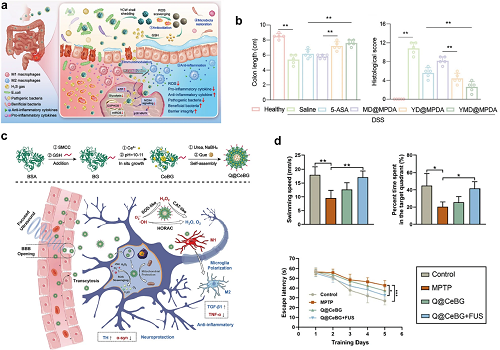
图8. (a)YMD@MPDA口服给药用于IBD的靶向治疗,包括ROS清除、抗炎和免疫调节作用的示意图。(b)YMD@MPDAIBD的体内药效:基于组织形态学显微镜分析的结肠长度量化和组织学评分。(c)Q@CeBG纳米反应器的制备过程及其在PD中的治疗机制的示意图,侧重于神经保护和脑微环境的调节。(d) Q@CeBG联合FUS治疗PD小鼠的行为学评价。代表性数据包括游泳速度、在目标象限花费的时间百分比和Morris水迷宫试验的逃避潜伏期。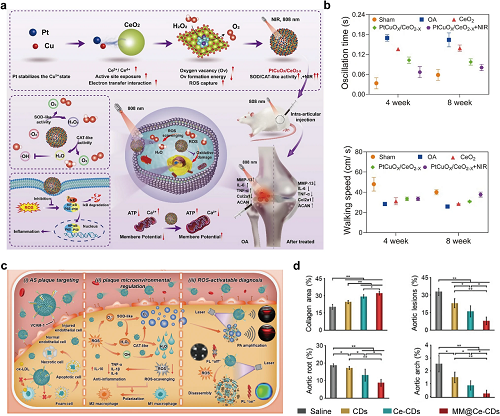
图9. (a)PtCuOX/CeO₂-X纳米酶治疗OA的示意图。(b)PtCuOX/CeO₂-X纳米酶治疗OA:治疗4周和8周后通过步态分析测量左后肢摆动时间和步行速度。HPBZs治疗缺血/再灌注损伤示意图。(c)MM@Ce-CDsNPs合成的示意图及其在AS靶向ROS激活治疗和斑块微环境调控中的作用。(d)MM@Ce-CDsNPs治疗AS的体内增效作用:主动脉相对病变面积、主动脉根部、主动脉弓冰冻切片相对斑块面积和斑块胶原面积的定量分析。
以典型的PB纳米酶为例,铁基纳米酶通过铁离子(Fe2+/Fe3⁺)的氧化还原循环表现出催化活性。这些材料表现出多功能的酶模拟行为,包括POD、CAT和SOD样活性。在神经系统疾病的治疗中,空心结构的PB纳米酶(HPBZs)显示出增强的ROS/RNS清除能力,在体内外抑制细胞凋亡和炎症,并在最小副作用的情况下改善缺血脑耐受性(图10b,c)。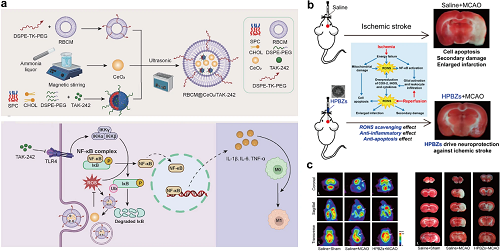
图10. (a)RBCM@CeO₂/TAK-242的设计、制备和治疗机制。(b)HPBZs治疗缺血/再灌注损伤示意图。(c)RBCM@CeO₂/TAK-242治疗脑缺血/再灌注损伤的体内药效:具有代表性的18F-FDG PET图像和TTC染色冠状脑片照片。
MOF纳米酶由有机连接物和金属簇组成,通过金属节点、配体或它们的协同作用模拟酶的催化作用,增强底物的吸附和传质。本质上,MOFs可以催化POD底物产生有毒•OH,有效杀灭细菌。例如,双金属Q-MOFCe0.5利用氧空位、多价氧化还原循环和光活性带结构在可见光下连续产生ROS,有效地消除表面粘附的细菌(图11a,b)。在RA治疗中,锰工程二氧化硅纳米载体(MHPH)酸反应性释放卟啉和锰,形成SOD-/CAT模拟锰卟啉。这促进M1巨噬细胞极化为M2巨噬细胞,并通过硅低聚物增强生物矿化,如关节炎模型所示(图11c,d)。2D MOF纳米片(ZMTP)通过锰卟啉配位和锌调节的氧化还原模拟天然抗氧化酶(Mn-SOD/CAT),在纳米催化治疗的细胞和体内模型中显示双酶活性、抗炎和促生物矿化作用以及抗关节炎功效(图11e)。然而,尽管MOF纳米酶在结构可设计性和多功能集成性方面优于传统的纳米酶,但它们仍然面临着生产稳定性和可扩展性方面的挑战。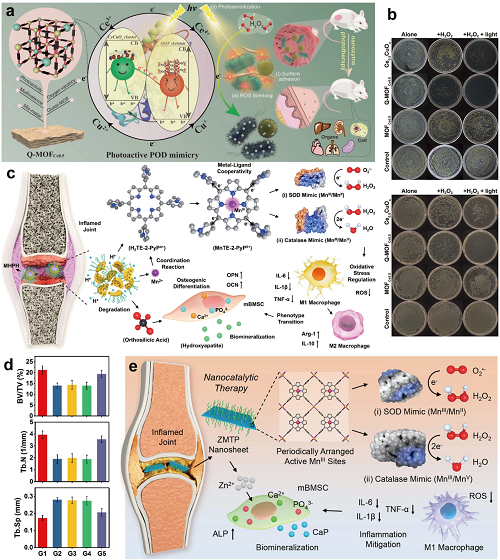
图11. (a)二维双金属准MOFCe0.5纳米酶的催化消毒机理。(b)平板计数结果显示不同纳米酶制剂对大肠杆菌O157:H7和金黄色葡萄球菌的抗菌作用。(c)MHPH纳米药物用于催化抗炎治疗的治疗概念示意图。(d)MHPH的体内抗关节炎作用:骨微结构基本参数(BV/TV、Tb.N和Tb.Sp)的显微CT组织形态计量学分析。(e)ZMTP纳米片对RA的纳米催化治疗机制。
值得注意的是,表现出多酶拟态(SOD/CAT/POD/GPx)的MXenes利用其带负电的表面吸引金属离子,从而促进神经疾病中氧化应激和金属离子累积的治疗靶向性。2D V2C MXenes通过减轻氧化应激清除ROS并减少细胞凋亡和炎症,从而预防缺血性卒中(图12a,b)。纳米材料通过智能设计促进精确治疗炎症性疾病。针对需要精确的神经和心血管疾病,有针对性的策略可以绕过BBB,将药物集中在病变处,提高疗效,同时降低毒性,这对于减缓神经系统疾病和减少副作用至关重要。富含硅醇的MSN可实现定制功能化,提高载药量、血脑屏障渗透和生物医学应用的控释。Ye等人开发了一种巨噬细胞膜修饰的SiO₂/MnO₂纳米马达(MM@MnO₂-Au-mSiO₂@Cur)能够驱动H₂O₂推进,促进BBB穿透和靶向炎症。MnO₂催化H₂O₂转化为O₂,O₂与负载姜黄素的SiO₂协同工作,促进M1巨噬细胞向M2巨噬细胞极化,从而在神经治疗应用中实现神经保护和抗炎作用(图12c,d)。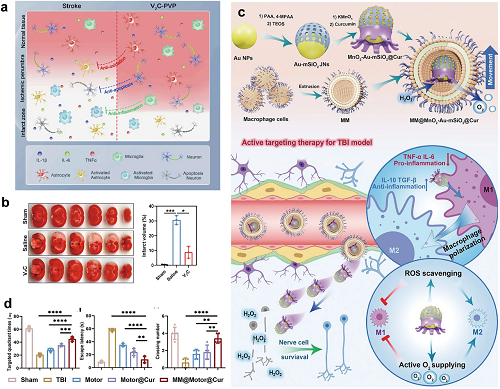
图12. (a)2D V2C MXene基纳米酶的示意图,具有内在的多种酶样活性,作为缺血性卒中治疗、减轻氧化应激、抑制细胞凋亡和对抗炎症的治疗纳米平台。(b)V2C-MXene治疗缺血性脑卒中的体内疗效:TTC染色冠状位脑片的代表性图像和梗死体积的定量计算。(c)MM@MnO₂-Au-mSiO₂@Cur和级联靶向抗炎治疗TBI的制造工艺示意图。(d)MM@MnO₂-Au-mSiO₂@Cur治疗Morris水迷宫TBI,包括目标象限停留时间、逃避潜伏期和平台穿越次数的体内药效。
AS的靶向治疗针对病变部位,从而减少全身副作用,提高疗效,延缓斑块进展,降低心血管风险。炎性内皮细胞和巨噬细胞过度表达VCAM-1/IL-1R,通过VCAM-1结合的NPs实现双重靶向,恢复TIMP3和IL-1R拮抗剂系统,通过雷帕霉素促进M2极化,从而实现协同稳定斑块和免疫调节。此外,清道夫受体(SR-A/CD36)介导低密度脂蛋白(LDL)的摄取和泡沫细胞的形成。Bai等人开发了负载miR-146a的SR-A靶向核酸NPs,通过清道夫受体结合实现斑块特异性递送。这种方法抑制NF-κB驱动的炎症,导致AS斑块的稳定(图13a,b)。针对AS中的低氧,低氧靶向FMMON@PL由PFCE/IONPs组成的NPs可传递氧,降低HIF-1α表达和氧化应激,抑制斑块巨噬细胞中泡沫细胞/M1极化。这种方法减轻缺氧并抑制AS进展(图13c)。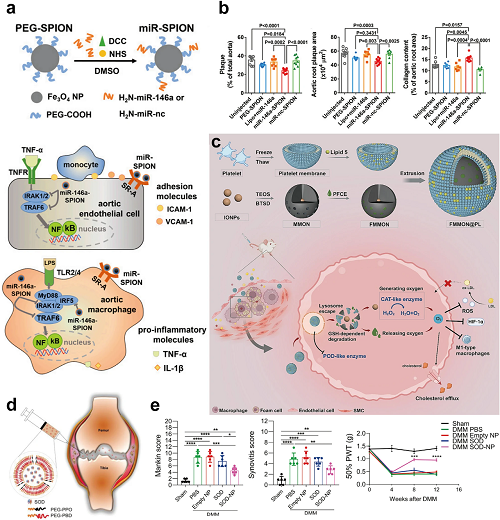
图13. (a)miR-146a-SPION的制备过程和机制的示意图。(b) miR-146a-SPIONs治疗AS的体内疗效:总主动脉斑块面积分数、主动脉根部斑块面积和胶原含量。(c)FMMON@PL的合成示意图及其在AS治疗中的应用。(d)关节内注射用高膜透性SOD多聚体示意图。(e)SOD-NP治疗OA的疗效评价:Mankin评分、滑膜炎评分和von-Frey试验测定膝关节OA严重程度。
4.2 软纳米材料
软纳米材料,包括聚合物纳米粒子、纳米纤维素基材料、纳米胶束、脂质体和外泌体,具有良好的生物相容性和可调的力学性能。与刚性材料相比,软性纳米材料具有良好的仿生结构相容性,降低了机械侵袭性,为药物传递和组织工程提供了高效、低毒、智能的解决方案。
通过聚合或自组装合成的聚合物纳米材料(例如NPs/纳米胶束)通过调节分子量和修饰提供稳定和可控的药物递送。这些材料广泛用于医学,包括合成聚合物(例如PLGA、PEG)和天然聚合物(例如CS),用作多功能载体。在免疫疾病干预方面,Gui等人设计了靶向滑膜的PEG-PPO掺杂的SOD NPs。这些纳米颗粒的渗透膜保护SOD,同时使ROS清除,抑制分解酶,减轻骨关节炎(OA)(图13d,e)。此外,聚合物纳米颗粒的生物相容性和控释性能增强了肾脏疾病的治疗。ROS反应性聚合物NPs(PPS-CPNs/CLT)将雷公藤红素传递至肾小球,穿透内皮屏障,使足细胞释放ROS触发的药物。这减轻了膜性肾病的病理,如免疫沉积和足突丧失,同时降低了毒性(图14a,b)。
聚合物NPs作为药物载体,而天然聚合物(例如CS、菊粉、SF)提供内在的抗炎和抗氧化作用。这些天然聚合物调节肠道微生物群,修复粘膜屏障,并直接清除ROS,破坏细菌DNA,减轻炎症。它们作为载体和生物活性剂的双重作用促进了IBD治疗、伤口愈合和抗菌应用,突出了纳米医学的多功能性。MCC/CS NPs(单羧基corrole/CS)自组装显示双重抗菌作用,结合静电捕获和NIR光热效应,从而加速糖尿病伤口愈合。提高药物生物利用度需要功能化纳米材料靶向给药。在主动靶向策略的背景下,Ai等人构建了粒径小于30 nm的超小脂质NPs(LNPs)(ctLP NPs)以穿透软骨,其中胶原结合肽进一步促进MK-8722在调节软骨细胞能量代谢和缓解OA中的有效作用(图14c,d)。在被动靶向方面,肾脏靶向的中尺度NPs通过增强通透性和滞留(EPR)效应传递ROS清除剂依达拉奉,减少肾细胞损伤和死亡,改善肾功能,预防化疗引起的肾损伤。
纳米胶束类似于脂质体,由两亲性分子自组装成正常或反向结构,包封疏水或亲水性药物。它们增强了药物的包封性,减少了与机体的相互作用,提高了生物利用度,并将不良反应降至最低。Vyawahare等人将9-氨基吖啶和咖啡酸与mPEG-PCL纳米胶束(9AA NMs)结合,通过抑制NF-κB和HIF-1α,减轻炎症级联反应,并最终防止软骨侵蚀、肿胀和关节损伤,有效治疗RA。在此基础上,通过引入靶向策略,将进一步推进胶束在医学中的应用。DEX/HA-TK-ART胶束将青蒿琥酯和DEX共同输送到关节,协同抑制HIF-1α/NF-κB和清除ROS。HA靶向性和ROS响应性TK链接器有助于最小化非靶向效应(图14e)。
基于脂质的纳米材料,包括合成类型,如脂质体和固体脂质NPs(SLN),以及天然外泌体,具有磷脂双层,具有水性核心,用于封装抗生素和抗炎剂。然而,脂质体容易受到氧化和水解引起的稳定性问题的影响,限制了其有效性。表面修饰可以提高稳定性和靶向性,从而增强药物对特定位点的传递。例如,壳聚糖包裹的胞磷胆碱脂质体(CT CS LPs)通过在大鼠体内的缓释、改善稳定性、增强细胞摄取和抗菌作用促进糖尿病伤口愈合。SLN是另一种基于脂质的纳米系统,可保护药物不被降解,增强溶解度和生物利用度,实现靶向递送,并控制药物释放,使其在各种疾病的诊断和治疗中具有价值。关于靶向设计,该策略与前面讨论的方法一致,采用刺激响应性分子修饰进行靶向功能化。脂肪酶敏感的VCM作为SLN靶向细菌脂肪酶,将MRSA生物膜减少5倍,并在12 h内根除细菌。与传统方法不同,隐形聚合物(如PEG)形成脂质体,可逃避巨噬细胞的吞噬清除,形成长循环系统。这些脂质体通过EPR效应实现被动靶向,在病理部位实现特异性聚集。聚乙二醇化脂质体(hFGF21@BCM-LIP)通过VCAM-1/α4β1靶向活化的小胶质细胞,改善生物活性分子的稳定性并促进淋巴积聚,以缓解Aβ诱导的认知缺陷、tau病理学和神经炎症(图15a、b)。
外泌体是具有磷脂/胆固醇双层结构的天然脂质纳米囊泡,在细胞来源和生物活性物质(蛋白质、RNA)方面与合成载体(如脂质体)不同。其生物相容性结构通过膜融合或内吞实现细胞间通讯,调节生物过程。生物衍生的外泌体积极调节病理,例如,M2b巨噬细胞衍生的外泌体通过CCL1-CCR8结合和免疫激活减轻结肠炎。来源于各种间充质干细胞的外泌体,包括人脐带来源的间充质干细胞和骨髓来源的间充质干细胞,对IBD具有保护作用。植物来源的外泌体,如柠檬来源的外泌体,通过重新编程巨噬细胞和促进细胞增殖促进糖尿病伤口愈合。封装在GelMA/DAS水凝胶贴片(GelMA/DAS/Exo)中,可实现缓释和改善渗透性,为慢性伤口修复提供临床解决方案(图15c)。此外,外泌体可以与活性分子(如miRNA)协同作用,通过将各种分子封装在封闭的磷脂双层膜内来保护遗传信息。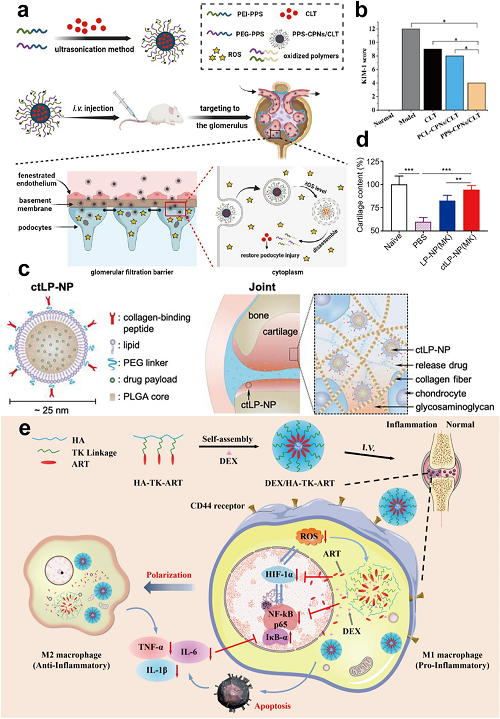
图14. (a)ROS响应性PPS-CPNs/CLT的制备及其肾小球靶向递送的示意图。(b) PPS-CPNs/CLT治疗膜性肾病的体内疗效:基于免疫组化结果的KIM-1水平半定量评分。(c)含有PLGA核和PEG结合脂质壳的ctLP NPs的方案设计。(d) MK-8722负载的ctLP NPs修复胶原酶诱导的OA小鼠软骨损伤的疗效:藏红O染色切片中软骨含量的定量(红色)。(e)ROS反应性HTA前药胶束协同释放DEX,抑制HIF-1α/NF-κB级联调节RA治疗中ROS清除和巨噬细胞复极的示意图。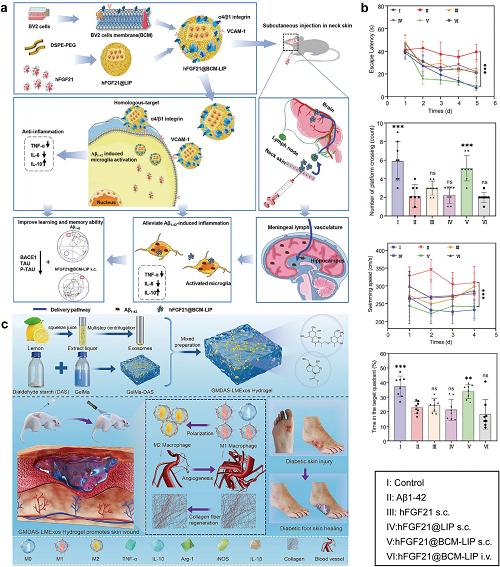
图15. (a)仿生hFGF21@BCM-LIP通过淋巴系统靶向调节脑组织炎症治疗AD的示意图。(b)hFGF21@BCM-LIP在Morris水迷宫治疗AD的体内药效,包括逃避潜伏期、穿越平台次数、游泳速度和在目标象限的时间。(c)GelMA/DAS/Exo水凝胶制备及机理示意图。
V 总结
本文综述了纳米颗粒、纳米酶、脂质体、纳米纤维、外泌体和胶束等纳米材料在治疗炎症相关疾病中的应用,如感染、创伤愈合、肝肾损伤、心脑血管疾病、神经系统疾病、肠道炎症和风湿性疾病。与传统的小分子药物相比,这些纳米材料具有更好的载药能力和溶解度。具体而言,可通过清除ROS减轻炎症相关氧化应激。此外,本综述还探讨了涉及纳米材料的各种靶向策略,如使用配体、活性氧响应材料或仿生生物膜来修饰它们。这种修饰可以显著提高药物的生物利用度,并通过主动靶向提高纳米药物的治疗效果。讨论的各种应用为开发新型纳米药物提供了宝贵的见解,并为探索预防和治疗疾病的创新解决方案提供了新的机会。虽然纳米医学显示出巨大的前景,但必须承认,仍然需要取得实质性进展,临床转化的步伐仍然缓慢。为加快纳米医学在临床环境中的实施,应解决以下方面:
(1) 纳米药物的制备方法是纳米药物临床转化成功的关键。简化制备和合成过程可以节省时间,降低研究阶段的成本,最终提高研究效率。虽然生物合成和自组装技术可以实现纳米材料的半智能合成,但这些方法仍面临稳定性差、生产成本高以及难以控制合成过程等问题,阻碍了大规模生产。因此,开发高效、环境可持续的合成方法,降低生产成本,提高批量生产效率,并将毒副作用降至最低,将是推进纳米材料临床应用的关键。
(2) 纳米材料的改性是提高其性能,使其更适应人体复杂生理环境的关键。这些修饰确保了生物体内复杂相互作用中的稳定性,并使纳米药物能够复制体内动物研究中所见的显著治疗效果。通过在原有材料的基础上进行改进,纳米材料改性促进了具有独特性质的多样化、创新性纳米药物的产生,从而无需开发全新的原材料。这一战略不仅加快了研究,而且大大降低了成本。
(3) 扩大纳米材料类型和应用的种类和范围对其成功融入医学领域至关重要。纳米药物的作用机制决定了其疗效的大小。例如,纳米酶通过模拟酶活性促进ROS的产生或消除,但目前的选择仅限于氧化还原酶,而其他酶类型,如异构酶和裂解酶,在很大程度上未被探索。酶在催化机制、效率和底物特异性上有很大的不同。这种变异使得它们在各种生理条件下都是有效的,从而扩大了纳米医学的潜在应用。因此,不断探索纳米材料的作用机制和医学用途对于提供更广泛的纳米医学选择至关重要。
(4) 靶向策略是纳米材料的“画龙点睛”。将靶向性结合到纳米材料中的目的是增加其在所需部位的积累,提高生物利用度,并最终提高功效。然而,传统的被动和主动瞄准方法面临着一些挑战,包括不确定性、缺乏可重复性和安全问题。例如,生物细胞膜包裹纳米颗粒的制备与化学合成有着显著的不同,而生物膜固有的复杂性使得确保不同批次合成的纳米药物始终含有相同数量的膜蛋白和靶向性质具有挑战性。此外,细胞膜衍生的纳米系统在体内的稳定性给评估带来了挑战,并可能导致潜在的毒副作用。因此,靶向策略应优先考虑最小化毒性和确保稳定的性能,以实现纳米材料的持久有效精确治疗。
(5) 选择合适的给药途径是纳米药物成功转化的关键因素。体外和体内研究的显著差异可归因于实验动物和人类之间的解剖差异。因此,有必要采用不同的给药方法来解决研究过程中的这些差异,以弥补这一差距。在研究阶段,比较不同剂型和途径的疗效对于提高纳米材料在体内的稳定性、生物利用度和患者依从性至关重要。因此,创新的纳米药物给药剂型和给药途径有助于其临床应用。
作者简介

关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 上海大学陈雨等综述:用于难治性炎症相关疾病治疗的新型纳米药物
 Nano-Micro Letters
Nano-Micro Letters 韩国延世大学Yong Min Lee等:规整微孔结构促进SiOₓ/人工石墨复合电极中高效锂离子传输
韩国延世大学Yong Min Lee等:规整微孔结构促进SiOₓ/人工石墨复合电极中高效锂离子传输 拜年了!Nano-Micro Letters祝您马年新春快乐!
拜年了!Nano-Micro Letters祝您马年新春快乐! 南科大曾林/韩美胜等综述:水凝胶电解质赋能锌离子电池的新进展
南科大曾林/韩美胜等综述:水凝胶电解质赋能锌离子电池的新进展 韩国忠南大学Sangbaek Park等:核壳MOF限域锂离子溶剂化构筑高温长效锂金属电池
韩国忠南大学Sangbaek Park等:核壳MOF限域锂离子溶剂化构筑高温长效锂金属电池