研究背景
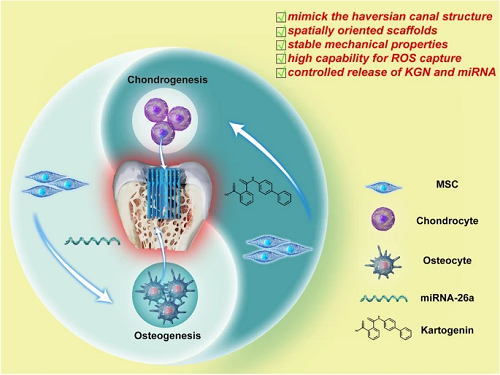
由于创伤、肿瘤、感染等原因造成的骨软骨缺损常常导致患者出现肢体疼痛、活动受限甚至残疾,骨软骨再生已经成为一个紧迫的临床问题。但由于骨和软骨组织的具有完全不同的自然性质,实现二者同时再生具有较大的挑战性。许多研究主要集中于软骨支架的构建,却往往忽略了软骨下骨的再生。但实际上,软骨下骨的构建以及新生软骨与软骨下骨的垂直整合是减轻组织恶化的关键。因此,构建一种多因子且空间定向的支架刺激骨软骨同时再生具有重要意义。我们通过金属离子及其配体的动态响应协调和络合作用将靶向药物,即用于软骨修复的KGN@PDA纳米颗粒和用于骨修复的miR-26a@CaP纳米颗粒原位沉积在2-脲4[lH]-嘧啶酮(UPY)修饰的凝胶(GTU)上,卷成圆柱形模仿天然骨的哈弗氏管结构,所得到的水凝胶具有稳定的力学性能,自愈合能力,较高的活性氧(ROS)捕获能力,以及KGN和RNA的控制释放能力。进一步研究发现KGN@PDA和miR-26a@CaP分别通过JNK/RUNX1和GSK-3β/β catenin通路促进间充质干细胞(MSCs)的成软骨和成骨分化,这种生物材料递送方法对改善骨软骨修复具有重要意义。
In Situ Deposition of Drug and Gene Nanoparticles on a Patterned Supramolecular Hydrogel to Construct a Directionally Osteochondral Plug
Jiawei Kang, Yaping Li, Yating Qin, Zhongming Huang, Yifan Wu, Long Sun, Cong Wang, Wei Wang, Gang Feng* & Yiying Qi*
Nano-Micro Letters (2024)16: 18
https://doi.org/10.1007/s40820-023-01228-w
本文亮点
1. 构建了一种多因子定向支架来刺激骨软骨再生。
2. 首次证明药物和基因纳米颗粒可通过金属配体相互作用在空间上沉积在图案化薄膜上。
3. 首次采用薄膜轧制法构建骨软骨塞,模拟天然骨的哈弗氏管结构。
内容简介
结合不同的因子以实现骨软骨组织同时再生工程支架的发展仍是骨软骨组织工程的一个重大障碍。浙江大学齐义营&王玮课题组首次制造了基于金属离子及其配体的动态响应协调和络合作用原位沉积多治疗因子的图案化超分子仿生水凝胶,通过在时间和空间上对KGN@PDA和miR-26a@CaP的控制释放实现了良好的骨和软骨组织同时修复的效果,深入探究了KGN@PDA和miR-26a@CaP分别通过JNK/RUNX1和GSK-3β/β-catenin通路促进BMSCs软骨和骨分化从而实现骨软骨缺损修复的机制。
图文导读
I 定向GTU-Fe/KGN@PDA/miRNA@CaP水凝胶修复骨软骨缺损的设计示意图
定向水凝胶修复骨软骨缺损的实验设计如图1所示。图A展示了水凝胶塞的制备流程,将KGN@PDA和miRNA@CaP纳米颗粒分别沉积于其不同部位控制多因子的空间分布并制备骨软骨塞;图B展示了体内实验中水凝胶通过局部控释KGN和miR-26a诱导宿主MSCs向软骨/骨方向分化,并展示了该过程潜在的胞内机制。
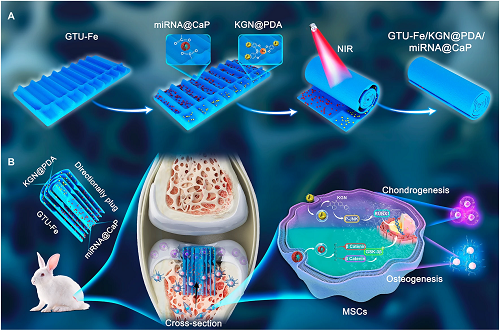
图1. 定向GTU-Fe/KGN@PDA/miRNA@CaP水凝胶修复骨软骨缺损的设计示意图。
II KGN@PDA和miRNA@CaP纳米颗粒的特性
如图2A所示,通过再沉淀法制备KGN核,随后使用PDA壳来包覆KGN。如图2B所示,KGN纳米颗粒的平均尺寸约为95.4nm,而KGN@PDA纳米颗粒的平均尺寸约为288.4nm,表明多个KGN颗粒可能形成单个KGN@PDA颗粒。KGN 的zeta电位为-22.0mV,而KGN@PDA的电位为-63.3mV。HRTEM图像显示KGN@PDA纳米颗粒具有球形形态,直径约为200-300nm。SEM观察可见KGN@PDA表面的不规则片状结构。如图2F所示,KGN@PDA中C、O和N均匀分布。如图2G所示,miRNA@CaP利用磷酸钙共沉淀技术制备。miR-26a的平均流体动力学直径为12.3nm,zeta电位为-42.2mV,而miRNA@CaP的平均流体动力学直径为170.7nm,zeta电位为-1.64mV(图2H,I)。miRNA@CaP纳米颗粒的XRD图谱在大约20=25°处表现出宽带(图2J),表明缺乏长程周期性并排除其他晶相的存在。通过HRTEM结合选区电子衍射(SAED)来表征miRNA@CaP的纳米结构和结晶模式(图2K)。HRTEM和SEM图像显示miRNA@CaP纳米颗粒为不规则球状。如图2M所示,在元素图谱中,来自miR-26a的氮主要分布在miRNA@CaP复合物的中心,而钙和磷则位于外围。

图2. KGN@PDA和miRNA@CaP纳米颗粒的制备和表征。
III GTU-Fe/KGN@PDA/miRNA@CaP水凝胶的特性
如图3所示,通过明胶和UPy-NCO的投料比控制接枝率,选择6.12%的适度接枝率进行进一步研究,所得的GTU-Fe水凝胶可以承受打结和拉伸(图3A),可以模制成各种图案,卷成圆柱形。去除外部压缩力后,可立即恢复到原来的形状(图3C)。使用微型CT扫描观察水凝胶容纳KGN@PDA和miRNA@CaP的凹槽结构。EDS光谱证实水凝胶图案由凹槽结构组成。SEM图像(图3F、G)显示GTU-Fe水凝胶的表面覆盖有大小均匀的纳米颗粒。钙(Ca 2p)和磷(P 2p)的新峰与四个强峰(O 1s、N 1s、C 1s和Fe 2p)一起出现,表明miRNA@CaP成功整合(图3H、I)。铁(Fe)的结合能由于与酚羟基的络合而增加。如图3K所示,GTU-Fe样品中C-OH的结合能为531.10eV,在加载KGN@PDA后增加至531.73eV。
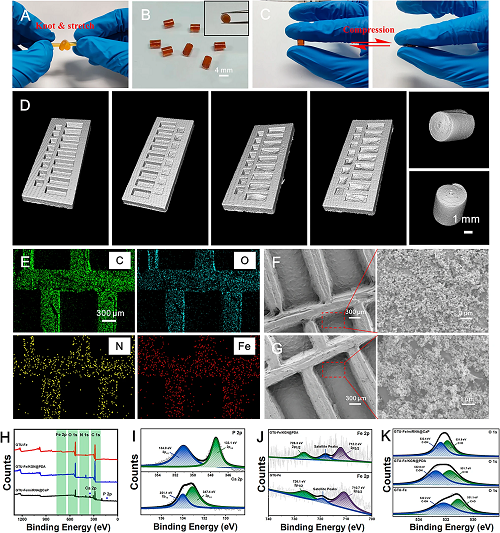
图3. GTU-Fe/KGN@PDA/miRNA@CaP的表征。
IV 体外评估
KGN@PDA显着增强软骨ECM的分泌(图4A)且MSCs中Col II、Sox9和Aggrecan的蛋白表达上调(图4B),同时蛋白p-JNK和p-RUNX1上调,表明软骨形成分化过程中激活了JNK/RUNX1通路(图4B,4C)。随miR-26a(25、50nM)浓度增加,钙结节、COL1A1、ALP和RUNX2表达增加,表明miRNA@CaP诱导MSCs成骨分化(图4D,E)。GSK-3β蛋白下调和p-β catenin上调表明成骨分化过过程中激活了GSK3β/β catenin通路(图4E)。miRNA-Cy5@CaP与MSC共培养1天后,荧光显微镜图像显示细胞质内有高强度荧光信号(图4F)。同时,截面图像观察到miR-26a主要分布于细胞核周围和细胞膜的内侧。表明miR-26a可早期转染至MSC中并均匀分布在细胞质内发挥其药理作用。
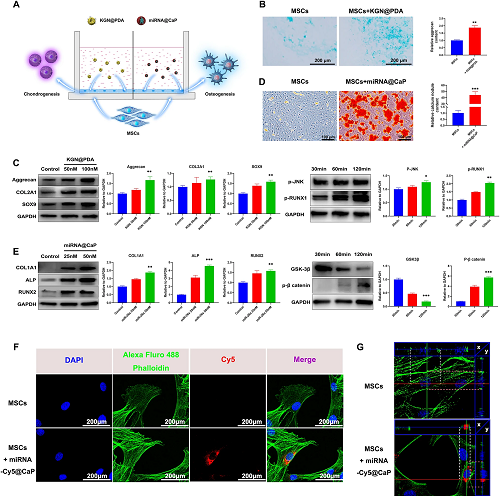
图4. 体外评估KGN@PDA和miRNA@CaP纳米颗粒对MSCs软骨形成和成骨作用的影响以及MSCs对miR-26a的细胞摄取。
V RNA微阵列分析
进行RNA微阵列分析探索用KGN或miR-26a处理的MSC的基因表达谱。将差异表达基因(DEG)进行聚类分析(图5A、F)。GO分析表明,含胶原蛋白的ECM、发育细胞生长和细胞凋亡信号通路的负调节参与软骨形成(图5B),ECM组织、骨化和血管生成的调节与成骨有关(图5G)。KEGG分析显示,KGN诱导的软骨形成(图5C)和miR-26a诱导的成骨(图5H)中PI3K-AKT、MAPK和内吞作用通路显着富集。KEGG通路的基因集富集分析(GSEA)确定了19条参与软骨形成的通路(图 5D)和16条参与骨生成的通路(图5I)。包括PI3K-Akt信号传导、ECM-受体相互作用、粘着斑和肌动蛋白细胞骨架途径调节在内的途径显着富集。图5E、J为KEGG通路相互作用图。
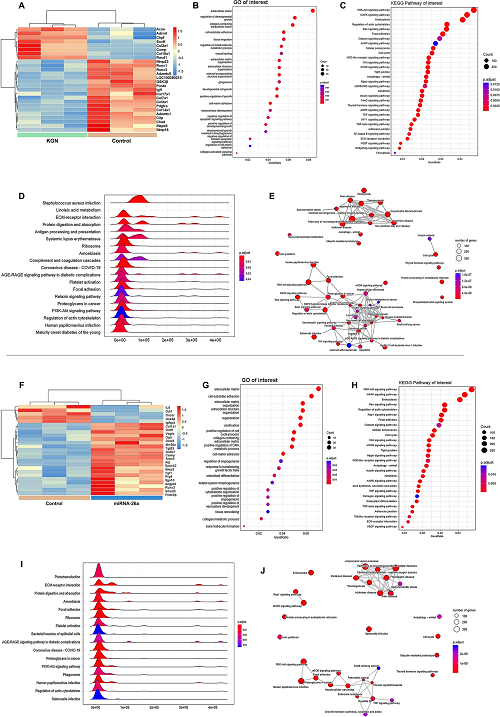
图5. 基于RNA-Seq的体外MSC成软骨或成骨转录组分析。
VI 体内评估
V组在术后6周和12周时宏观评分最高(n = 6,p < 0.05)(图6B)。显微CT图像提示6周时,IV组和V组形成了更多的钙化组织,体积超过了III、II和I组(图6C)。第12周时,V组的软骨下骨形成最明显,新骨几乎充满整个软骨下区域且具有最高的软骨下骨体积(图6D),体现了miR-26a优异的成骨能力。6周时,组织学观察表明第V组表现出优异的软骨下再生和软骨再生,MASSON三色和番红-O染色显示出具有最多的胶原蛋白和GAG,表明软骨基质正在生成。

图6. 体内软骨修复效果的大体、micro-CT及组织学评估。
VII 胶原定向分析和胶原II免疫组织化学染色
偏光显微镜显示,在第12周时,第I组的胶原纤维杂乱无章。在第II组和第IV组中,胶原纤维较前更加规则。III组具有丰富的纤维,而V组则拥有丰富且几乎垂直的胶原纤维,类似于天然软骨。在第III 组和第V组中观察到丰富的Col II染色,并且Col II水平从6周到12周呈增加趋势。在对照组中,Col II主要局限于宿主软骨的边界和缺损基底部。第II组和IV组显示出比I组更强烈的Col II染色,特别是在再生界面处尤为明显。V组中新软骨与软骨下骨结合优于其他组别。

图7. 术后12周再生组织的偏振光、胶原纤维分布和Col II免疫组织化学分析。
作者简介


关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 浙江大学冯刚、齐义营等:图案化超分子水凝胶上原位沉积药物和基因构建定向骨软骨塞刺激骨软骨再生
 Nano-Micro Letters
Nano-Micro Letters 广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机
广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机 松山湖材料实验室林生晃&湖南大学杨蓉:多模态神经形态器件与集成
松山湖材料实验室林生晃&湖南大学杨蓉:多模态神经形态器件与集成 安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化
安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化 浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池
浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池