研究背景
单原子纳米酶(SAzymes)凭借最大化的原子利用效率和精准调控的金属- 载体相互作用,展现出超越传统纳米酶的催化效率,其漆酶样活性最高可达天然酶的4.72倍,部分SAzymes的催化亲和力更是比天然酶高出5-20倍,在疾病诊断、肿瘤治疗、抗菌抗炎等生物医学领域掀起研究热潮。然而,金属原子团聚、高温下配体键断裂、环境耐受性不足、生物安全性风险及催化长效性有限等稳定性瓶颈,严重阻碍了其从实验室走向临床应用。例如,未优化的Fe-N₄单原子纳米酶在室温储存8周后,过氧化物酶(POD)活性显著下降,Fe-N-C类SAzymes 在酸性介质中易受自由基攻击导致Fe原子脱落,这些问题都成为其临床转化的关键障碍。如何系统性解决这些稳定性难题,实现单原子纳米酶的临床转化,成为该领域亟待突破的核心科学挑战。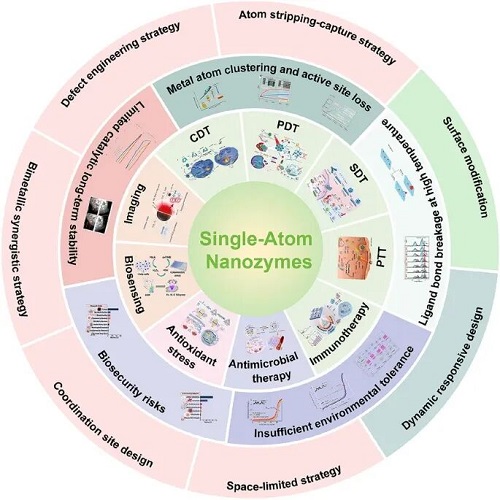
Innovative Strategies to Overcome Stability Challenges of Single Atom Nanozymes
Rong Guo , Qiuzheng Du, Yaping He , Haoan Wu* , Yu Zhang*,Ziwei Jing*
Nano-Micro Letters (2026)18: 100
https://doi.org/10.1007/s40820-025-01939-2
本文亮点
1. 全景聚焦,直击痛点:全面梳理了单原子纳米酶在实际应用中面临的五大稳定性挑战,涵盖原子团聚、键合断裂、环境适应、生物安全及长效催化等关键维度,为靶向解决方案提供清晰靶点。
2. 多维策略,协同破局:提出合成工艺优化、表面修饰、动态响应设计三大核心策略体系,包含空间限制、配位位点设计、双金属协同等细分技术路径,实现稳定性与催化性能的同步提升。
3. 临床导向,蓝图明确:构建“结构可预测、活性可调控、生物可兼容、规模可制备”四维发展路线图,为单原子纳米酶从基础研究向临床工具的转化提供明确指引。
内容简介
针对单原子纳米酶在临床转化中的稳定性瓶颈,东南大学张宇、武昊安团队联合郑大一附院荆自伟,开展了系统性的稳定性提升研究。该团队通过深入解析单原子纳米酶的结构-活性-稳定性关联机制,提出了多层次、全方位的创新解决方案:在合成环节,通过空间限制策略实现金属原子的原子级分散,借助配位位点设计强化金属-载体相互作用,利用双金属协同、缺陷工程等技术提升催化稳定性;在表面改性方面,通过靶向分子修饰实现精准递送,减少非特异性分布,提升生物相容性;在响应设计上,构建 pH、光等环境响应型体系,实现催化活性的按需激活,降低体内无效消耗。这些策略协同作用,有效解决了单原子纳米酶在复杂生物环境中的稳定性难题,显著提升了其在疾病诊断与治疗中的可靠性和安全性。
图文导读
I 稳定性挑战的核心症结
单原子纳米酶的稳定性问题源于其独特的原子级结构特性:高表面自由能导致金属原子易迁移团聚,高温或极端环境下配体键易断裂,生理环境中的离子、生物分子会干扰活性位点,非降解载体可能引发长期生物安全风险,这些因素共同制约了其临床应用。单原子纳米酶的稳定性问题源于其独特的原子级结构特性,五大核心挑战相互交织,共同制约其临床应用:
金属原子团聚与活性位点流失:Fe、Co等金属原子因原子级分散导致表面自由能极高,在催化反应或储存过程中易迁移团聚形成纳米颗粒,导致活性位点密度下降;过高的金属负载量或合成中的高温碳化、溶剂处理步骤,会破坏金属 – 载体配位结构,加剧团聚风险,甚至导致原有活性位点消失或被覆盖,阻碍底物分子吸附。例如,Cu-N₄配位结构在催化过程中易因 H₂O₂吸附导致活性位点流失,而Fe-N₄活性位点的对称电子结构会限制催化选择性和¹O₂生成效率。
高温下配体键断裂:高温环境中金属原子动能增加,易克服扩散壁垒,导致 Metal-N/C/O配体键断裂,削弱金属-载体相互作用,引发原子脱落或团聚。如Pd 单原子催化剂在100℃时保持稳定,但在600℃时活性显著丧失;还原气氛下高温处理更易诱发金属原子团聚。
环境耐受性不足:在强酸碱、高氧化介质中,金属d轨道电子缺失会削弱配体键,降低键解离能,促进原子剥离;碳基或MOF载体易被腐蚀,暴露配位空位,加速单原子位点重构或团聚;过量H₂O₂还会氧化金属中心,导致催化路径偏离。例如,Fe-N-C SAzymes在酸性介质中易受自由基攻击,而Pt单原子在高H₂O₂浓度或低pH条件下配位结构会发生畸变。
生物安全风险:非降解载体(如传统碳基材料)可能长期滞留体内引发炎症或免疫反应;金属离子(如 Co、Ir)慢性渗漏会导致器官累积毒性;贵金属 SAzymes(如 Pt、Ir)高剂量下可能引发细胞毒性;且SAzymes缺乏天然酶的蛋白质折叠等保护机制,易受生物体内生物分子干扰,降低催化选择性。
催化长效性有限:长期催化和储存过程中,活性位点团聚现象加剧,且无天然酶的自我保护机制,易受外界因素影响失活。如Pd₁/ZnO-bulk催化剂经长期稳定性测试后出现严重团聚;未优化的Fe-N₄ SAzyme室温储存8周后POD活性显著下降。
II 合成工艺优化:筑牢稳定根基
合成工艺优化是提升稳定性的核心手段。空间限制策略利用多孔材料的分子笼效应实现金属原子的空间隔离,避免团聚;配位位点设计通过轴向配位修饰、杂原子掺杂等方式优化电子结构,强化金属-载体相互作用;双金属协同策略通过不同金属原子间的电子转移调节催化动力学,同时抑制原子迁移;缺陷工程与原子剥离-捕获策略则进一步拓展了稳定活性位点的构建路径,为单原子纳米酶提供了坚实的结构基础。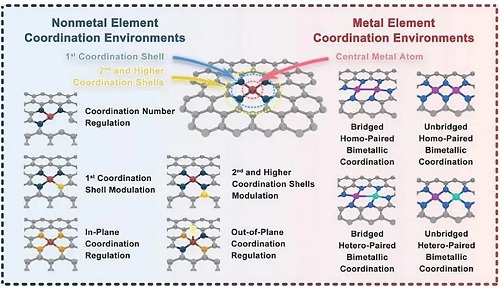
图1. 改变碳基基质中的各种配位环境策略。
空间限制策略:利用多孔材料的分子笼效应实现金属原子空间隔离,避免迁移团聚。以MOF材料为前驱体结合介孔二氧化硅保护策略合成的Zn-卟啉结构 SAzyme,储存6个月后细菌抑制率仍保持95%以上;Cu单原子锚定在二维碳纳米结构形成的CuN₃-SAzyme,经500 Gy辐射后几何结构和配位环境无显著变化,仍保持高酶活性;通过该策略制备的Cu-CN SAzyme,金属负载量高达23.36 wt%,且在体内外均展现出优异的级联催化活性和生物相容性。
配位位点设计策略:通过轴向配位修饰(引入 O、Cl、S、B 等原子)或杂原子掺杂(P、S、F等)优化电子结构,强化金属-载体相互作用。Fe-B/N-C SAzymes通过轴向B配体调制电荷分布,加速H₂O₂分解,同时提升稳定性;FeN₃P-SAzyme 通过磷氮精准配位调控电子结构,POD催化活性和动力学可与天然酶媲美;Pt₁-N₃PS活性位点通过N、P、S多原子配位形成强共价键,在900℃煅烧时仍能抑制Pt原子团聚,连续催化30 h活性无明显衰减,POD活性达传统Pt纳米颗粒催化剂的100倍以上。
双金属协同策略:利用两种金属原子间的电子转移调节催化动力学,同时抑制原子迁移。Mo/Zn双金属SAzymes中,金属原子经一年水浸仍保持分散,催化活性无明显衰减;FeCu-DA双原子纳米酶通过Fe位点(POD活性)与Cu位点(SOD 活性)协同,更高效生成ROS,增强免疫原性细胞死亡(ICD)效果,提升癌症免疫治疗效率;PtNPs-Fe/NC通过Pt NPs与Fe位点间的定向电子转移,优化Fe位点电子密度,提升氧还原反应(ORR)的稳定性和催化性能。
缺陷工程策略:在载体表面构建配位不饱和缺陷位点,增强对金属单原子的锚定能力。Fe-SAzyme通过边缘位点工程暴露缺陷Fe-N₄原子位点,催化H₂O₂分解的动力学参数优于天然过氧化氢酶;Cu₁/CeO₂ SAzyme经高温烘焙诱导形成配体不饱和Cu₁O₃缺陷位点,显著激活Cu原子,加速H₂O₂解离生成・OH,且细胞毒性低。
原子剥离-捕获策略:将金属纳米颗粒或块体粉末中的原子逐步剥离,迁移至特定载体并被配体位点捕获锚定。通过反向煅烧工艺将Pt纳米颗粒原子化,被N、P、S共掺杂碳基底捕获形成热稳定Pt单原子,所得Pt-TS-SAzyme的POD活性和动力学远超Pt纳米颗粒酶。
III 表面修饰与动态响应:适配生物环境
在表面修饰通过配体、抗体、肽链等靶向分子进行接合,实现单原子纳米酶的精准递送,减少脱靶积累和活性损失;以天然材料为模板的修饰策略则提升了生物相容性和代谢效率。动态响应设计让单原子纳米酶能够感知肿瘤微环境的 pH、光照等信号,实现催化活性的按需激活,在病灶部位精准发挥作用,同时降低正常组织中的无效消耗,显著提升了体内应用的稳定性和安全性。
表面修饰策略:利用适配体、抗体、肽链等靶向分子接合,实现精准递送,减少脱靶积累和活性损失。EBV编码LMP1天然配体修饰的MIrPHE SAzyme,在EBV相关鼻咽癌模型中,肿瘤部位富集量是未修饰组的3倍以上,且无明显全身毒性;叶酸修饰的Fe-N-C SAzymes在肿瘤部位积累量提升3.2倍,肝脾分布减少40%,肿瘤体积抑制率从52%提升至85%,对正常组织无显著毒性;Fe-CDs通过表面修饰血脑屏障穿透肽和胶质瘤靶向肽,可选择性靶向胶质母细胞瘤,激活自噬-溶酶体通路,有效抑制耐药胶质瘤生长。此外,以天然材料为模板(如红细胞、铁蛋白、纤维素)进行修饰,可提升生物相容性和代谢效率,如红细胞模板SAzyme(ETN)具有天然蜂窝结构,易降解且能减少长期毒性,同时兼具止血、抗菌和伤口愈合功能。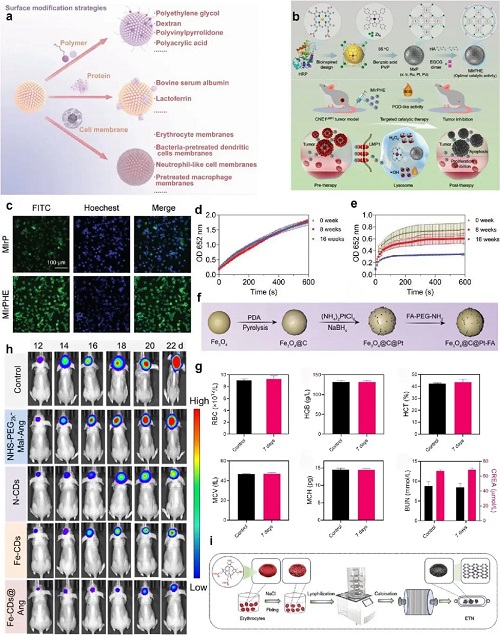
图2. a) 用于提高纳米酶生物相容性的表面修饰策略示意图。b) MIrP的合成过程及治疗效果示意图。c) MIrPHE对CNE1ᴸᴹᴾ¹细胞的靶向作用照片。d、e) MIrP(d)和MFeP(e)在室温下储存0-16周后催化TMB比色反应的时间-反应曲线(n=3)。f) Fe₃O₄@C@Pt的制备过程示意图。g) 小鼠注射Fe₃O₄@C@Pt-FA后1周的血液生化分析结果。h) 荷瘤小鼠相关数据(数据以平均值 ± 标准差表示,n=6,采用单因素方差分析和Tukey多重比较检验,*p<0.05,***p<0.001)。i) ETN的合成过程示意图。
动态响应设计:构建 pH、光、酶等环境响应体系,实现催化活性按需激活,降低体内无效消耗。pH响应型SA-Rh纳米酶在酸性肿瘤微环境中POD活性高效激活,结合光热治疗(PTT)协同增强肿瘤杀伤效果;Co-SAEs/HNCS在近红外照射下,光电子效应与光热效应协同触发ROS爆发和局部温和升温,强化催化治疗效果;FPB-Co-Ch NPs纳米酶体系在酸性条件下可发挥SOD、CAT、POD、OXD四种酶活性,高效杀灭耐药幽门螺杆菌,且对肠道菌群无显著影响;CaCO₃基pH响应型SAF NPs可在肿瘤部位程序化释放DOX,提升靶向性和抗癌活性。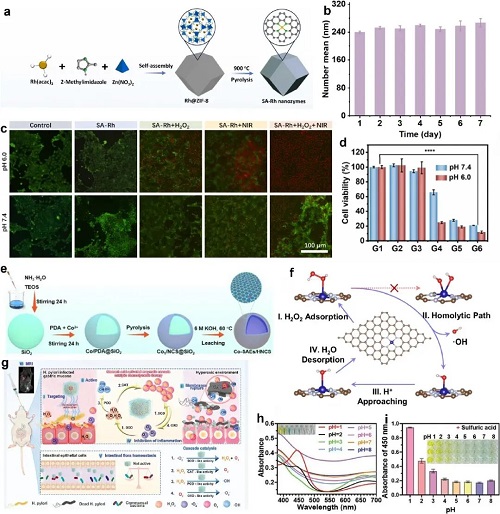
图3. a)铑单原子纳米酶的合成及其抗肿瘤治疗示意图。b)不同天数下 HCS-FeCu 纳米酶的流体力学直径变化。c)不同处理方式和pH条件下,经钙黄绿素-AM(绿色)和碘化丙啶(红色)染色的4T1细胞荧光图像(比例尺=100微米)。d)不同处理方式和pH条件下4T1细胞的存活率(G1:对照组,G2:铑单原子纳米酶组,G3:过氧化氢组,G4:铑单原子纳米酶+过氧化氢组,G5:铑单原子纳米酶+近红外光组,G6:铑单原子纳米酶+过氧化氢+近红外光组)。e) Co-SAEs/HNCS的合成示意图。f) pH 6.5、25℃条件下Co-SAEs/HNCS产生羟基自由基(・OH)的催化机制示意图。g) FPB-Co-Ch纳米酶复合物的制备及应用示意图。h) FPB-Co纳米颗粒与TMB在不同pH溶液中孵育30分钟后的吸收光谱及视觉颜色变化。i) FPB-Co纳米颗粒与TMB、过氧化氢在不同pH溶液中孵育30分钟后的吸收光谱及视觉颜色变化。
IV 临床转化潜力:高稳定赋能精准医疗
在生物医学应用中,经稳定性优化的单原子纳米酶展现出卓越性能:在疾病诊断领域,实现生物标志物的高灵敏检测和病灶的精准成像;在肿瘤治疗中,通过化学动力学、光动力、免疫治疗等多模式协同发挥高效抗癌作用;在抗菌和抗氧化应激治疗中,展现出长效稳定的治疗效果。尤其在复杂生理环境等严苛条件下,优化后的单原子纳米酶仍能保持稳定的催化活性和生物安全性,为临床应用提供了可靠保障。
V 总结
本研究系统阐明了单原子纳米酶的稳定性挑战及内在机制,提出了涵盖合成、修饰、响应设计的多维解决方案,构建了从基础研究到临床转化的完整技术链条。通过合成工艺优化强化结构稳定性,借助表面修饰提升生物相容性,利用动态响应实现精准调控,三类策略协同发力,有效突破了单原子纳米酶的临床应用瓶颈。所提出的四维发展路线图,进一步明确了单原子纳米酶从实验室走向临床的关键节点和目标。该研究不仅为单原子纳米酶的稳定性提升提供了系统性的技术支撑,也为新型仿生催化材料的临床转化提供了宝贵经验,有望推动单原子纳米酶成为下一代精准医疗的核心工具。
作者简介



关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 东南大学张宇、武昊安/郑大一附院荆自伟等综述:破解单原子纳米酶稳定性难题的创新策略
 Nano-Micro Letters
Nano-Micro Letters 中科院苏州纳米所王锦团队:“轻水材料”新概念,让水成为超轻隔热与无源降温功能材料
中科院苏州纳米所王锦团队:“轻水材料”新概念,让水成为超轻隔热与无源降温功能材料 中科院宁波材料所陈亮/林贻超:超2000小时稳定!钌单原子稳定NiFeOOH实现高盐水电解
中科院宁波材料所陈亮/林贻超:超2000小时稳定!钌单原子稳定NiFeOOH实现高盐水电解 邱介山/方国赵/米红宇等:界面调控型水凝胶电解质实现高性能水系锌电池与自供电生物传感监测
邱介山/方国赵/米红宇等:界面调控型水凝胶电解质实现高性能水系锌电池与自供电生物传感监测 广西大学王双飞院士&刘新亮等: 熵驱动纤维素弹性体自组装,用于机械能量收集和自供能感测
广西大学王双飞院士&刘新亮等: 熵驱动纤维素弹性体自组装,用于机械能量收集和自供能感测