研究背景
经皮给药技术因其能够规避肝脏首过效应、提高患者依从性,正逐渐成为替代注射等传统给药方式的理想选择。尤其对于蛋白质、核酸及细胞外囊泡(EVs)等大分子药物而言,其非侵入式递送具有重要的临床意义。然而,皮肤的多层结构(包括角质层、表皮和基底膜等)构成了天然屏障,使得这些药物难以有效穿透至皮肤深层,从而显著限制了其治疗效果。微针(MNs)作为当前主流的经皮增强技术之一,可通过形成微通道辅助药物穿透屏障,但通常需要针长≥600 μm 才能实现有效的渗透,这不仅可能引发疼痛与应激反应,还可能导致微损伤与皮肤刺激。此外,皮肤表面存在褶皱、毛孔、汗腺等复杂结构,影响微针贴片的贴附稳定性,进而导致药物释放分布不均,进一步降低治疗效果。因此,开发一种兼具高效递送、无痛体验及良好生物相容性的经皮给药系统,已成为亟需解决的关键科学与技术问题。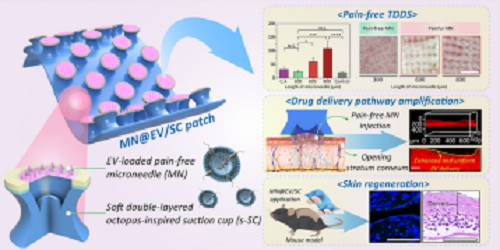
A Hierarchical Short Microneedle-Cupping Dual-Amplified Patch Enables Accelerated, Uniform, Pain-Free Transdermal Delivery of Extracellular Vesicles
Minwoo Song, Minji Ha, Sol Shin, Minjin Kim, Soyoung Son, Jihyun Lee, Gui Won Hwang, Jeongyun Kim, Van Hieu Duong, Jae Hyung Park* & Changhyun Pang*
Nano-Micro Letters (2026)18: 11
https://doi.org/10.1007/s40820-025-01853-7
本文亮点
1. 双增强递送策略:构建了一种仿生双增强贴片系统(MN@EV/SC),通过集成负载细胞外囊泡的短微针与柔性吸盘腔体,实现协同增强的经皮递送效果。
2. 无痛深层高效递送:该系统实现了高达290 μm的有效渗透深度,并通过短微针设计显著降低血浆皮质酮水平,兼顾药效递送效率与使用舒适性。
3. 增强皮肤再生功能:通过高效递送外泌体以激活真皮成纤维细胞并促进胶原蛋白合成,同时维持其生物活性,展现出优异的皮肤修复与再生潜力。
内容简介
为突破大分子药物在经皮递送中的穿透限制,韩国成均馆大学Changhyun Pang 研究团队设计了一种仿生双增强透皮贴片系统(MN@EV/SC),通过整合短微针(≤300 μm)与柔性吸盘结构,实现无痛且高效的细胞外囊泡(EVs)递送。短微针可有效避免传统长微针所带来的不适与组织损伤,而吸盘结构则通过产生局部负压诱导角质层发生形变,从而增强贴片与皮肤之间的贴合性,协同提升微针的渗透效率及药物分布的均匀性。
体外与体内实验结果表明,该系统可将 EVs 稳定递送至约290 μm的皮肤深层,显著优于单独使用微针时的 111 μm。递送过程中,EVs 保持良好的生物活性,能够显著促进成纤维细胞的增殖(Ki-67 阳性率升高)、迁移及胶原蛋白合成,并具备抵抗过氧化氢诱导的氧化应激能力。MN@EV/SC 同时展现出良好的缓释性能与组织相容性,适用于复杂曲面皮肤的贴附。
在中年老鼠皮肤再生模型中,MN@EV/SC 显著改善了真皮结构,使真皮厚度提升至对照组的 1.6 倍,胶原蛋白含量增加 169.1%,并显著下调 MMP-2 及衰老相关标志物(p16、p21)的表达,显示出优异的皮肤重塑与抗衰老潜力。该研究为细胞外囊泡等大分子生物活性物质的无创经皮递送提供了创新性策略,在皮肤治疗、抗衰老及组织修复等领域具有广阔的应用前景。
图文导读
I 双增强MN@EV/SC系统的构建与工作原理
图1展示了仿生双增强贴片MN@EV/SC的构建及其工作原理。该系统由负载EV的微针阵列与仿章鱼吸盘结构的柔性吸附腔室(SC)集成,展现出良好的弯曲性能与皮肤贴合能力(图1a)。插图展示了章鱼足部的扫描电镜图像,揭示了仿生吸附结构的设计灵感来源。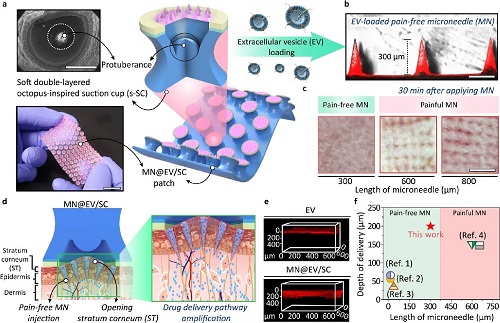
图1. 双增强经皮递送贴片系统的设计与构建:(a) MN@EV/SC的实物图与示意图。插图为八爪鱼前肢的扫描电镜图像(左上);贴片的柔性展示图(左下);吸盘结构内部集成微针(右)。(b) MN@EV的二维重建图像。(c) 不同针长的微针贴敷于小鼠皮肤后对皮肤屏障干扰的评估。(d) MN@EV/SC的双增强作用机制示意图,展示皮肤层的纳米级形变及其对EV分布行为的影响。插图为贴片贴附于皮肤表面的局部放大图。(e) 共聚焦显微图像显示EVs在皮肤不同层次中的递送深度。(f) 本研究所开发的MN@EV/SC与文献报道的微针递送系统在药物递送深度与针长方面的对比分析。
微针阵列的二维重建图像显示微针排列整齐、负载均匀,长度约为300 μm(图1b)。不同长度(300、600 和 800 μm)微针对小鼠皮肤组织的扰动情况评估结果表明短微针显著降低了组织损伤范围(图1c),有助于实现无痛递送。图1d展示了“微针穿刺+负压吸附”协同增强的递送机制:微针在皮肤局部形成微通道,吸盘产生的负压诱导角质层发生纳米级形变,从而显著提升 EVs 的渗透深度与分布均匀性。图1e为共聚焦显微镜拍摄的皮肤组织切片图像,清晰展示了 EVs 从表皮至真皮层的递送深度。将本研究所开发的MN@EV/SC系统与已有微针递送系统的文献数据在针长与药物递送深度方面进行对比(图1f),结果显示MN@EV/SC在短针条件下(300 μm)实现了高达290 μm的递送深度,显著优于传统系统,进一步验证了双放大策略在提升经皮递送效率与生物安全性方面的独特优势。
II 微针长度优化与无痛性能验证
图2系统评估了微针长度对皮肤穿透性、疼痛反应及贴附性能的影响,进一步验证了MN@EV/SC设计的合理性与优越性。通过构建不同长度(300、600 和 800 μm)的微针阵列,系统分析了其机械性能及其对皮质酮(CORT)水平的影响。扫描电镜图像证实微针成型良好,排列紧密(图2c)。力学测试结果显示,随着微针长度增加,其压缩强度增强,但同时对皮肤的侵入性也随之提高(图2d)。在小鼠模型中,短微针组(300 μm)诱导的 CORT 释放水平与化学贴附组相近,显著低于长针组,表明其可实现接近无痛的皮肤穿透(图2e)。通过荧光染料罗丹明B的递送深度分析发现,与单一微针贴片相比,MN/SC结构在保持短针条件下实现了更深层的药物递送(图2f、图2g),并在汗湿皮肤表面展现出更强的垂直方向粘附力(图2h)。进一步的时间依赖性递送实验表明,MN/SC系统能够稳定、持续地递送药物,渗透深度随时间显著增加(图2i)。综合以上结果,短微针与吸盘结构的协同作用有效兼顾了疼痛控制、递送效率与贴附性能,充分验证了MN@EV/SC双放大机制在设计上的科学性与实用性。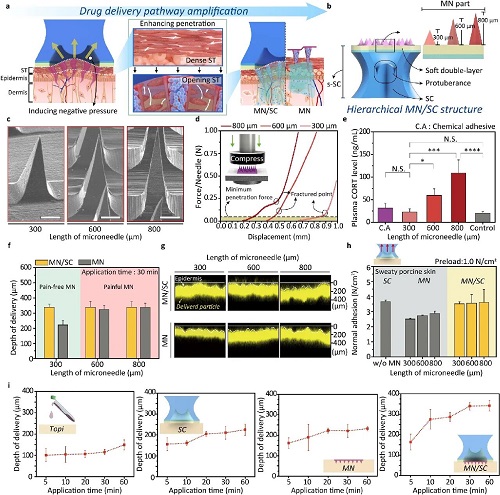
图2. MN/SC的特性:(a) 通过MN@EV/SC实现的详细双重放大机制示意图;(b) 单个 MN/SC结构示意图;(c) 微针的扫描电子显微镜图像;(d) 不同长度微针在压缩变形下的机械强度。图中展示力与位移关系曲线,虚线标出最小穿透力。内嵌图为力学测试装置示意图;(e) 在不同针长微针贴片处理后,C57BL/6 小鼠血浆中皮质酮(CORT)水平的 ELISA 检测结果(n = 3);(f) 使用 MN/SC和单独使用 MN 在猪皮中递送罗丹明B的深度对比,区域颜色表示疼痛等级(绿色:低痛,红色:高痛);(g) 不同针长条件下罗丹明B的荧光穿透图像(n = 10);(h) 在多汗猪皮上,单增强贴片(灰色)与双增强贴片(黄色)在不同针长条件下的法向附着力比较(n = 10);(i) 不同作用时间(5、10、20、30 和 60 分钟)下罗丹明B在猪皮中递送深度的比较(n = 10)。
III EVs 的高效递送与体内组织分布
图3深入评估了MN@EV/SC系统在小鼠皮肤中的 EVs 递送效率与分布行为,进一步验证了其在体外与离体组织环境下的功能表现。所设计的MN@EV/SC结构通过短微针与仿生吸盘的协同作用,构建了多层级递送通道,有效促进EV穿透角质层并进入真皮组织(图3a)。共聚焦激光扫描显微镜成像结果证实,EV 均匀包埋于微针内部,呈现规则的空间分布(图3b)。在离体小鼠皮肤实验中,EV 可借助MN@EV/SC结构实现横向与纵向的扩散,广泛分布于微针周围区域,形成持续且稳定的释放模式(图3c、图3d、图3e),其中递送深度和分布均匀性均显著优于未加载吸盘结构的对照组。综合以上结果表明,MN@EV/SC 系统可在无需外部能源或辅助设备的条件下,实现对真皮层的深层、高效且可控的 EVs 递送,为药物的经皮给药提供了切实可行的结构平台。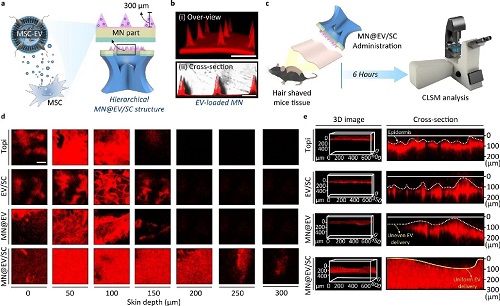
图3.MN@EV/SC平台实现高效EV递送。(a)MN@EV/SC的分层结构示意图;(b) 共聚焦激光扫描显微镜(CLSM)获取的 MN@EV 三维重建图像(比例尺:300 μm);(c)MN@EV/SC作用于小鼠离体皮肤组织的实验设计与时间轴示意图;(d, e)MN@EV/SC单个吸盘区域内EV在皮肤深度方向的荧光分布图,分别为横向(d)与纵向(e)重建图像(比例尺:50 μm)。
IV EVs 体内滞留表现与皮肤再生促进作用
图4系统评估了MN@EV/SC递送系统在小鼠体内的 EVs 滞留行为及其促进皮肤组织再生的能力。研究通过对比裸贴(EV alone)、传统微针(MN@EV)与双放大贴片(MN@EV/SC)三种方式,系统分析了EV在体分布情况与持续性(图4a)。在C57BL/6小鼠背部皮肤贴敷不同贴片后进行活体荧光成像,结果显示MN@EV/SC递送的EVs在皮肤局部可稳定滞留至少7天,且信号强度明显高于对照组(图4b),说明该系统具备良好的持续释放能力。进一步对不同递送策略下的荧光强度进行量化分析,结果表MN@EV/SC组在整个观察周期中均表现出最高的EV保留水平(图4c)。组织冷冻切片进一步揭示,MN@EV/SC递送的EVs不仅穿透表皮层,还能深入分布于真皮和皮下组织,分布范围更广泛(图4d)。此外,显著的皮肤层间界限分布清晰,表明递送过程结构完整,未造成严重组织扰动。以上结果充分表明,MN@EV/SC系统通过短微针与吸盘协同放大机制,显著增强了EV在皮肤内的分布深度与保留时间,在不引入外部能量的前提下实现高效、持续的生物活性物质递送,为皮肤疾病治疗和组织再生提供了可靠技术支持。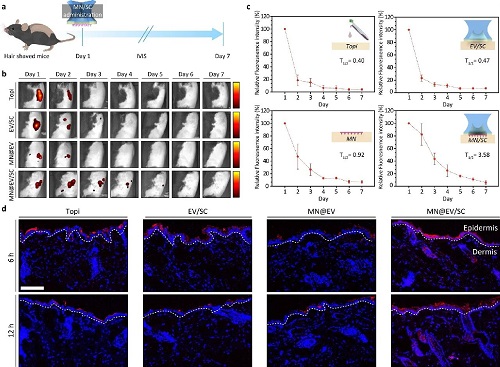
图4.MN@EV/SC系统在体内的递送效果及其EV释放行为评估: (a) C57BL/6 小鼠体内生物分布实验的设计示意图与时间进程图。(b) 不同时间点(第 1 天至第 7 天)EV 在体内滞留的荧光成像图(n = 3)。(c) 不同递送方式下荧光强度随时间变化的定量分析结果。(d) 冻切皮肤组织切片的荧光图像,显示标记EV在皮肤不同层次(表皮、真皮和皮下组织)中的分布情况,白线表示表皮与真皮的分界线(比例尺:100 μm)。
V EVs 对成纤维细胞功能的调控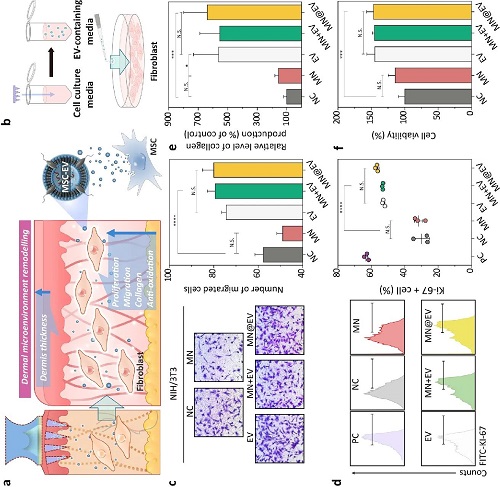
图5. MN 所载 MSC-EV 对成纤维细胞功能的影响:(a) MSC-EV 经 MN@EV 递送后作用于真皮成纤维细胞的机制示意图;(b) 利用溶解 MN@EV 制备含EV培养液的实验流程图;(c) NIH/3T3 细胞在 Transwell 迁移实验中的代表性光学显微图像(左)及其迁移能力的定量分析结果(右)(比例尺:1 mm);(d) Ki-67 阳性 NIH/3T3 细胞的流式细胞术图像(左)及其阳性率的定量分析结果(右);(e) NIH/3T3 细胞中可溶性胶原蛋白的相对产量(以对照组为参照);(f) NIH/3T3 细胞在 H₂O₂ 诱导的氧化应激条件下的细胞活力评估。所有数据均以均值 ± 标准差(mean ± SD)表示。统计分析采用单因素方差分析(one-way ANOVA)及 Tukey 事后检验,显著性水平标注如下:N.S. = 无显著差异,*p < 0.05,**p < 0.01,***p < 0.005,****p < 0.001。
图5展示了MSC来源的细胞外囊泡(MSC-EVs)在MN@EV中保持良好的生物活性,并对其在成纤维细胞修复潜能方面的功能进行了系统评估。研究通过构建Transwell实验及多项细胞功能检测,验证了MN@EV递送的EVs对皮肤修复关键细胞——NIH/3T3成纤维细胞的有效调控能力(图5a)。研究通过模拟递送过程,在培养液中溶解MN@EV以获得EV溶液(图5b),并用于后续细胞实验。Transwell迁移实验结果显示,EVs处理显著增强了成纤维细胞的迁移能力(图5c),表明其在皮肤再生中具有潜在促进作用。流式细胞术分析显示,经EV刺激后,细胞周期增殖标志物Ki-67阳性细胞比例明显升高,说明EVs能够有效促进细胞增殖(图5d)。同时,ELISA检测结果表明,EVs处理可显著提高成纤维细胞分泌可溶性胶原蛋白的水平,进一步支持其促修复功能(图5e)。在H₂O₂诱导的氧化应激模型中,EVs处理组的细胞活力显著高于对照组,提示MSC-EVs具有良好的细胞保护作用(图5f)。综上所述,图5证实MN@EV递送的MSC-EVs在微针制备与释放过程中保持了完整的生物功能,能够有效促进成纤维细胞的迁移、增殖、胶原合成,并增强其抗氧化应激能力。
VI 体内皮肤微环境改善与抗衰效果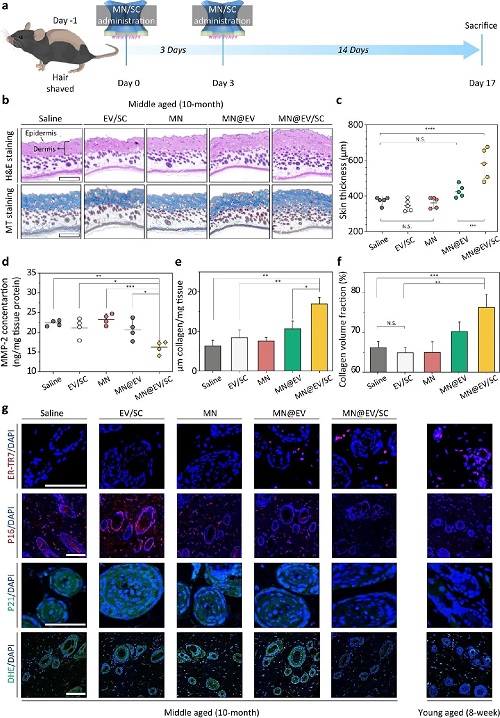
图6. MN/SC介导的EV递送在体内改善真皮微环境的效果:(a)MN@EV/SC处理老龄 C57BL/6 小鼠的体内实验时间进程图。(b) 皮肤组织的组织学分析,包括 H&E 染色(上)和 Masson 三色染色(下),黑色箭头指示表皮或真皮位置(比例尺:500 μm,n = 5)。(c) 皮肤切片中真皮厚度的定量分析结果。(d) 小鼠皮肤匀浆中 MMP-2 浓度的测定结果。(e) 真皮中胶原蛋白占比面积的定量分析结果。(f) 皮肤切片中胶原体积分数的定量分析结果。(g) 针对 ER-TR7、p16、p21 和 DHE 的免疫荧光染色图像,细胞核使用 DAPI(蓝色)染色进行标记(比例尺:100 μm)。所有数据均以均值 ± 标准误(mean ± SEM)表示。统计显著性分析采用单因素方差分析(one-way ANOVA)结合 Tukey 事后检验,显著性水平标注如下:N.S. = 无显著性差异,*p < 0.05,**p < 0.01,***p < 0.005,****p < 0.001。
图6系统评估了MN@EV/SC在体内对皮肤微环境的调控能力及其抗衰老与修复效果。在中龄C57BL/6小鼠模型中,研究团队按照预设时间线进行处理(图6a),并对处理区域的皮肤组织进行了组织学与分子水平的多维度分析。HE染色与Masson染色结果显示,MN@EV/SC处理组的小鼠真皮层厚度显著增加(图6b),图像定量分析进一步证实其显著优于其他对照组(图6c),表明该系统具有促进皮肤结构重建的能力。同时,皮肤组织匀浆液中基质金属蛋白酶-2(MMP-2)含量显著升高(图6d),提示其可能参与调控细胞外基质的降解与再生平衡。在胶原合成方面,MN@EV/SC处理组的真皮层中胶原含量占比及胶原体积分数均明显升高(图6e–f),表明该系统对胶原再生具有显著促进作用。免疫荧光染色结果进一步显示,MN@EV/SC处理可上调真皮成纤维细胞标志物ER-TR7的表达,显著抑制衰老相关蛋白p16和p21的表达,并降低ROS氧化应激水平(通过DHE染色检测)(图6g),提示其具备调控真皮微环境、抑制细胞衰老的潜力。综上所述,图6表明MN@EV/SC不仅能够有效将EVs递送至皮肤深层,还可通过调控皮肤微环境及成纤维细胞活性,增强皮肤组织结构完整性、促进胶原合成并延缓细胞衰老过程,展现出在抗衰老与皮肤修复领域的广阔应用前景。
VII 总结
本研究构建了一种仿生“双放大”经皮递送平台 MN@EV/SC,将短微针(300 μm)与仿章鱼吸盘结构相结合,通过微针穿刺与局部负压的协同作用,实现了EVs的无痛、高效且深层的递送。
实验结果表明,该系统在不引发明显应激反应的前提下,将EVs在皮肤的递送深度由传统微针的111 μm提升至290 μm,并在皮肤中保持长达5天的滞留时间。在功能层面,MN@EV/SC显著促进了成纤维细胞的迁移与增殖能力,增强了胶原蛋白的合成水平,同时有效降低了氧化应激引起的细胞损伤。在中龄小鼠模型中,该系统使真皮厚度增加1.6倍,胶原含量占比提升169%,并显著下调了衰老相关标志物p16和p21的表达,展现出卓越的皮肤再生与抗衰老效果。
综上所述,MN@EV/SC平台成功突破了传统微针在“递送效率—使用舒适性”之间的平衡限制,为大分子药物的经皮输送提供了一种具有临床转化潜力的新策略,在皮肤治疗、组织修复及抗衰应用中展现出广阔的应用前景。
作者简介


关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 韩国成均馆大学Changhyun Pang等综述:微针和仿生吸盘协同双增强,实现EVs无痛高效经皮递送
 Nano-Micro Letters
Nano-Micro Letters 江南大学刘天西、王子成等:阻抗/隔热双梯度结构聚酰亚胺纤维构筑及其多频谱兼容隐身
江南大学刘天西、王子成等:阻抗/隔热双梯度结构聚酰亚胺纤维构筑及其多频谱兼容隐身 哈工大周伟等综述:脉冲动态电解水助力传质增强、微环境调控与制氢优化
哈工大周伟等综述:脉冲动态电解水助力传质增强、微环境调控与制氢优化 天津大学姜忠义/张润楠&新加坡国立大学张岁等: “门-通道”结构COF支架膜用于高效锂镁分离
天津大学姜忠义/张润楠&新加坡国立大学张岁等: “门-通道”结构COF支架膜用于高效锂镁分离 南洋理工大学Jong-Min Lee等综述:偶极子及相互作用在高能量电池中的发展及优势
南洋理工大学Jong-Min Lee等综述:偶极子及相互作用在高能量电池中的发展及优势