Nano-Micro Letters (2021)13: 182
https://doi.org/10.1007/s40820-021-00697-1
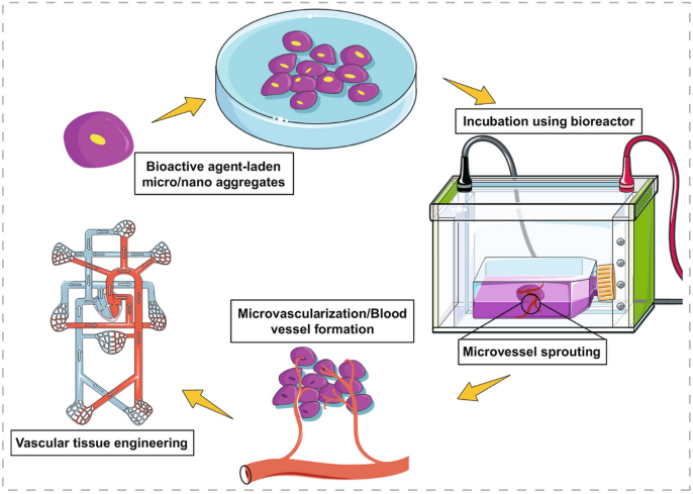
2. 对预血管化纳米-微米级聚集体在生物医学和再生医学中的应用进行了深入讨论。
生物制造方法需要在实验室中构建工程组织,如血管网络。基于微流体技术和生物打印的技术可用于创建血管网络。3D生物打印为难以获得高级血管化植入提供了卓越的解决方案。尽管这些过程已经取得了重大进展,但仍然无法模拟三维血管网络的功能和生理并发症。除了制造技术外,诱导血管化最常用的方法是在促血管生成因子(如血管内皮生长因子(VEGF))内可控地递送生物材料,如水凝胶支架。另一种方法是基于细胞的组织工程,它的理化参数需要优化。
为了设计血管组织,需要对心血管系统有全面的了解。毛细血管是最小且最丰富的血管且分布非常密集。毛细血管用于调节过滤过程,在100–200 µm的组织内直接交换营养素和废物。为了在体内获得充分的氧气和营养物质,宽度或长度大于此尺寸的工程组织需要先天性微血管的形成。
管化组织中的重大损伤,例如不能完全自行愈合的骨缺损,最终导致慢性疼痛。有限特征愈合能力和当前干预措施的局限性,使大血管缺损的治疗成为临床环境中需要解决的关键挑战。包括动脉和静脉在内的大血管由三个主要的显微壁层组成:外层由胶原纤维和弹性组织组成,中层由胶原纤维、弹性组织和平滑肌组成,内层由内皮组成。动脉比静脉含有更多的弹性组织,这使得动脉能够随着血压的升高而增强其血液传导能力。小静脉、小动脉和毛细血管等小血管壁比动脉和静脉壁薄得多,窄得多。小静脉和小动脉分别由薄层纤维组织和平滑肌组成的小直径血管。毛细血管通常只有一个细胞的厚度,可以实现最佳的质量交换和液体渗透性。根据血管大小,细胞类型略有不同。静脉、动脉和小动脉由内皮细胞(ECs)、周细胞和平滑肌细胞(SMC)组成。小静脉由内皮细胞(ECs)、周细胞和平滑肌细胞(SMC)组成,这些细胞赋予小静脉与动脉的区别特征。毛细血管由单个内皮细胞(EC)和一些周细胞组成,周细胞主要被认为是稳定血管壁的细胞。大血管的主要作用是使血液和物质输入或输出器官。相反,小血管或不同的毛细血管与多种生物学过程有关,包括促进组织间质液体的运输和吸收、淋巴细胞的迁移和免疫反应等。血管的功能和结构具有显著的复杂性。组织工程微血管的复杂性是组织工程领域面临的主要挑战。此外,还应考虑任何组织工程的关键因素,包括化学生长因子、干细胞、支架材料、机械力、支架形貌、电刺激、生物相容性/生物降解性,电活性支架以及细胞板支架。
A 生长因子
细胞外基质(ECM)是一个高度动态的微环境,主要通过招募和激活不同的生长因子(GFs)来调节多种细胞过程。不同位置的不同亲和力导致不同的GF-ECM相互作用;此外,GFs有许多相互关联的交互作用,其具有全功能行为的能力(图3)。ECM通过与细胞受体结合的GF活性调节下游信号通路,并导致血管生成过程中新血管的从头形成。通过可控释放生物材料中的生长因子,已经建立了许多体外方法来模拟出芽。一般来说,将刺激新血管形成的生长因子分为碱性成纤维细胞生长因子(BFGF)、血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)和转化生长因子-β(TGF-β)。化学和生物共价结合反应可用于将GFs结合到基质中,或将其装载到微米级聚集体或微球中以长期输送。最近,科学家们将VEGF负载的葡聚糖微粒组合到聚乳酸-乙醇酸(PLGA)微球中,这种可注射的方法实现了GF的控制释放。当注射到大鼠缺血组织中时,该系统在体外显示内皮细胞增殖,在体内形成毛细血管以及平滑肌α-肌动蛋白阳性血管。在另一项研究中,利用微流控技术制备了PLGA微球,该微球由载有VEGF的无水反胶束(R.M.)二棕榈酰磷脂酰胆碱(DPPC)纳米颗粒组成;据报道,28天的缓慢和持续释放可促进人脐静脉内皮细胞的增殖。同样,Tayebi研究团队制造了平均尺寸为16–36 µm的PLGA微球,用于控制VEGF的释放。最近的一项研究综述了各种微粒在控制和持续释放GF方面的潜力和应用。生长因子只能在局部细胞需要时通过使用各种物理刺激源释放,这些物理刺激源的侵入性很小,如光、超声波和局部热。例如,利用聚(N-异丙基丙烯酰胺)(PNIPAM)开发了磁热响应智能载体,以控制VEGF的释放和吸收,刺激人脐静脉内皮细胞增殖。生长因子的感知呈现和温和释放在调节新生血管形成中起着至关重要的作用。可以通过应用光来模拟生长因子,从而实现血管的出芽和内皮细胞在特定方向上的迁移,这可能导致VEGF在特定底物上的同质和对齐模式(图4),并且还导致在基质表面存在光图案化VEGF的情况下进行高分辨率细胞培养(图5)。研究表明,随着时间的推移,间质流动可以消除空间GF梯度,这表明生长因子和流体力共同控制新血管的生长。
另一种模拟血管化的策略是通过工程细胞的功能释放促血管生成旁分泌因子。例如,科学家证明,在血管组织环中加入明胶微球可以通过细胞自组装促进GF的释放和平滑肌收缩蛋白的表达。有研究已经证明,低浓度预处理间充质祖细胞分泌TGF-β可增强动脉生成基因表达谱。据报道,在心肌梗死大鼠模型的梗死心脏中培养间充质祖细胞时,基质细胞衍生因子1的分泌可以促进血管形成。研究表明,通过靶向性基因操纵间充质干细胞(MSCs)高水平表达内源性VEGF可显著提高体内血管生成支持能力。经VEGF修饰的可注射聚乙二醇微球可促进体内血管化,从而实现胰岛内植入和血糖水平调节。缺乏这些方法通常会导致失控的网络组织和渗漏微血管的形成。另外,另一项研究表明,对于骨骼肌,在生长培养基上培养适当的细胞(C2C12细胞)三天后,培养基成功地与成肌细胞培养基交换,从而刺激细胞分化和细胞排列。六天后,该程序完成,并观察到完整的细胞排列。有趣的一点是,细胞生长在叶子衍生的纤维素支架上,显示完全对齐或者部分对齐(图6)。
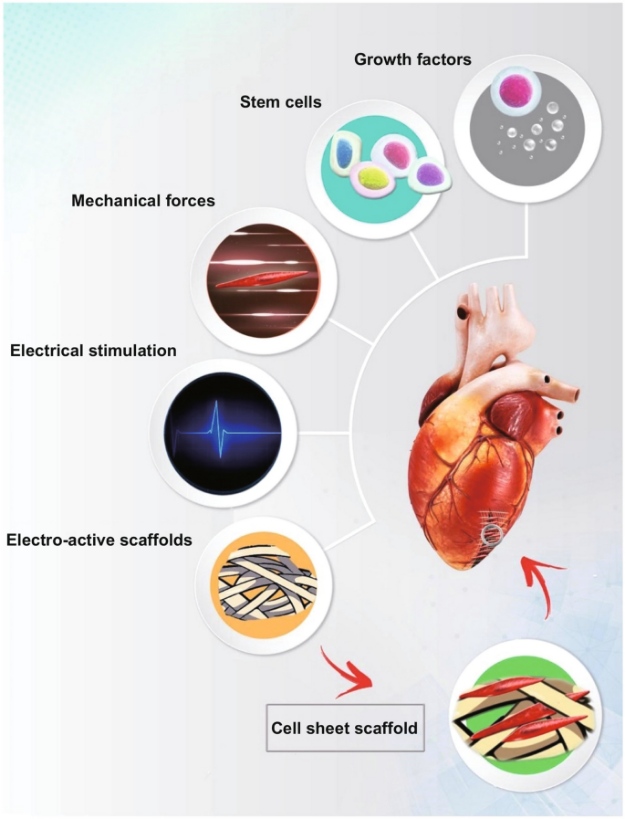
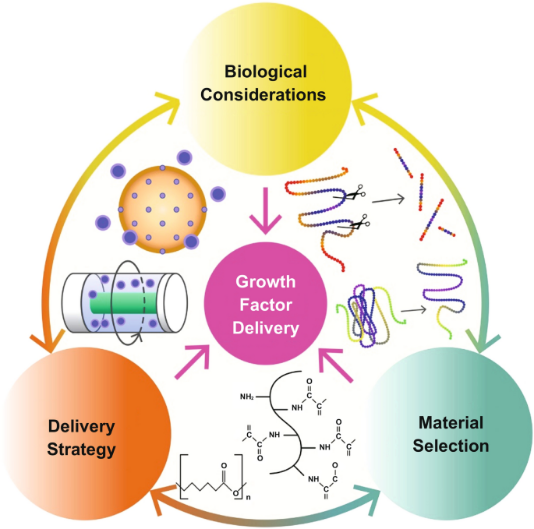
图3. 关于GFs递送以及每个关键因素对递送系统影响的示意图。
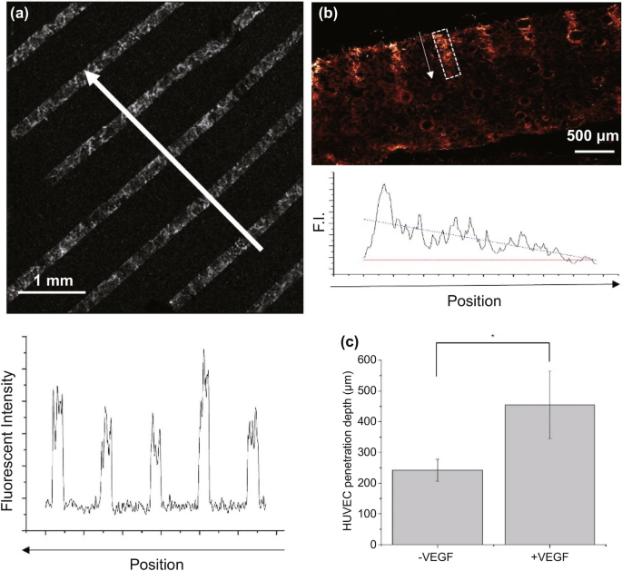
图4. 血管内皮生长因子在胶原-糖胺聚糖支架表面的光图案化。(a) 用VEGF光图案化的胶原-糖胺聚糖支架的表面;(b) 胶原-糖胺聚糖支架表面光图案化VEGF的横截面显微镜;(c) 胶原-糖胺聚糖支架表面的VEGF结合量。
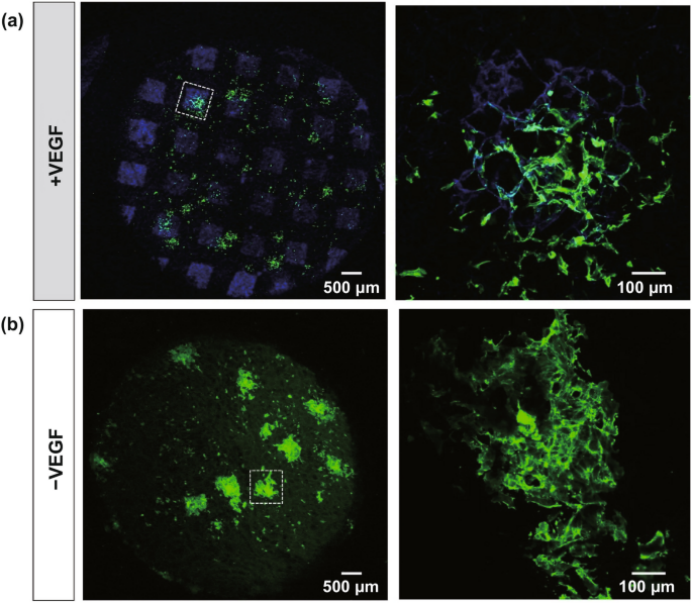
图5. 在胶原-糖胺聚糖支架表面上的光图案化VEGF,HUVEC细胞。(a) 在修饰的光图案化支架上培养的图像; (b) 在未修饰的光图案化支架上培养的图像。
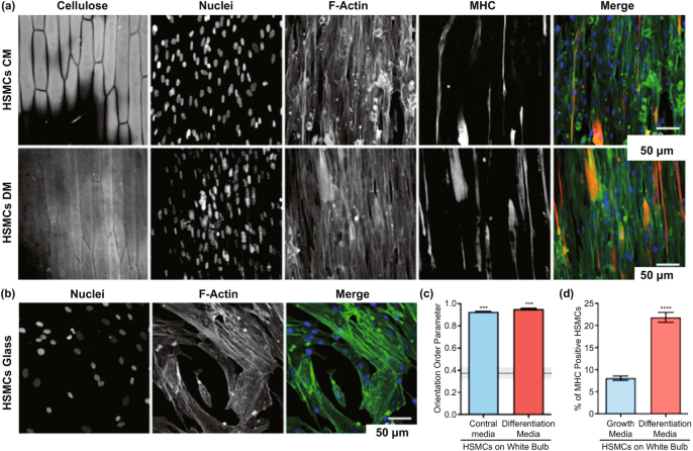
图6. 当C2C12细胞在葱源性纤维素支架的外表面上培养时,分化成排列整齐的肌管。(a) 当在外部葱白鳞茎或绿叶纤维素支架上培养时; (b) 共焦荧光图像显示C2C12细胞在纤维连接蛋白涂层(50 μg/mL)上培养时在玻璃盖玻片随机排列; 通过在不同底物上种植C2C12细胞的2D方向顺序参数(OOP),对肌动蛋白排列获得的荧光图像进行定量分析。
B 细胞成分
在许多生物工程策略中,研究人员利用原代内皮细胞构建中、微尺度血管系统。人脐静脉内皮细胞和原代小鼠肝细胞的联合生物打印显示出良好的细胞-细胞相互作用,并通过适当的诱导血管化显著增强CYP1A2的代谢活性和肝细胞的功能。最近,内皮细胞在毛发生长中的关键作用已被揭示,其中由人血管内皮细胞、人毛乳头悬浮液和小鼠胚胎上皮细胞组成的聚集体形成,然后定位于毛囊细菌中;该系统改善毛囊基因表达导致毛发再生。Carmeliet等人发表了一项单细胞研究,揭示了内皮细胞的转录组图谱,该图谱提供了内皮细胞异质性的更好表征,这可能解决了在微尺度和中尺度模拟血管模型的主要挑战。该图谱包含内皮细胞的全部转录组,包括内皮细胞的特殊表型和意外表型(图7)。所有这些结果都已通过蛋白质-蛋白质研究以及特定蛋白质分析(图8)得到验证,这有助于科学家评估纳米材料的行为和相互作用以及它们在细胞微环境中的相互关联关系。
周细胞在影响微血管的自分泌和旁分泌信号中起着关键作用。此外,毛细血管的形成和再生受周细胞丰度、规格和可塑性的调节。在体外重现这些细胞时遇到了一些挑战;神经胶质抗原2、平滑肌肌动蛋白和血小板衍生生长因子受体β是在不同品种中表达的表面标记物,可创造分化为平滑肌细胞和其他基质细胞类型的潜力。血管周围细胞有可能触发影响微血管模型中血管出芽的支持性支架形成的因素,尽管它们缺乏周细胞的组织特异性特征。因此,血管周围细胞替代作为一种关键的生物工程方法涉及在工程模型中分化干细胞(即骨髓或原代成纤维细胞来源的MSC)。例如,研究人员报导了在微流控装置提供的受控灌注条件下,人源性MSC和内皮细胞的相互作用,促进了MSC的增殖,并使血管细胞产生适当的反应。由纤维蛋白和胶原与人成纤维细胞和内皮细胞包埋而成的复合微球显示出周细胞样功能,体外培养14天的微血管网络成熟和预血管化微组织的形成中表明层粘连蛋白的沉积。在另一项研究中,胶原微球已经装载了人骨髓来源的骨髓间充质干细胞,以刺激多能干细胞来源的内皮细胞(iPSC-EC)。由于骨髓间充质干细胞与iPSC-EC相互作用,他们采用内皮细胞表型,表达内皮标记物CD31,形成管状微血管样模式。
另外,科学家们研究了包括多能干细胞衍生的内皮细胞(iPSC)策略在内的新细胞源进行微血管组织工程或体内再生。iPSC-人内皮细胞(ECs)(CD144+,CD31+抗原表达)的衍生方法产生小动脉或静脉样内皮细胞群。与HUVEC相比,一些研究强调了异位植入体内后内皮细胞缺乏成熟导致功能缺陷。Levenberg小组最近的一项研究表明,来源于胚胎干细胞(ESC)的内皮细胞(EC)能够与天然小鼠组织吻合,并在管腔中的第一例人类CD31+血管细胞中得到了证实。早期研究表明,iPSC内皮细胞中的CXCL12/CXCR4趋化信号可促进缺血视网膜的血运重建,与人类原代内皮细胞相比,后者对血管生成的贡献更大。已开发出载人脐静脉内皮细胞(HUVEC)的胶原微球,显示CD31+显著增加,表明在体内植入14天后出现新生血管(图9)。
有多种方法可用于周细胞的直接分化方案以及iPSC和ESC衍生的血管周细胞的生成。ECs、周细胞和血管平滑肌细胞(VSMC)现在可以从人类诱导的多能干细胞(hiPSC)高效生成,并用于器官芯片开发,作为模拟组织的基本体外血管化模型。除了体外模型外,许多研究小组还试图在再生损伤模型中获得功能性体内植入。iPSCs在工程中微尺度血管系统中的应用是一种自体的、无限的细胞来源以及高产量技术,为生成组织血管和体外模型提供了最有效的工具。
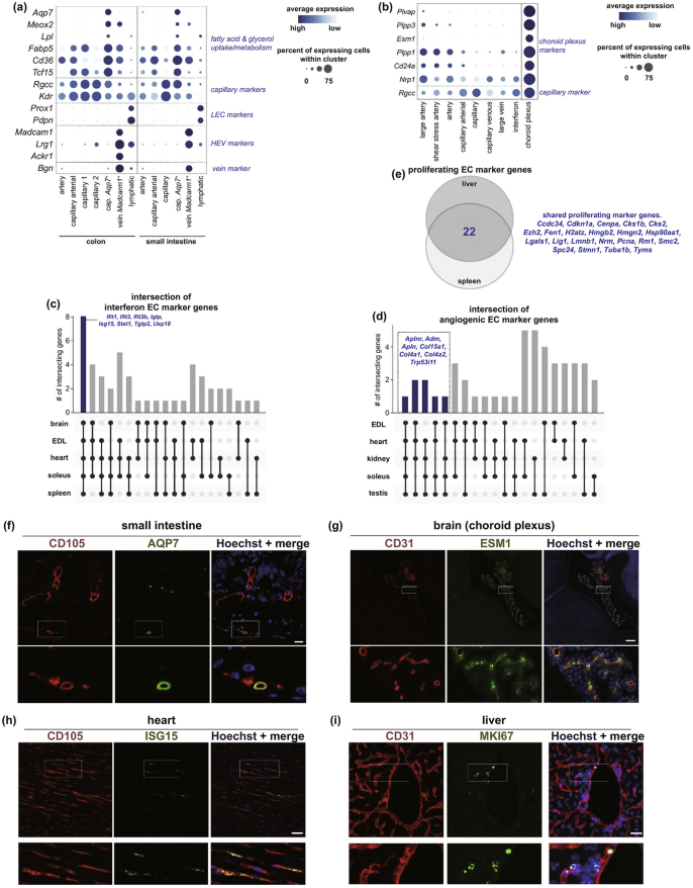
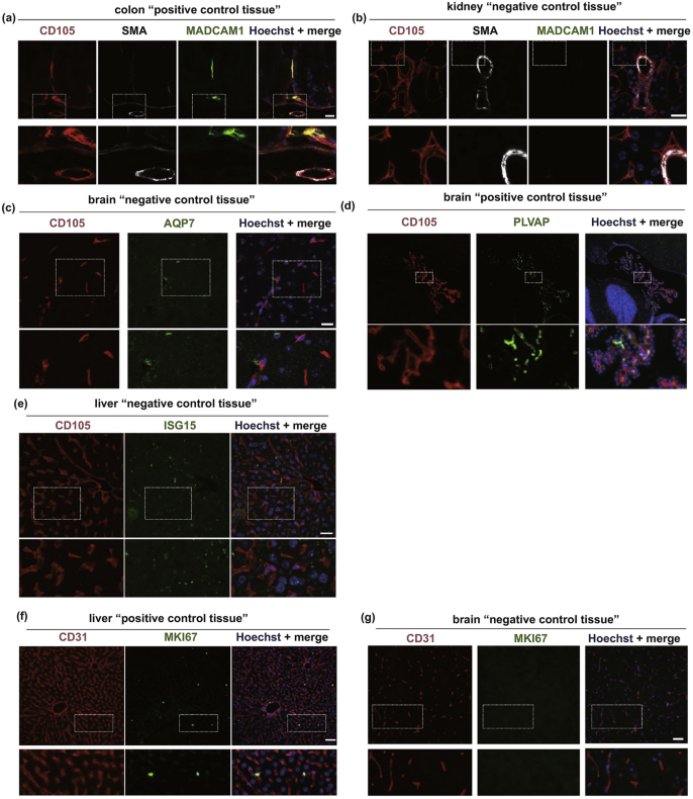
图8. 特殊内皮细胞表型的蛋白质验证实验。(a-b) 小鼠结肠的典型显微照片; (c-d) 小鼠脑切片的代表性显微照片(阴性和阳性对照组); (e-g) 小鼠肝脏的显微照片(阴性和阳性对照组)。
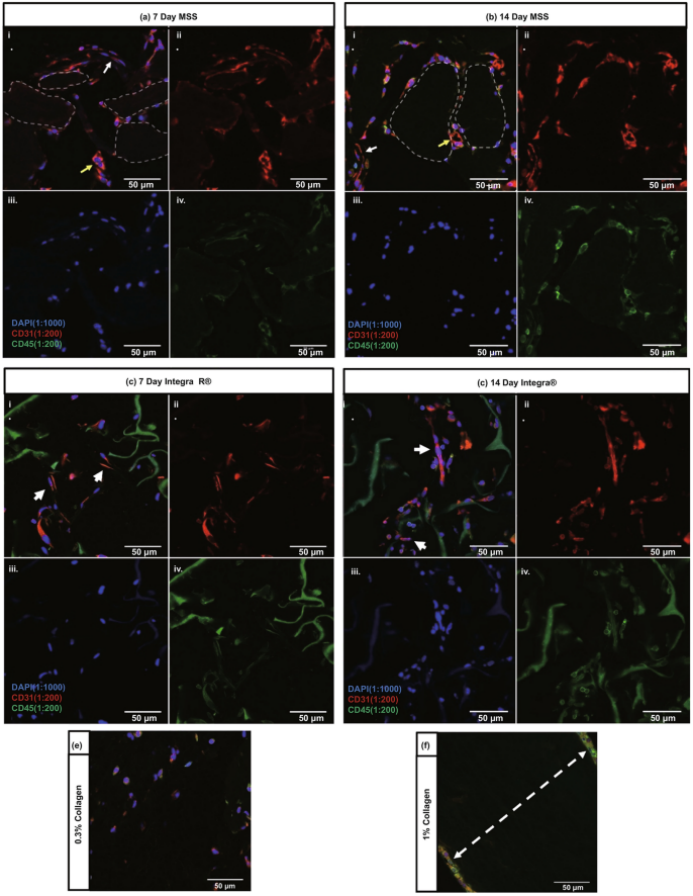
图9. 新生血管实验的体内阶段。(a) 微球支架的CD31和CD45染色;(b)微球支架的内皮细胞染色;(c-d) Integra®支架的内皮细胞染色;(e-f) I型胶原支架的CD31和CD45染色。
II 生物打印在解决问题方面的差距和作用
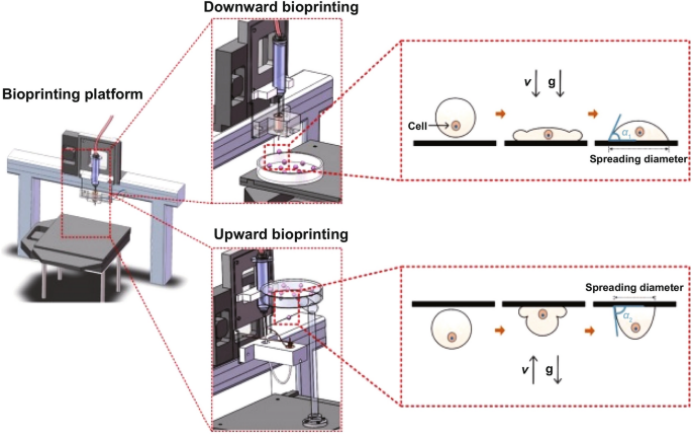
通过多种细胞类型和聚集细胞的共培养,可以创造各种不同的细胞形态。细胞外基质分泌能力是细胞在天然微环境中诱导有效通讯的重要因素。由于细胞-细胞和细胞-细胞外基质的相互作用有限,天然组织微环境通常不易形成。它可以通过细胞以分离的方式生长来实现,例如细胞负载水凝胶或单层细胞。为了解决这个问题,人们引入了新的生物打印技术。许多生物墨水配方包括细胞聚集体已被报道,成为生物打印血管化组织的一种有前途的工具。此外,生物打印技术在所需位置精确放置高密度细胞的能力为临床应用规模的仿生结构创造新的方案。例如,在功能化和高存活率的胰岛三维培养模型中,微血管化是非常需要的。Scheiner等人将50 μm聚(ε-己内酯-PEG-ε-己内酯)-b-聚(l-丙交酯)微球装载在3D打印的基于聚二甲基硅氧烷的结构中,然后装载胰岛细胞,使其在4周内产生显著的血管化。
血管组织工程面临的主要挑战之一是细胞培养系统中缺乏细胞间的相互作用和微血管网络的出芽,这些问题可以通过生成充满细胞的球体或微型聚集体来解决。由于球体的融合能力,它们可用于形成强健的内源性毛细血管样网络,从而为创建高度组织化的血管化微组织提供新的机会。在这方面,已经证明毛细血管新生的出芽能够改变富含纤维蛋白细胞的基质的机械生物学特性,从而改变细胞的命运。在另一项研究中,琼脂糖微模子被用作具有受控尺寸的高产量球体,以开发用于高通量制造血管前网络的平台。人脐静脉内皮细胞可以成功分化成球形,最近已与脂肪源性干细胞(ADSCs)结合使用,以改善球形体内的毛细血管形成和组织工程应用。激光诱导前向转移(LIFT)工艺是一种很有前景的数字印刷技术,它利用粘度在1到300 mPa s之间的水凝胶促进液滴的形成,从而在印刷技术中提高细胞密度(每毫升高达6000万个细胞)。
以组织球体和其他三维小细胞聚集体形式存在的微组织是模拟体内组织微环境的理想候选者,可对其进行重组,以生成可复制的复杂组织,如骨和胰腺,以及用于治疗目的的癌组织模型。这种球体的组装可以通过3D生物打印和微流控装置以受控方式进行。因此,这些组织球体必须具有标准尺寸和形状,以适合微组织生物打印过程中的连续分配。
大规模标准尺寸的可伸缩生物制造是另一个需要考虑的重要问题。直径大于300 μm的大球体或较小的共培养球体不适合生物打印。悬滴培养法是一种高维持性培养方法,可形成小的共培养球体。通过几种培养方法研究了血管化球体形成的适宜性。尽管开发了多种高通量球体培养系统,但迄今为止,它们已被用于生产单一培养球体或非血管化共培养物。目前尚未报道一种能够在体内高产量地形成大组织,具有可调和可控大小的预血管化微尺寸聚集体和微球的制备方法。
目前尚未报道一种能够在体内高产量地形成大组织,制备具有可调和可控大小的预血管化微尺寸聚集体和微球的方法。此外,这些预血管化微球将是模拟特定人类组织结构的微组织3D生物打印的基本元素。到目前为止,大多数工程化血管化组织的大小在1毫米范围内。然而,需要在大范围内进行微血管形成,并具有高细胞密度(~cm),以提供适当的灌注。此外,非粘附性微孔培养系统能够以高通量方式产生具有生物打印兼容几何形状的血管化前微组织。以不同比例(HUVEC/ADSC、HUVEC/HFF、HUVEC/ADSC/HFF)将人脐静脉内皮细胞(HUVEC)与其他支持细胞类型,如脂肪组织来源的间充质干细胞(ADSC)和人包皮成纤维细胞(HFF)共培养研究应用支持细胞类型和细胞比例对球体和微血管形成的影响。
球体的精确定位是一项重大挑战。球体密度在球体融合中起着至关重要的作用;因此,由于球体的位置不一致,可能导致不均匀融合。在这方面,球体在印刷前被灌注到固体圆筒中。与球形单位相比,圆柱形组织单位融合速度更快、更连续,尤其是在大规模情况下。这些结构可用于扩大血管组织生物制造。
 Rajender S. Varma
Rajender S. Varma
本文通讯作者
帕拉茨基大学 (Palacky University)
管理多学科技术项目,参与包括光催化、合成、环境科学,高效的污染物绿色修复技术等可持续化学的研究。近年来,专注于研究纳米光催化剂组装的绿色方法以及磁性可回收纳米光催化剂在良性介质中的可持续应用。
▍主要研究成果
▍Email: varma.rajender@epa.gov

Navid Rabiee
本文通讯作者
谢里夫理工大学(Sharif University of Technology)
生物材料,药物递送,基因递送,纳米材料。
▍Email: nrabiee94@gmail.com

Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 捷克Varma教授亮点评述:纳/微球状聚集体在预血管化和再生医学中的应用
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用