Intracellular Delivery of mRNA in Adherent and Suspension Cells by Vapor Nanobubble Photoporation
Laurens Raes, Stephan Stremersch, Juan C. Fraire, Toon Brans, Glenn Goetgeluk, Stijn De Munter, Lien Van Hoecke, Rein Verbeke, Jelter Van Hoeck, Ranhua Xiong, Xavier Saelens, Bart Vandekerckhove, Stefaan De Smedt, Koen Raemdonck, Kevin Braeckmans*
Nano‑Micro Lett.(2020)12:185
https://doi.org/10.1007/s40820-020-00523-0
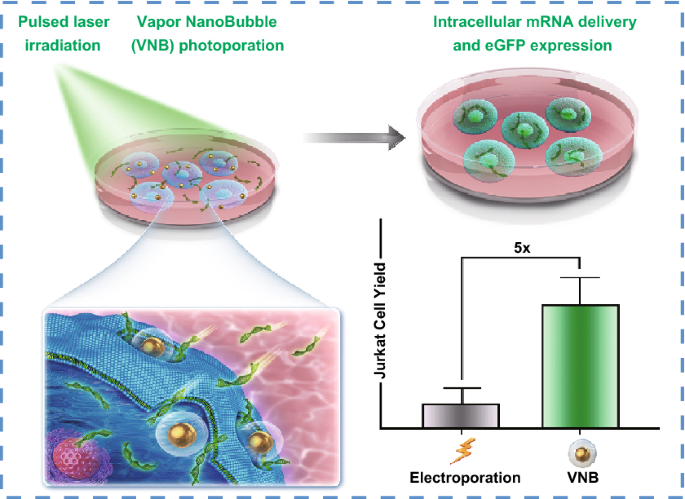
1. 蒸气纳米气泡(VNB)光穿孔是一种很有前途的转染贴壁细胞和悬浮细胞mRNA的物理技术。
2. 与VNB光穿孔过程相关的参数被优化以实现高效的mRNA转染。
3. VNB光穿孔产生的活体转染Jurkat T细胞是电穿孔的五倍,即目前用于T细胞的标准非病毒转染技术与电穿孔相比。
通过转染核酸进行高效、安全的细胞工程仍然是基础生物医学研究和许多新的治疗应用(如基于cart细胞的治疗)的长期障碍之一。近年来,mRNA作为一种比基于病毒或DNA转座子的方法更安全、更通用的替代工具越来越受到关注。然而,现有非病毒性mRNA传递途径的局限性阻碍了这些难以转染免疫细胞的基因工程的进展。比利时根特大学Kevin Braeckmans教授等在本研究中,证明金纳米粒子介导的蒸气纳米气泡(VNB)光穿孔是一种有前途的物理转染方法,能够在粘附细胞和悬浮细胞中递送mRNA。在HeLa细胞上进行的初步转染实验表明转染缓冲液和载体浓度的重要性,而该技术进一步证明可在Jurkat T细胞中有效递送mRNA,转染效率高达45%。重要的是,与电穿孔相比,电穿孔是T细胞非病毒转染的参考技术,转染的活Jurkat T细胞数量增加了五倍。总而言之研究结果表明,将VNB光穿孔技术作为一种更温和有效的技术用于粘附细胞和悬浮细胞的细胞内mRNA传递,具有在治疗和基础研究应用中未来改造细胞的潜力。
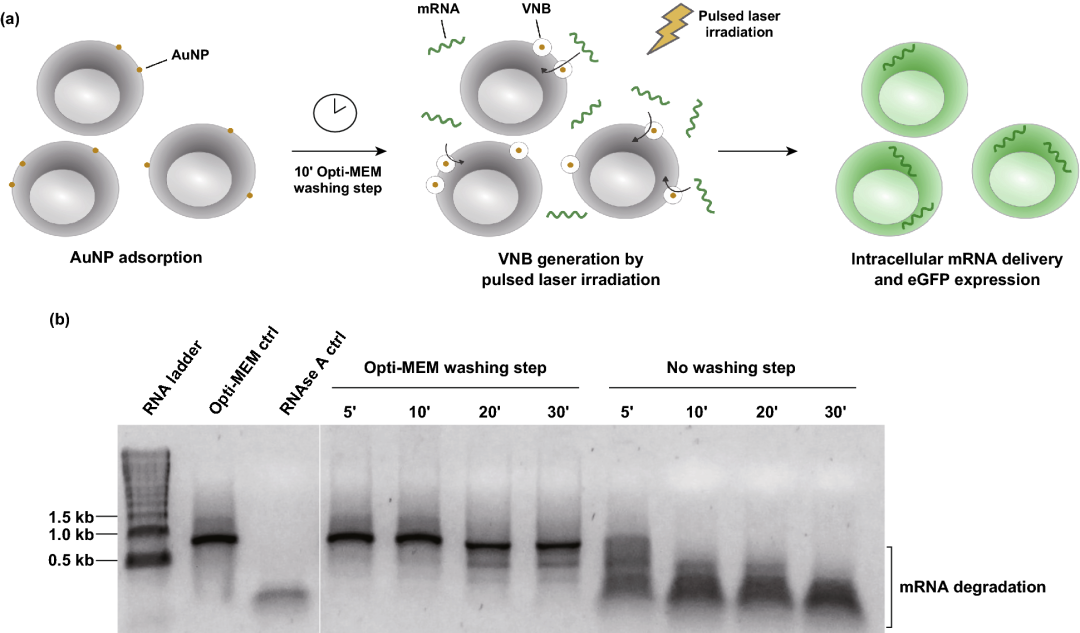
研究了用60 nm阳离子PDDAC包被的AuNPs作为光热纳米粒进行VNB光穿孔的适用性。直径为60 nm的AuNPs被认为是理想的光热敏化剂,需要最小的气泡成核阈值激光注量。对于VNB光孔法转染,首先用阳离子AuNPs孵育细胞。在冲洗掉未结合的AuNPs后,用单个激光脉冲(7 ns)照射会导致细胞结合的AuNPs产生VNBs。当热能被消耗时,VNBs不可避免地崩塌,导致细胞膜上的局部孔隙形成,使细胞外mRNA分子通过这些膜孔直接扩散到细胞质中。
图1. 气相纳米泡(VNB)光孔法转染mRNA的优化方法。(a) VNB光孔法转染mRNA的示意图。(b) 用天然琼脂糖凝胶电泳分析物理mRNA的完整性;1 µg eGFP mRNA 孵育HeLa细胞上特定的时间,事先用/不用Opti-MEM洗涤。作为对照,mRNA只在Opti-MEM (Opti-MEM-ctrl)中培养或用10 μg mL⁻¹ RNAse A (RNAse A ctrl)孵育30分钟。
II VNB光孔法在贴壁细胞中转染mRNA
HeLa细胞系在这里作为初始优化的参考细胞类型,因为它已经被广泛用于通过VNB光孔作用来量化细胞内各种分子(siRNA和纳米抗体)的传递。优化了VNB光孔法的相关参数,包括AuNP浓度、激光能量、转染缓冲液和mRNA浓度,以达到最大的转染效率和可接受的细胞毒性。与绝大多数对粘附细胞系的科学研究相一致,HeLa细胞实验选择了80%的细胞毒性阈值。
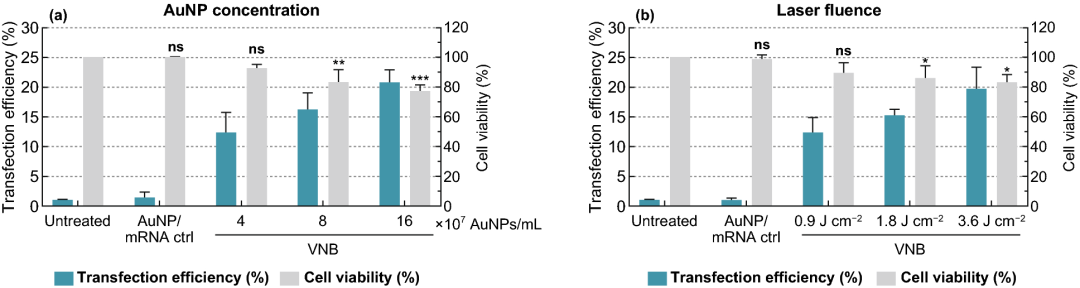
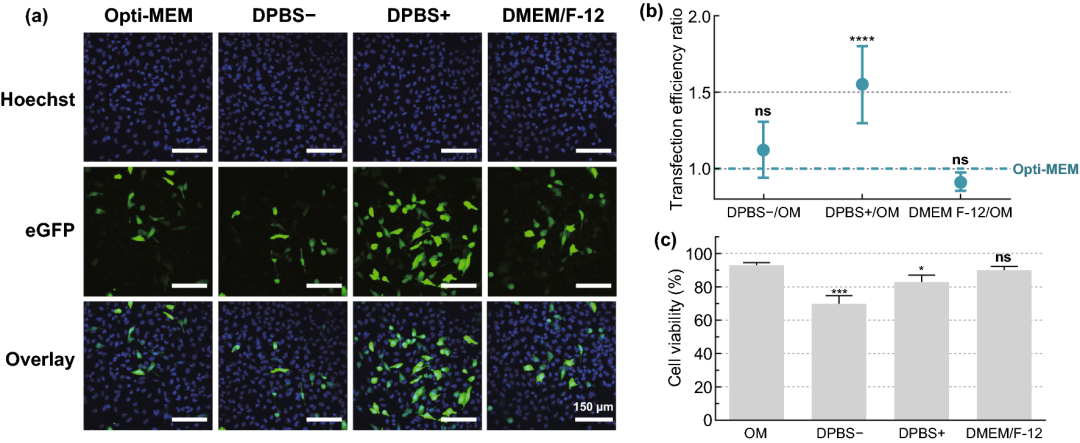
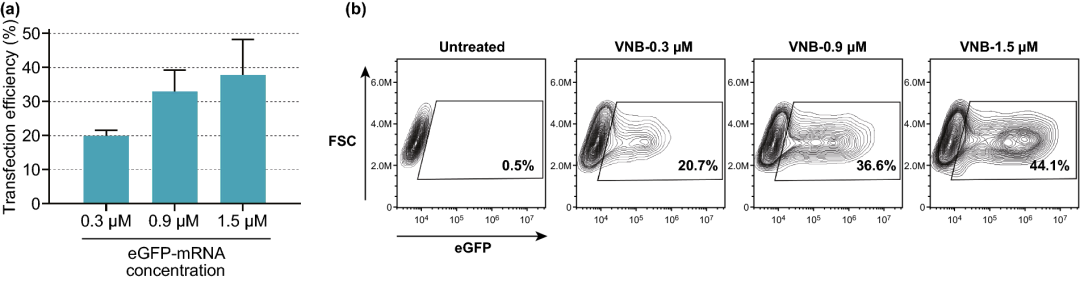
实验结果表明,细胞活力保持在80%以上的情况下,选择8×10⁷ AuNPs mL⁻¹ (~5 AuNPs/细胞)为最佳浓度,可产生约16%的eGFP阳性细胞;在3.6 J cm⁻²的激光照射下,可产生高达20%的eGFP阳性细胞;DPBS+作为HeLa细胞的转染缓冲液时,转染效果最好;随着mRNA浓度的增加,eGFP阳性细胞的百分比增加,1.5 µM mRNA的eGFP阳性细胞比例达到38%。
图2. 金纳米粒子(AuNP)浓度和激光照射量优化eGFP-mRNA转染HeLa细胞。(a) 在0.3 µM-eGFP-mRNA存在下,使用1.8 J cm⁻²的固定激光能量,不同浓度的AuNP来光孔化HeLa细胞。(b) 在0.3 µM eGFP-mRNA存在下,使用8×107 AuNP mL⁻¹的固定AuNP浓度,不同强度的激光能量来光孔化HeLa细胞。转染效率用流式细胞术(n≥3)测定的eGFP阳性细胞百分比表示。细胞活力值用CellTiter-Glo测定,并与未处理对照组(n=3)的相对值表示。采用单因素方差分析和Dunnett多重比较试验确定统计学差异(ns:无显著差异;*p<.05; **p<.01; ***p<.001)。
图3. HeLa细胞mRNA转染缓冲液的筛选。用不同的转染缓冲液:Opti-MEM(OM)、DPBS-、DPBS+或DMEM/F-12,通过VNB光孔法(0.3 µM mRNA;8×107 AuNPs mL⁻¹;3.6 J cm⁻²)转染HeLa细胞。(a) 转染后24小时HeLa细胞的典型共焦显微镜图像(比例尺=150 µm)。(b) 用流式细胞术(n=6)测定不同缓冲液与OM的转染效率比。进行单因素方差分析和Dunnett多重比较试验,以确定OM和其他缓冲液之间的统计差异(ns=无显著性;****p<.0001)。(c) 转染后24小时的细胞活力,与未经处理的对照组相比(n=3)。进行单因素方差分析和Dunnett多重比较试验,以确定OM和其他缓冲液之间的统计差异(ns=无显著性;*p<.05;***p<.001)。
图4. 提高eGFP-mRNA浓度对转染效率的影响。(a) 不同浓度eGFP-mRNA的转染效率,以eGFP阳性细胞百分比表示(n=3)。(b) eGFP-mRNA转染HeLa细胞典型实验的等高线图。
III eGFP‑mRNA转染Jurkat T细胞通过VNB光孔法
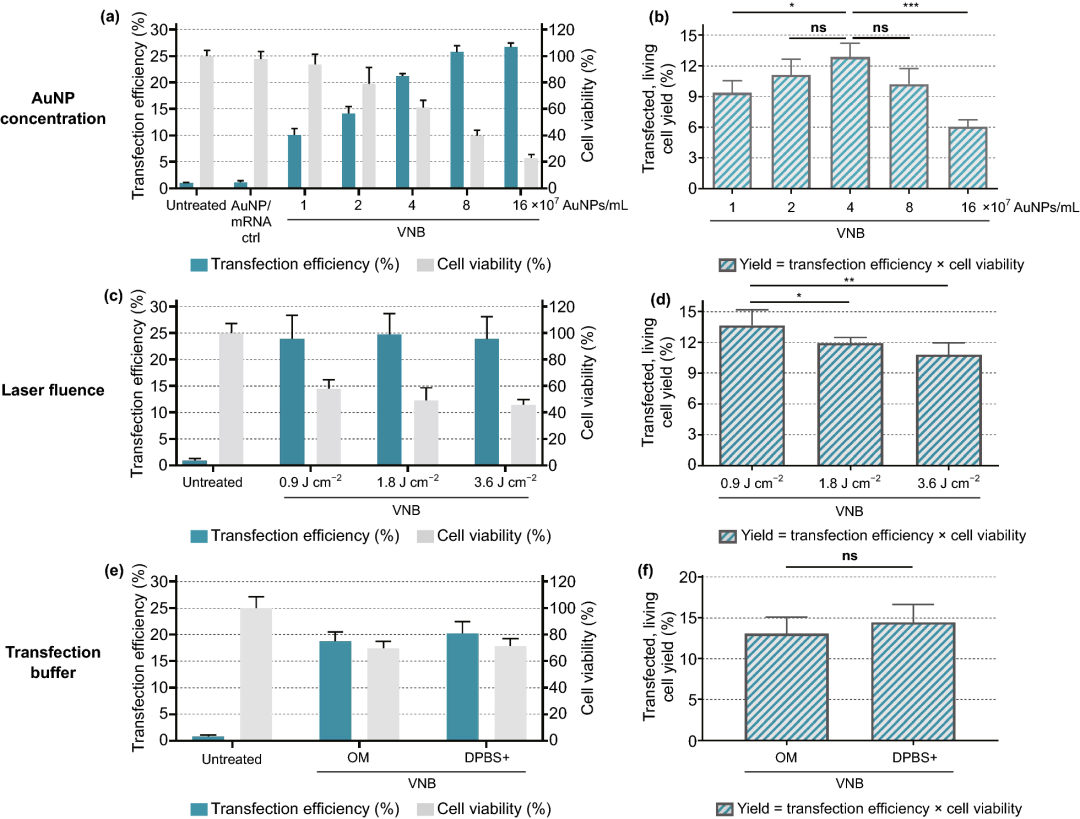
用Jurkat E6-1人白血病T细胞系作为原代人T细胞模型。与HeLa细胞转染实验相似,首先对Jurkat细胞VNB光孔化过程中的不同关键参数进行了优化(图5),即:(1)AuNP浓度;(2)激光注量;(3)转染缓冲液。
实验结果表明,4×10⁷ AuNPs mL⁻¹ (~2 AuNPs/细胞)的浓度为最佳条件,在该条件下约13%的初始细胞群是可存活和转染的;在0.9 J cm⁻²的最低激光能量下,活细胞和转染细胞的产量最高(~14%);用OptiMEM作为转染缓冲液,在Jurkat细胞上转染效率最好。
图5. 金纳米粒子(AuNP)浓度、激光能量和转染缓冲液对eGFP-mRNA转染Jurkat细胞的优化。转染效率表示eGFP阳性细胞的百分比,细胞活力值是相对于未经处理的对照组计算的,产量是转染效率和细胞活力的乘积。(a, b) 使用1.8 J cm⁻²的固定激光注量筛选AuNP浓度(n=3,用Dunnett的多重比较试验进行单向方差分析,ns=无显著性;*p<.05,***p<.001)。(c, d) 使用4×10⁷ AuNP mL⁻¹的固定AuNP浓度筛选激光能量(单位:J cm⁻²)(n=3,采用Dunnett多重比较试验的单向方差分析,ns=无意义;*p<.05,**p<.01)。e, f 比较Opti-MEM(OM)和DPBS+作为转染缓冲液的转染效率,使用4×10⁷ AuNPs mL⁻¹的固定AuNP浓度和0.9 J cm⁻²的激光能量(n=3,未配对的Student T检验,ns=不显著)。
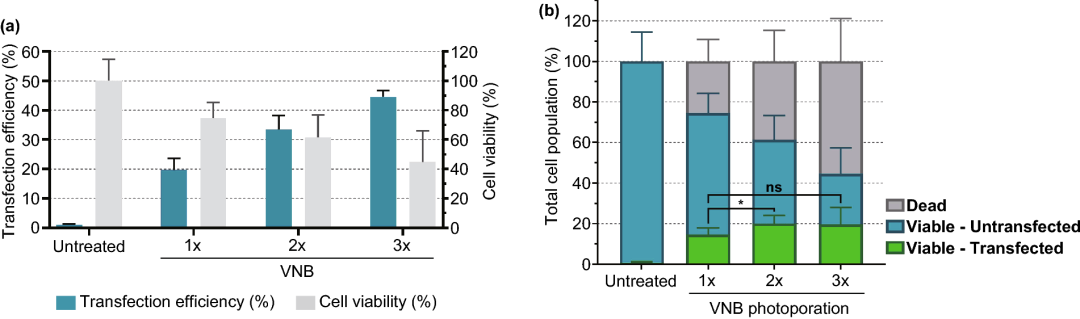
图6. 连续多次VNB光孔处理对Jurkat细胞mRNA转染效率的影响。(a) 转染效率代表eGFP阳性细胞的百分比,细胞活力值是相对于未经处理的对照组计算的。(b) 计算不同条件下的活细胞/转染细胞、活细胞/未转染细胞和死亡细胞的数量(n≥3,单因素方差分析与Tukey的多重比较试验,*p<0.05,ns=无显著性)。
IV VNB光穿孔比核型感染产生更多活的mRNA转染Jurkat细胞
电穿孔是目前最常用的非病毒核酸转染和T细胞体外修饰技术,将我们的技术与商业的电穿孔系统进行比较,结果显示转染的活Jurkat T细胞数量增加了五倍。
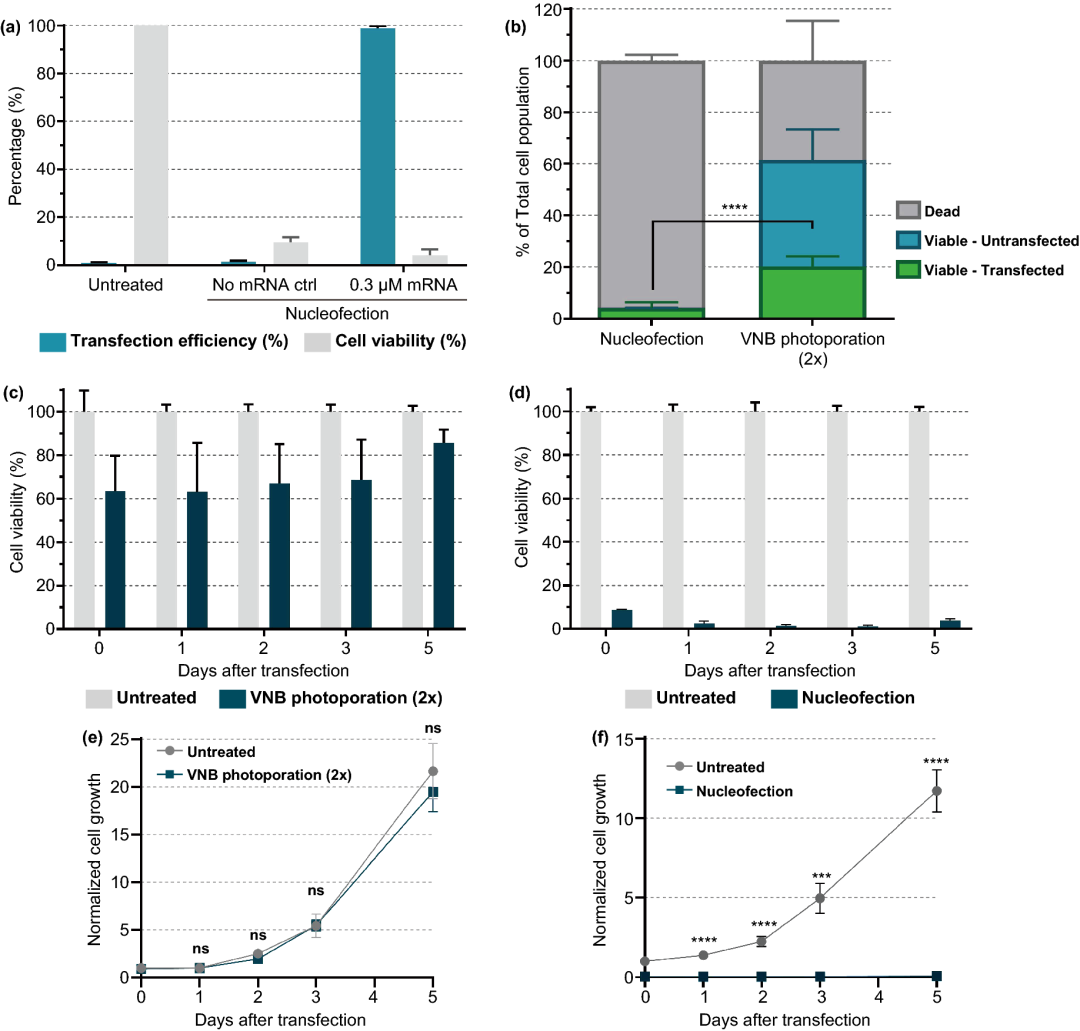
图7. 核型感染和VNB光孔法mRNA转染Jurkat细胞的比较。(a) 根据制造商的说明,通过核感染将eGFPmRNA (0.3 µM)转染Jurkat细胞。转染后24 h(n=3)用CellTiter-Glo法测定转染效率(即eGFP阳性细胞百分比)和细胞活力。(b) 核型感染和VNB光孔法在活细胞、转染细胞产量方面的比较(n≥3,未配对Student T检验;****p<0.0001)。(c, d) 转染后5天,在不同时间点测定VNB光孔(c) 或核感染(d) 后的细胞活力。第0天,在转染后2h测定细胞活力。每天计算与未处理对照组相比的细胞活力值(n=2×3)。(e, f) 在转染后5天,在不同时间点测量VNB光孔(e) 或核感染(f) 后的正常细胞生长。在第0天计算与未处理对照组相比的标准化细胞生长值。数据表示为平均值±SEM(n=2×3,未配对Student’s t test T;ns=无显著性,***p<0.001,****p<0.0001)。
 Kevin Braeckmans
Kevin Braeckmans
本文通讯作者
Ghent University 教授
生物光子学,药物输送,纳米医学,纳米技术,药物介导。
▍主要研究成果
在Nature Methods, ACS nano, Nature Reviews Drug Discovery等学术期刊以第一作者或通讯作者发表论文303篇,H指数为60。
▍Email: Kevin.Braeckmans@UGent.be
▍个人主页
www.researchgate.net/profile/Kevin_Braeckmans

Nano-Micro Letters《纳微快报》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2019 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前15%)。2019 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
Tel:021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 比利时Braeckmans教授:纳米气泡光孔法高效转染mRNA



 Kevin Braeckmans
Kevin Braeckmans
 Nano-Micro Letters
Nano-Micro Letters 比利时Braeckmans教授:纳米气泡光孔法高效转染mRNA
比利时Braeckmans教授:纳米气泡光孔法高效转染mRNA 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展