Molecular Design of Conjugated Small Molecule Nanoparticles for Synergistically Enhanced PTT/PDT
Wei Shao, Chuang Yang, Fangyuan Li*, Jiahe Wu, Nan Wang, Qiang Ding, Jianqing Gao, Daishun Ling*
Nano‑Micro Lett.(2020)12:147
https://doi.org/10.1007/s40820-020-00474-6
1. 通过受体导向的分子设计思路合成了具备较窄单重态-三重态能级差的共轭小分子IID-ThTPA。
2. IID-ThTPA NPs同时具备高光热转化效率(35.4%)和高1O2量子产率(84.0%)。
3. IID-ThTPA NPs可以发挥PTT/PDT协同治疗肿瘤的作用。
作为新兴的光学治疗方法, 光热治疗(PTT)和光动力治疗(PDT)在肿瘤治疗中受到越来越多的关注。近年来,将PTT和PDT集成到单一体系中协同治疗肿瘤已被广泛研究。其中光热效应可以加速血液流动,从而增加肿瘤内的氧气补充量,进一步放大PDT的功效。虽然协同治疗可以获得较好的抗肿瘤效果,但是目前可用的PTT/PDT制剂主要为多组分材料,不仅制备程序复杂,还必须由PTT和PDT两种不同波长的光源激发,所以往往面临稳定性差和操作性难等问题。因此研发可被单一激光源激发的单组分PTT/PDT制剂具有重要意义。供体-受体(D-A)共轭小分子(CSM)因具有出色的化学和光热稳定性已被广泛应用于有机光电、化学传感和生物医学等领域。基于各种受体,已经为PTT和PDT开发了许多CSM和共轭聚合物。其中吡咯并吡咯二酮(DPP)可用于在单一近红外(NIR)激光照射便可实现协同PTT/PDT。但是,这些制剂大多因单线态氧(1O2)量子产率低而影响治疗效果。
浙江大学李方园教授等在本文中研究了一种新型D–A–D CSM(IID-ThTPA),该分子以异靛蓝(IID)为受体,以三苯胺(TPA)为给体。与现有的基于DPP的纳米粒子相比,IID-ThTPA NPs具有较高的光热转换效率(35.4%),并且由于单重态-三重态能隙较窄而大大提高了1O2量子产率(84.0%),可以在671 nm激光照射下发挥PTT/PDT协同治疗。同时,良好的稳定性和生物相容性使其在光声成像(PAI)的指导下,在体内发挥PTT/PDT协同消融肿瘤的作用。
I IID‑ThTPA NPs的合成与表征
IID-ThTPA是通过IID-Br和Sn-ThTPA的Stille偶联反应合成的。两个噻吩(Th)环插入IID-ThTPA骨架中,充当π桥促进分子内电荷转移,从而在NIR中具有高消光系数。两个己基连接到IID段,以确保IID-ThTPA的有机溶剂可加工性。为了使IID-ThTPA具备水溶性以进一步用于生物医学领域,我们使用Pluronic F127作为基质,通过纳米沉淀法制备了基于IID-ThTPA纳米粒子(IID-ThTPA NPs),IID-ThTPA NPs在671 nm具有18.2 L g-1 cm-1的高质量消光系数,显示出良好的吸光能力(图1a-c)。此外,由于聚集引起的猝灭(ACQ)效应,水中IID-ThTPA NPs的荧光强度降低到THF中IID-ThTPA的37%(图1d),有助于IID-ThTPA NPs的光热转化。IID-ThTPA NPs的形貌通过透射电子显微镜(TEM)表征为大小约为60 nm的分散球形纳米颗粒,直径约为120 nm(图1e)。IID-ThTPANPs在各种介质中储存一周后,尺寸没有明显变化(图1f),表明它们在生物医学应用中具有出色的胶体稳定性。
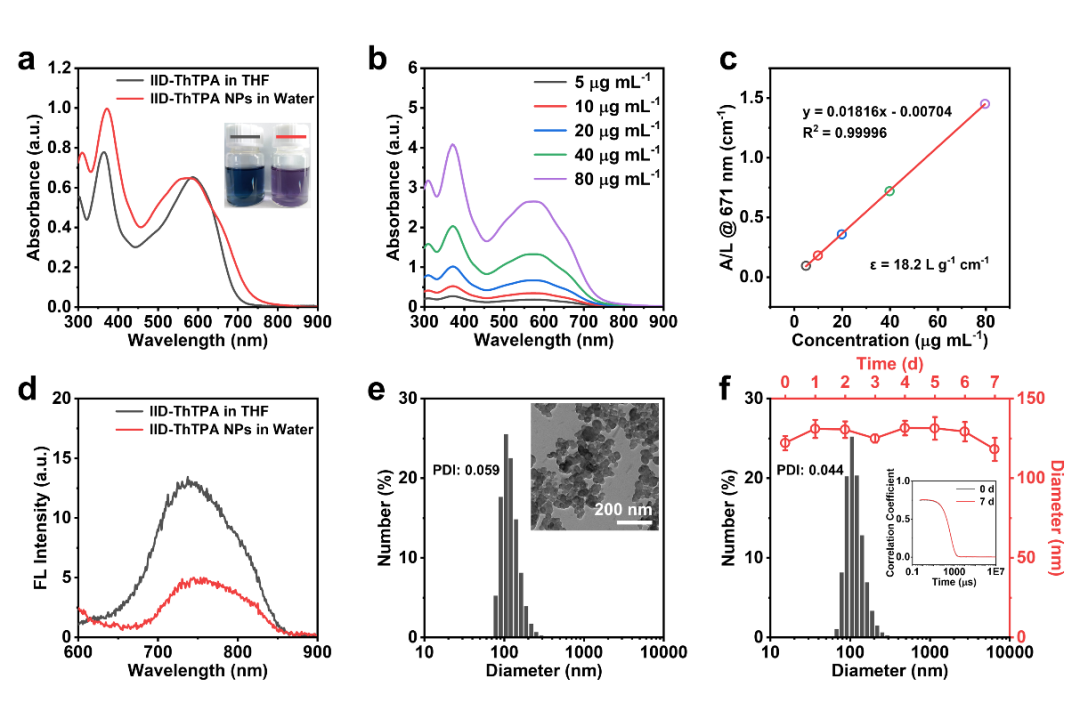
图1. IID‑ThTPA NPs的表征:(a) UV-Vis-NIR吸收光谱;(b) 不同浓度IID-ThTPA NPs的吸收光谱;(c) IID-ThTPA NP在671 nm处的质量消光系数;(d) IID-ThTPA和IID-ThTPA NPs的荧光光谱;(e) IID-ThTPA NPs的形貌和粒径表征;(f) IID-ThTPA NPs的稳定性表征。
II IID‑ThTPA NPs的光热性能
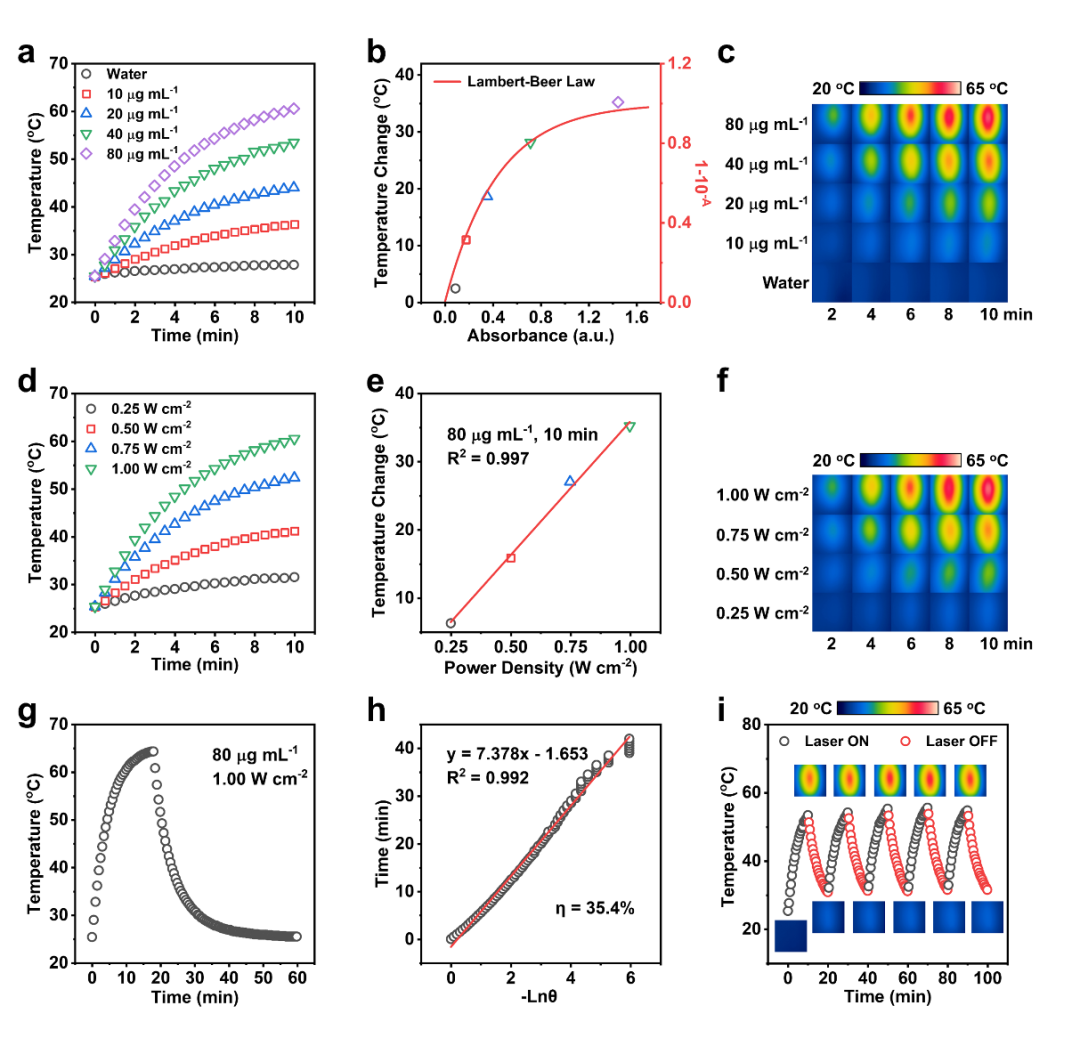
在激光照射下(671 nm,1.00 W cm-2,10 min),不同浓度的IID-ThTPA NPs均显示出温度升高(图2a)。根据Lambert-Beer定律拟合IID-ThTPA NPs的温度变化与不同浓度下的吸光度的曲线,表明较好的光热转换效率(图2b-c)。不同浓度IID-ThTPA NPs在激光照射过程中的温度升高也可以通过红外热像仪观察到(图2c)。较高的激光功率会导致温度升高更快(图2d),并且IID-ThTPA NPs的温度变化与激光功率的相关系数R2=0.997(图2e)。红外热像仪也验证了不同激光功率下的光热效应(图2f)。为了计算光热转换效率,对IID-ThTPA NPs溶液(80 μg mL-1)进行激光照射(671 nm,1.00 W cm-2),达到温度平稳状态后关闭激光自然冷却到室温(图2g)。通过绘制IID-ThTPA NPs的冷却时间与驱动力温度的负自然对数的线性时间数据,可以确定系统的时间常数为7.378分钟(图2h),根据Roper等报道的方法计算出光热转化效率为35.4%。IID-ThTPA NPs的高光热转换性能即使在五个激光开/关周期后仍可保持,这表明其具有出色的光热稳定性(图2i)。结果表明了IID-ThTPA NPs可作为高光稳定性的高效PTT材料。
图2. IID-ThTPA NPs的光热性能:(a) 不同浓度IID-ThTPA NPs的光热曲线;(b) IID-ThTPA NPs的温度变化与不同浓度下的吸光度的关系;(c) 不同浓度IID-ThTPA NPs时间-温度的红外热像图;(d) 不同激光功率下的IID-ThTPA NPs的光热曲线;(e) IID-ThTPA NPs的温度变化与激光功率相关性;(f) 不同功率密度下IID-ThTPA NPs(80 μg/mL)时间-温度的红外热像图;(g-h) 光热转换效率计算;(i) IID-ThTPA NPs(40 μg/mL)在(671 nm,1.00 W cm-2)条件下五个激光开/关循环的光热曲线。
III IID‑ThTPA NPs的光动力性能
我们利用TEMP作为单线态氧指示剂和BMPO作为羟基自由基和超氧阴离子指示剂确定了IID-ThTPA NPs产生的ROS类型为单线态氧。根据IID-ThTPANPs和亚甲基蓝(MB)在激光照射下DPBF的降解动力学曲线计算其单线态氧量子产率为84.0%(图3a-d)。IID-ThTPA NPs和MB在激光照射下的降解曲线也证明了IID-ThTPA NPs对MB的光稳定性(图3e)。为了更深入地了解IID-ThTPA NPs超高的单重态氧量子产率,我们对IID-ThTPANPs进行了密度泛函理论(density functional theory, DFT)计算,以研究其优化的几何构象,前线轨道分布,S1和T1能级。以普遍使用的DPP受体的共轭小分子DPP-TPA(ΦΔ = 33.6%,DPP-TPA NPs)作为对照。IID-ThTPA和DPP-TPA均具有刚性且共平面的分子骨架,IID-ThTPA和DPP-TPA的最高占据分子轨道(HOMO)均沿整个共轭主链分布,而最低未占据分子轨道(LUMO)主要位于IID-ThTPA和DPP-TPA的受体上。然而,更大的HOMO-LUMO分离和IID-ThTPA的较为扭曲的构象导致0.65 eV的窄ΔEST,几乎是DPP-TPA(1.01 eV)的一半。IID-ThTPA的ΔEST较窄,可以促进ISC,从而比DPP-TPANPs产生更多的单线态氧(图3f)。
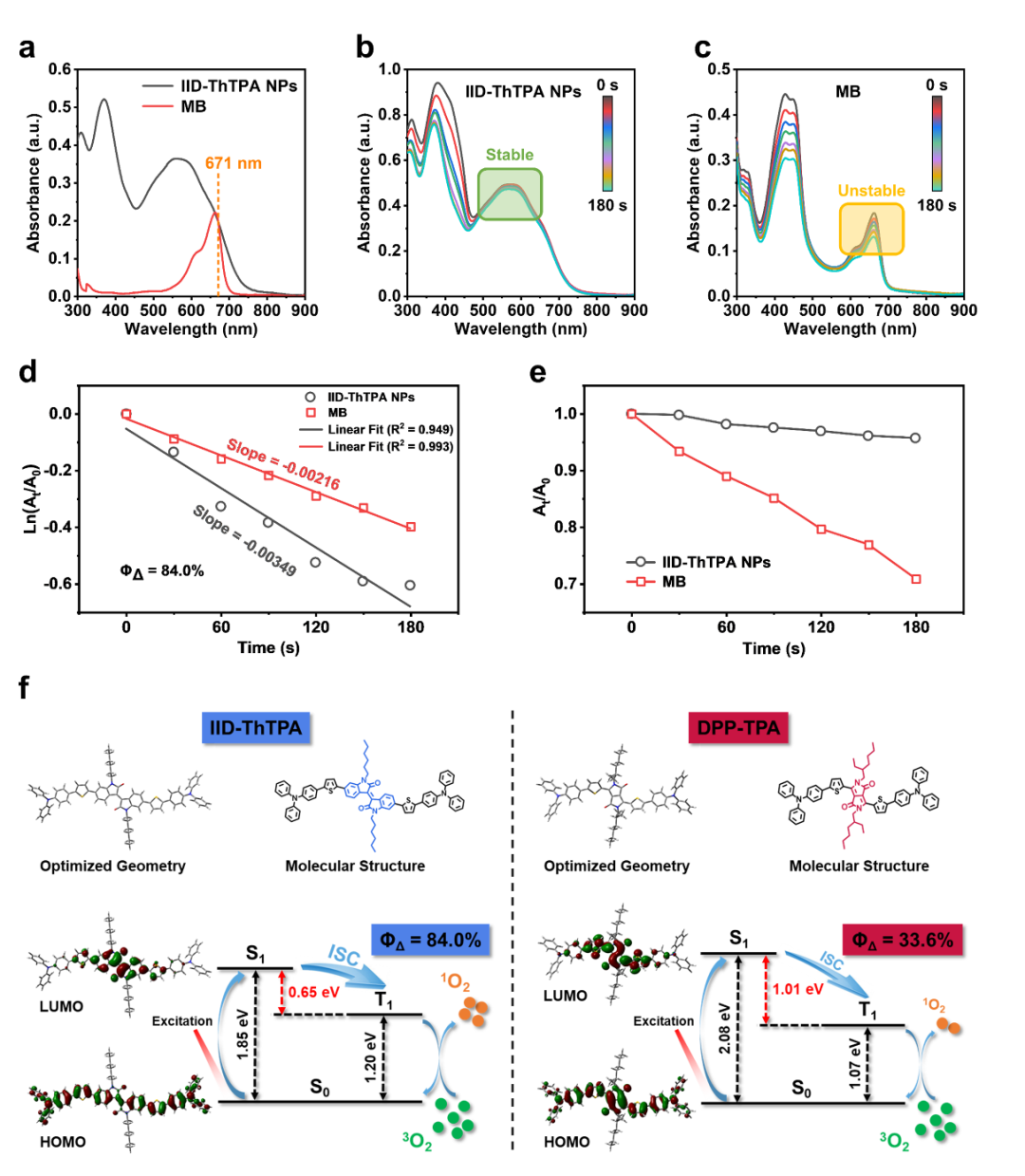
图3. IID-ThTPANPs的光动力性能:(a) IID-ThTPA NPs和MB在水中的吸收光谱;(b)激光照射下IID-ThTPA NPs对DPBF的降解曲线;(c) 激光照射下MB对DPBF的降解曲线;(d) 激光照射下IID-ThTPA NPs和MB对DPBF降解动力学计算;(e) IID-ThTPA NPs和MB在激光照射下的降解情况;(f) DFT理论计算IID-ThTPA和DPP-TPA的几何构象、HOMOs、LUMOs、S1和T1能级。
IV IID‑ThTPA NPs的体外PTT/PDT协同治疗
共聚焦激光扫描显微镜显示了IID-ThTPA-RITC NPs随时间变化的细胞摄取能力(图4a,b)。无激光照射时,IID-ThTPA NP即使在80 μg mL-1的高浓度下,对肿瘤4T1细胞也不造成明显毒性,单纯PTT治疗时的IC50约为73.2 μg mL-1,单纯PDT治疗时的IC50约为46.6μg mL-1,PTT和PDT的协同治疗时的IC50约为30.6μg mL-1(图4c),表明IID-ThTPA NPs可以同时实现PTT和PDT治疗,而且PDT效果要强于PTT。此外,在激光照射下,用IID-ThTPA NPs处理过的细胞有大量的ROS生成(图4d,e)。
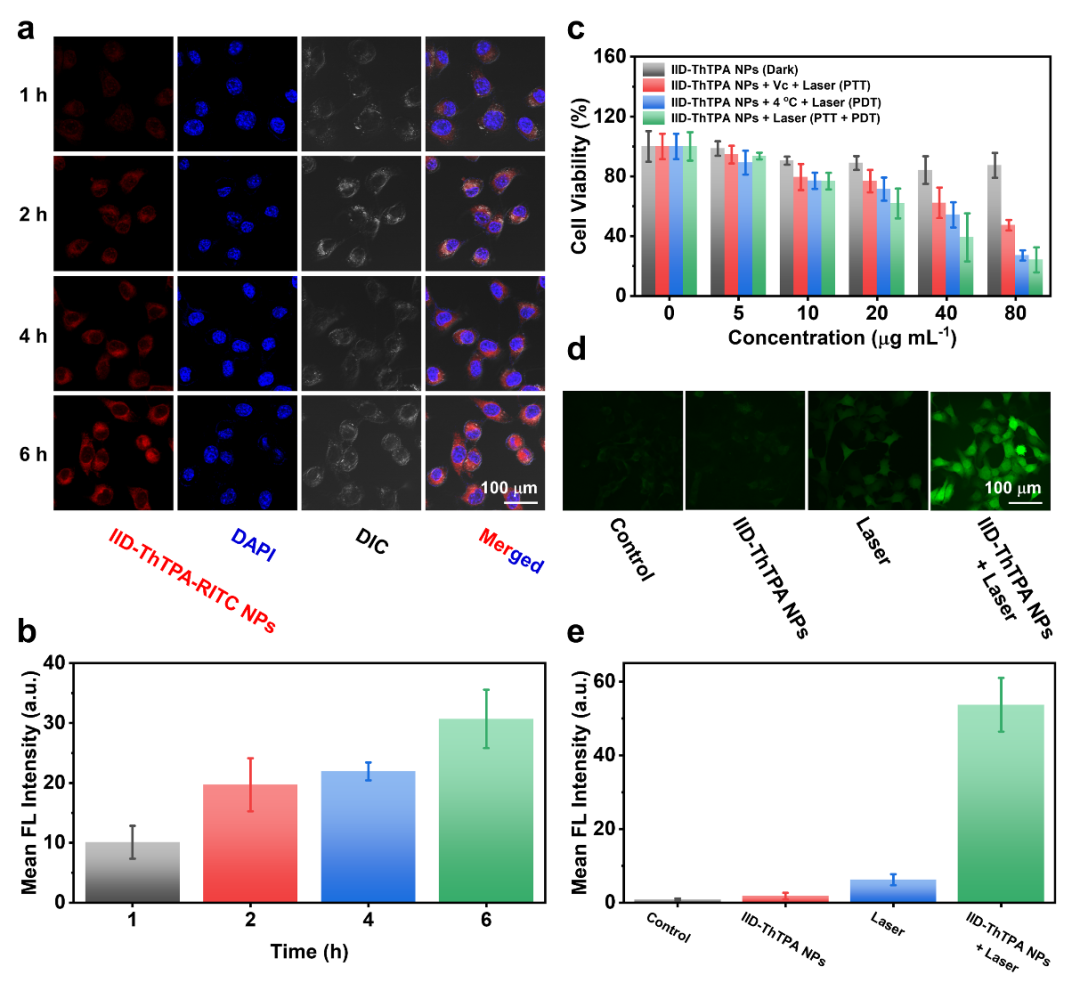
图4. IID‑ThTPA NPs体外PTT/PDT协同治疗:(a-b) IID-ThTPA-RITC NPs细胞摄取;(c) PTT、PDT和PTT/PDT分别处理时的细胞毒性;(d-e) 细胞内ROS水平检测。
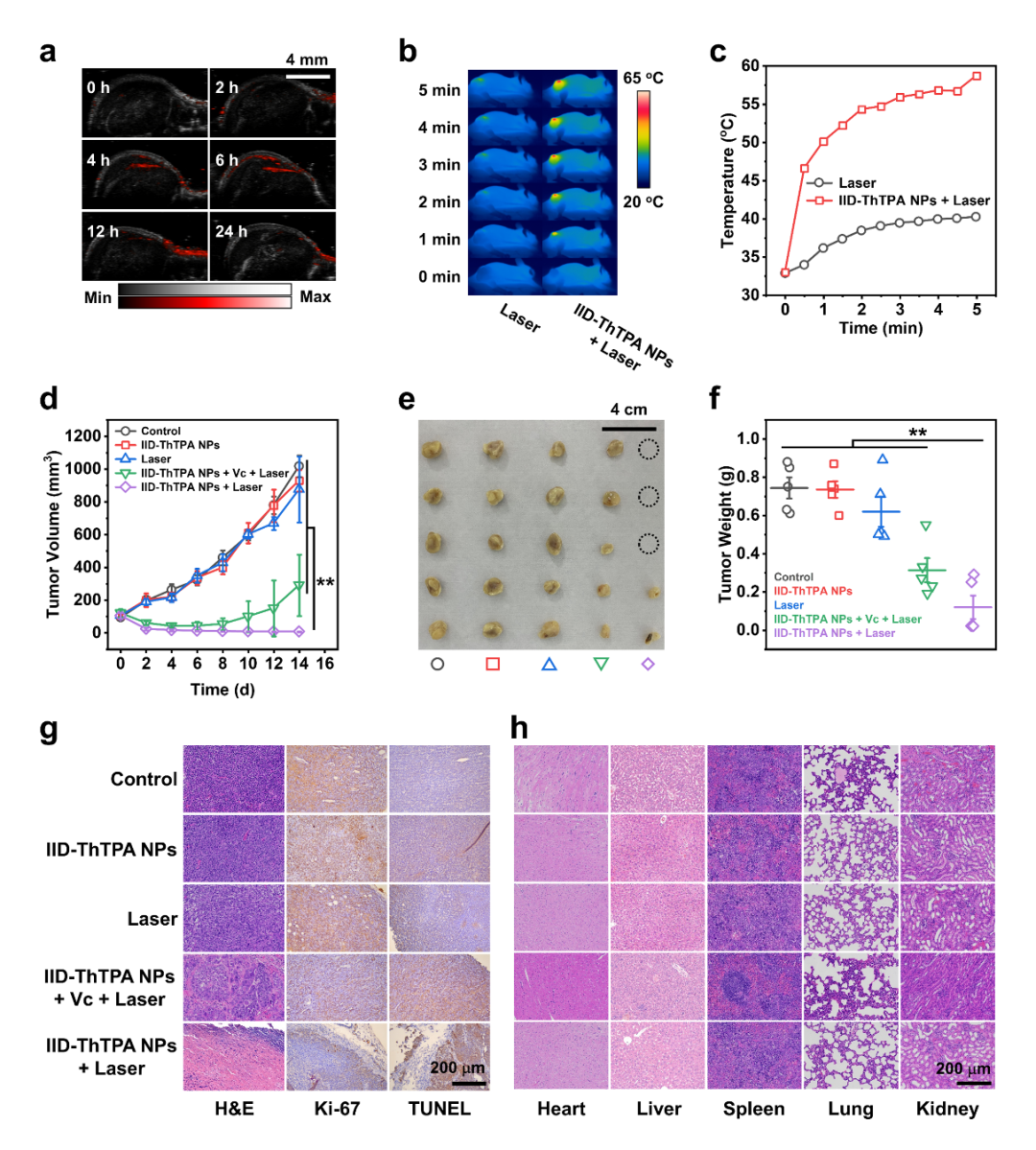
光声信号源自光热诱导的介质膨胀,与IID-ThTPA NPs的光吸收直接相关。将IID-ThTPA NPs静脉注入原位4T1荷瘤小鼠后,肿瘤部位的PA信号强度随时间逐渐增加,并在注射后6小时达到最大(图5a)。为了评估IID-ThTPA NPs的体内治疗效果,将4T1荷瘤小鼠随机分为Control、IID-ThTPA NPs、Laser、PTT、PTT/PDT五组。在激光照射下,Laser组小鼠的肿瘤部位温度仅达到40.2°C,而IID-ThTPA NPs+激光组的小鼠肿瘤部位温度迅速升高至58.7°C,足以消融肿瘤(图5b,c)。通过监测肿瘤治疗曲线,PTT/PDT组的小鼠肿瘤在治疗期间不断缩小,在治疗结束时几近消失(图5d-f),并且H&E,Ki-67和TUNEL等组织病理切片染色也验证了体内PTT/PDT的治疗效果(图5g)。治疗后不同组小鼠主要器官的H&E染色(图5h),血常规和血生化参数分析均表明IID-ThTPA NPs具有良好的系统安全性。
图5. 光声成像指导下的体内PTT/PDT协同治疗:(a) 尾静脉注射后肿瘤部位在680 nm处的PA图像;(b) Laser组和IID-ThTPA NPs+Laser组小鼠在671 nm、1.00 W cm-2激光照射下的红外热像图;(c) Laser组和IID-ThTPA NPs+Laser组小鼠在671 nm、1.00 W cm-2激光照射下肿瘤温度升高曲线;(d) 小鼠肿瘤生长曲线;(e) 小鼠肿瘤图片;(f) 小鼠肿瘤质量;(g) 小鼠肿瘤H&E、Ki-67、TUNEL病理切片染色;(h) 不同处理方式后小鼠主要脏器的H&E染色。
 李方园
李方园
本文通讯作者
浙江大学 副教授
主要从事分子影像探针和可视化纳米药物的研究。
▍主要研究成果
迄今在Advanced Materials,Nature Nanotechnology, Nano Letters,ACS Central Science, Journal of the American Chemical Society, ACS Nano 等国际著名刊物上发表论文50余篇,申请专利17项,授权专利9项。
https://person.zju.edu.cn/lfy#0

Nano-Micro Letters《纳微快报》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2019 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前15%)。2019 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
Tel:021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 一种新型共轭小分子纳米粒子:增强光热/光动力协同治疗效果



 李方园
李方园
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用