Drug Nanorod‑Mediated Intracellular Delivery of microRNA‑101 for Self‑sensitization via Autophagy Inhibition
XiaofeiXin1, Xiaoqing Du1, QingqingXiao1, Helena S. Azevedo2, Wei He1, *, Lifang Yin1, *
Nano-Micro Lett.(2019)11:82
https://doi.org/10.1007/s40820-019-0310-0
研究背景
自噬是引发PTX在乳腺癌治疗中产生耐药性的重要因素,将两种或两种以上的药物联用是目前解决肿瘤耐药性最为有效的方法之一。但是,传统的自噬小分子抑制剂缺乏靶向性,较大的给药剂量同时会引发系统毒性;与之相比,基因药物miRNA-101能靶向作用于自噬通路中的STMN1、RAB5A和ATG4D基因,分别抑制自噬过程中囊泡的成核、伸长与微管动力学,进而促发肿瘤细胞对化疗药物的敏感性,提高抗肿瘤药物的疗效。
2 为化疗小分子药物诱导的自噬,引发肿瘤耐药性的问题,提供全新的治疗策略。
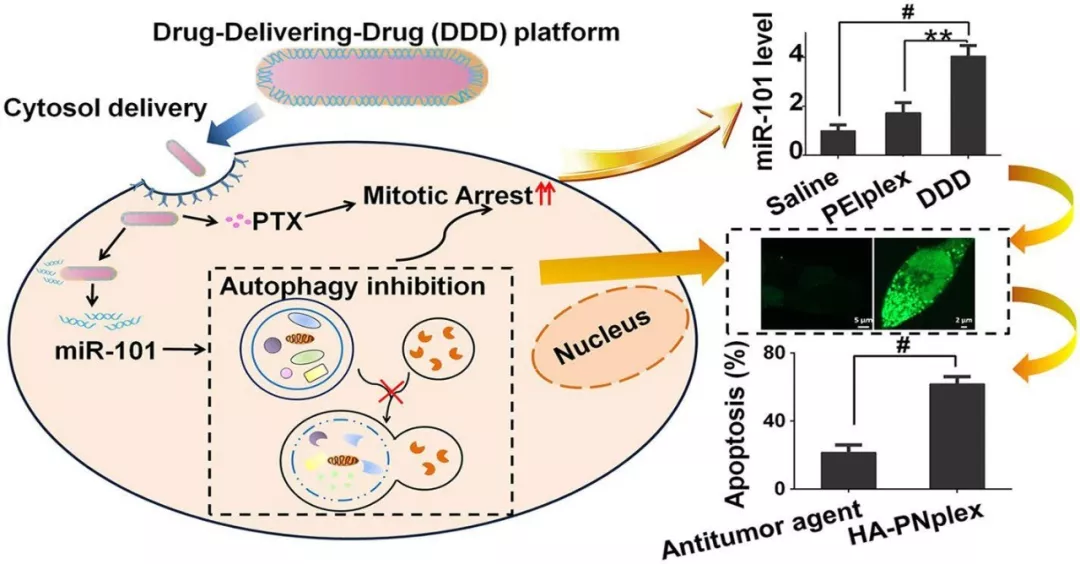
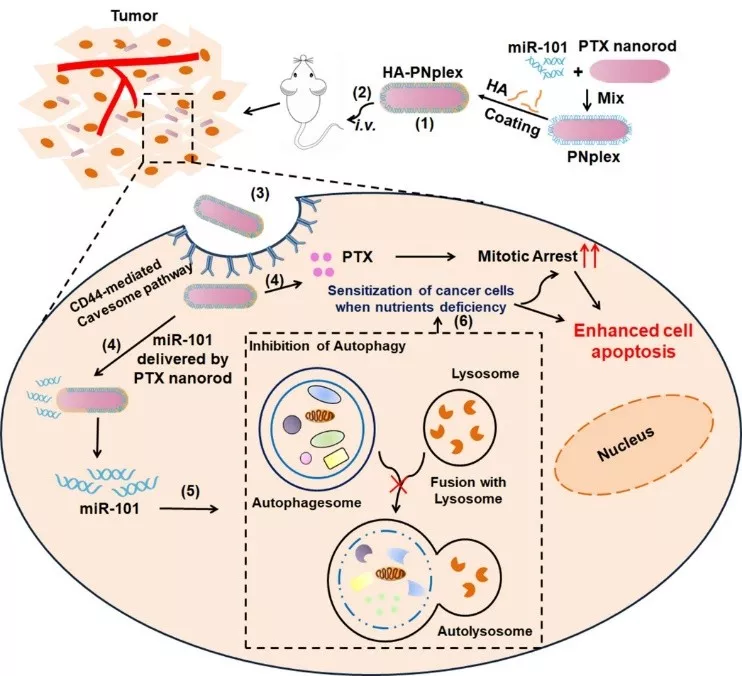
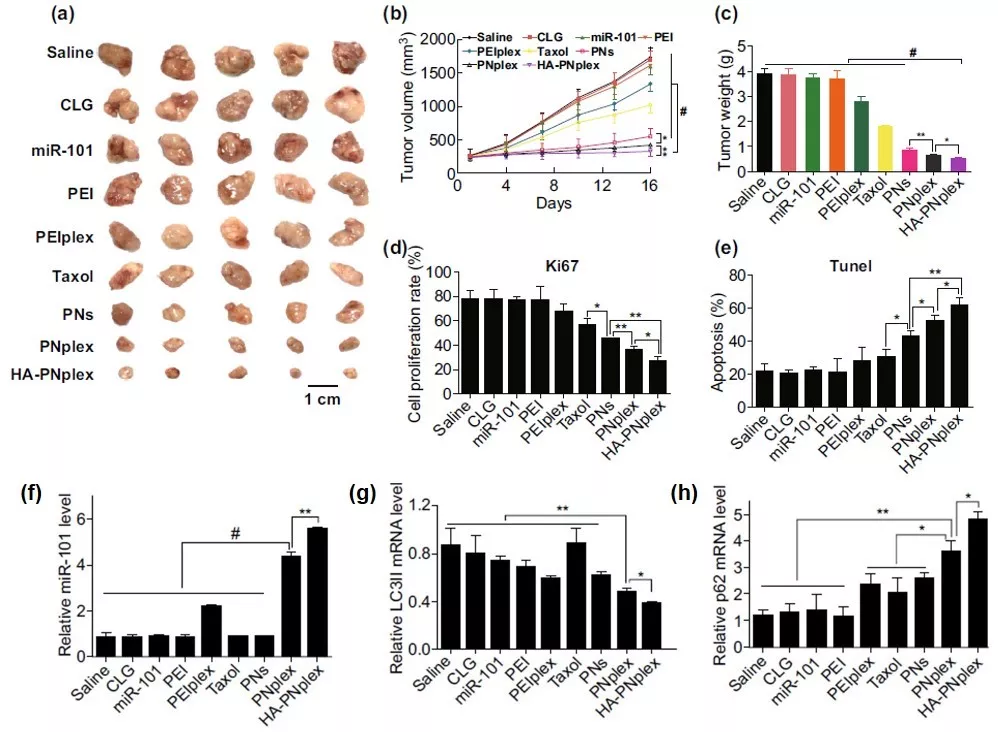
自噬与肿瘤的发生与发展密切相关,肿瘤化疗过程中会诱导自噬的产生,进而引发肿瘤耐药性的形成和肿瘤细胞的转移。中国药科大学何伟副教授&尹莉芳教授等采用“药物-递送-药物”体系(DDD)递送化疗药物紫杉醇(PTX)和基因药物miR-101。
DDD的粒径为180 nm,总载药量为66%,能将miR-101高效地递送至肿瘤细胞,通过miR-101显著抑制肿瘤细胞内的自噬作用。
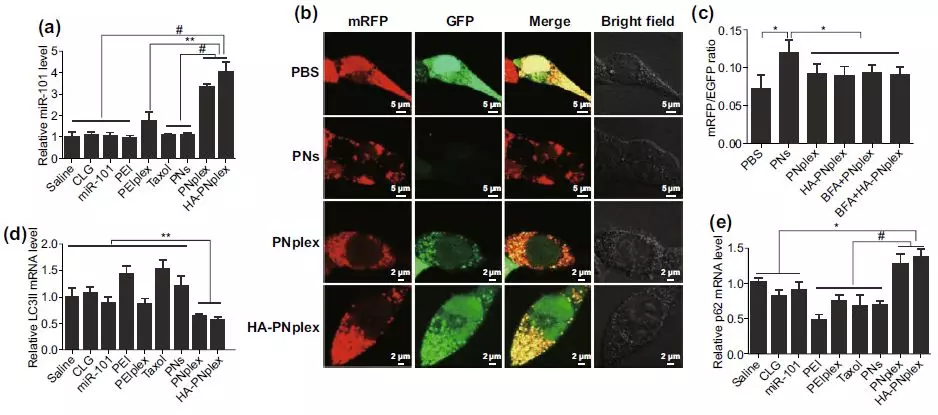
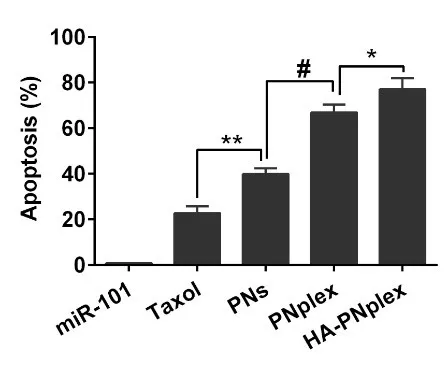
主要表现为微管结合蛋白LC3II的减少与自噬降解底物p62的蓄积,使其对化疗药物敏感,与单化疗药物治疗相比,凋亡率增加3倍,为克服肿瘤细胞耐药性提供了新的治疗策略。
DDD系统能将miR-101高效递送至MCF-7细胞中,与传统的递送系统相比,转染效率提高了3倍;化疗药物PTX会诱发自噬的产生,但miR-101的递送显著抑制肿瘤细胞中自噬的发生,主要表现为微管结合蛋白LC3II的减少与自噬降解底物p62的蓄积。

(本文通讯作者)
▍主要研究成果
Email: lifangyin_@163.com

(本文通讯作者)
▍主要研究成果
主持多项国家自然科学基金、科技部重大专项、省自然基金、教育部新教师基金等;以第一或通讯作者身份在ACS Nano, Advanced Science等杂志发表SCI论文50余篇。
编辑:《纳微快报》编辑部
E-mail:editorial_office@nmletters.org
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 肿瘤化疗耐药性的”克星”:基因与小分子联动治疗新策略
 Nano-Micro Letters
Nano-Micro Letters NML文章集锦 | 肿瘤靶向治疗
NML文章集锦 | 肿瘤靶向治疗 苏州大学刘庄教授:肿瘤微环境多重调控与化疗/免疫联合治疗新策略-碳酸钙基纳米载体
苏州大学刘庄教授:肿瘤微环境多重调控与化疗/免疫联合治疗新策略-碳酸钙基纳米载体 利用多层细胞培养模型揭示纳米颗粒在实体肿瘤中的吸收和分布
利用多层细胞培养模型揭示纳米颗粒在实体肿瘤中的吸收和分布 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人