Nano-Micro Lett. (2019) 11: 74
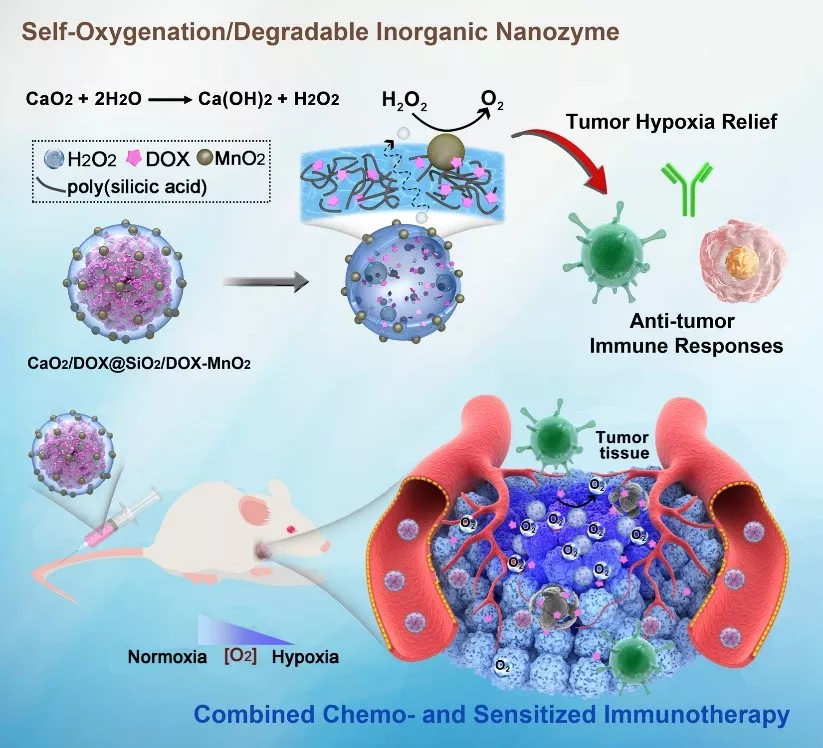
自产氧纳米酶为核壳结构,内核是CaO2纳米粒子,外壳是包埋有阿霉素(DOX)的二氧化硅,并吸附有MnO2纳米簇。CaO2水解产生的过氧化氢,能够穿过二氧化硅外壳,并在MnO2的催化下产生氧气。其中,CaO2的水解在酸性条件下更快,因此可以减少血液循环过程中的氧气提前释放,实现肿瘤微环境特异性产氧。
利用钙离子与DOX间的相互作用,可以在CaO2中高效掺杂DOX。而在SiO2壳中包埋DOX,可以实现壳的自降解,降低纳米酶的生物毒性。
以B16F10黑色素瘤皮下荷瘤小鼠为模型,考察了纳米酶的缓解瘤内乏氧能力以及对免疫治疗的增强效果。结果显示瘤内乏氧得到有效缓解。同时,对hypoxia-adenosinergic信号通路中集中关键组分的分析显示该通路被明显抑制。
利用CTLA-4抗体进行的小鼠活体抑瘤实验中,取得了良好的抗肿瘤效果,延长了小鼠生存期。进一步研究显示,由于缓解了瘤内乏氧,Treg细胞数量减少且CD8+T细胞数量增多且在肿瘤组织中的浸润增强。这些结果在激活免疫反应方面能产生协同效应,也体现了纳米酶在设计上的多效性。
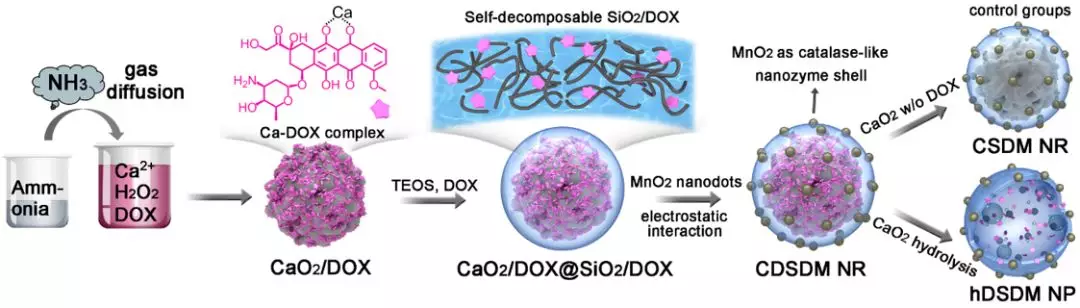
如图1所示,首先利用气体扩散法制备粒径均一的CaO2纳米粒子;利用钙离子与DOX间的相互作用,可高效上载DOX。随后在外部包裹掺杂有DOX的SiO2外壳,并吸附二氧化锰纳米簇。所得纳米酶能够自降解(在肿瘤微环境中降解更快),具有良好的生物相容性。对照组包括内核无DOX的纳米粒子,以及无CaO2内核的壳状纳米粒子。
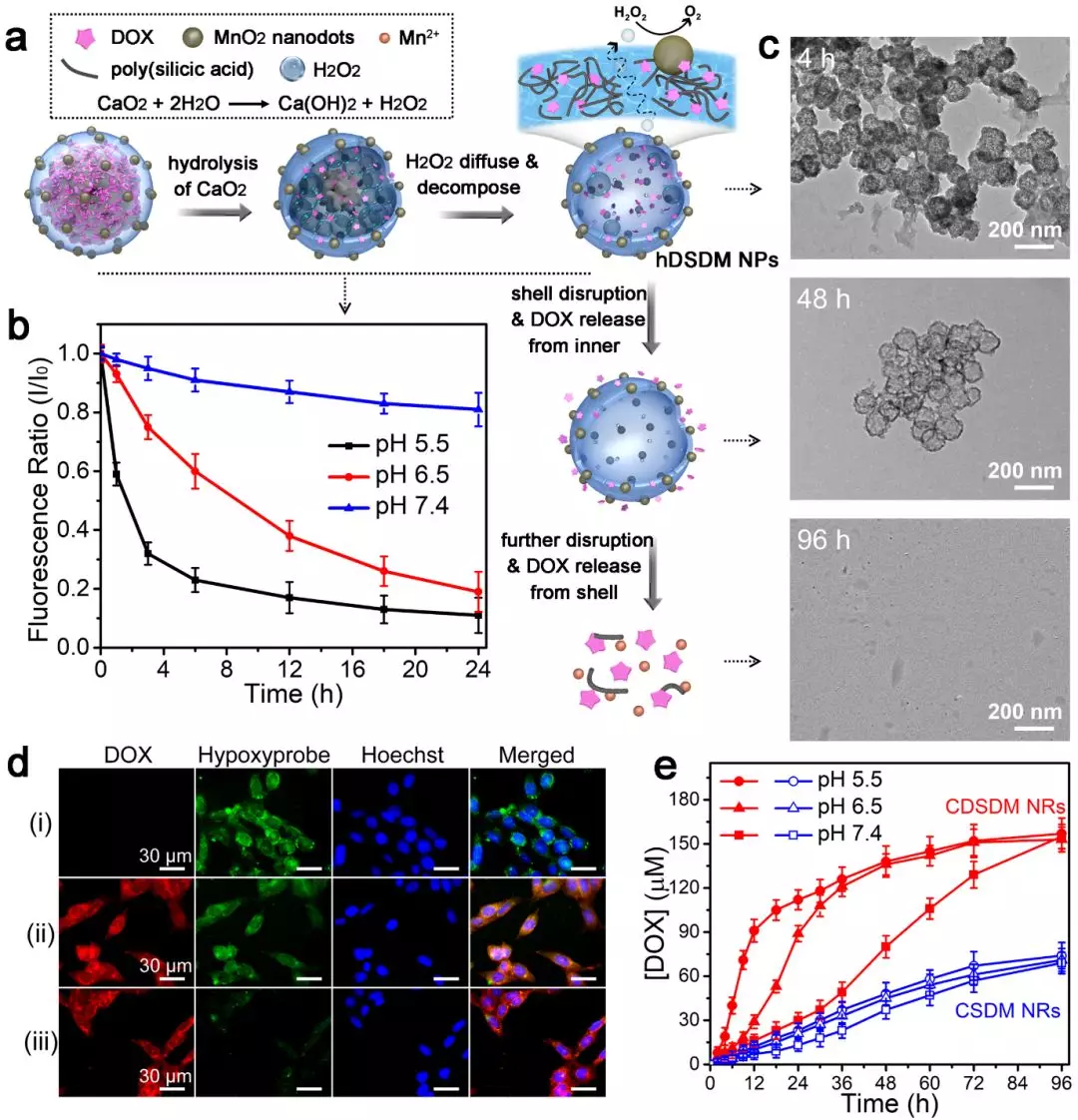
▍纳米酶的高效产氧及自降解
如图2,纳米酶的产氧过程为,CaO2水解产生过氧化氢,过氧化氢穿过二氧化硅外壳后,在MnO2的存在下产生氧气。CaO2在酸性条件下水解更快,因此可以特异性地在肿瘤微环境释放氧气。同时,二氧化硅外壳中掺杂有DOX,随着DOX的释放,外壳能够逐步崩解。DOX本身是一种广谱化疗药物,因而能够实现化疗-免疫联合治疗。对于乏氧培养的肿瘤细胞,纳米酶能够有效缓解乏氧。
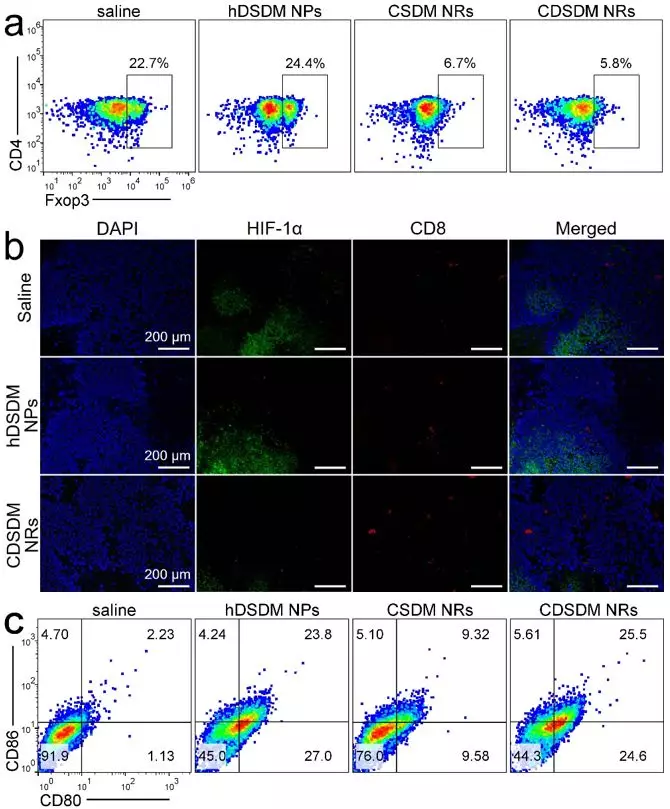
小鼠活体实验证实,纳米酶能够有效增强CTLA-4抗体对B16F10黑色素瘤的免疫治疗效果。如图3,其原因包括多个方面,包括缓解乏氧后肿瘤微环境中的调节性T细胞数量减少,而CD8+T细胞的瘤内浸润增强。同时,纳米酶中的DOX除了作为化疗药物外,其杀伤的肿瘤细胞还可以作为原位抗原,诱导树突状细胞成熟,刺激肿瘤特异性免疫应答。
作者简介

邓大伟
(本文通讯作者)
中国药科大学教授 博士生导师
江苏省杰出青年基金获得者,教育部新世纪优秀人才项目获得者,江苏省 “333工程”第三层次培养对象,获教育部自然科学二等奖(2016年度,3/7)。任中国药科大学工学院生物医学工程系主任,科技部纳米专项(青年)会评专家(召集人),江苏省食药总局项目会评专家组长,江苏省博士硕士学位授权-评议专家(2017年),中国光学学会生物医学工程专业委员会青年委员,医疗器械与药学装备专业委员会青年常委,江苏省生物医学工程学会纳米医药专业委员会和生物光子专业委员会委员等。发表SCI科研论文约50篇(一作和通讯作者),包括J. Am. Chem. Soc.,Chem. Mater.,Biomaterials等,并申请1项国际PCT。
Email: dengdawei@cpu.edu.cn
肿瘤治疗 · 往期回顾 👇
E-mail:editorial_office@nmletters.org
Tel:86-21-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 增强抗肿瘤免疫!自产氧/自降解无机纳米酶
 Nano-Micro Letters
Nano-Micro Letters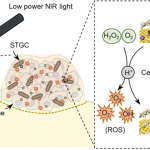 NML文章集锦 | 纳米酶
NML文章集锦 | 纳米酶 NTU综述:纳米酶—癌症诊断和治疗的多功能平台
NTU综述:纳米酶—癌症诊断和治疗的多功能平台 哈佛大学陶伟等:癌症诊疗的光子纳米药物-超低温剥离的2D锡纳米片
哈佛大学陶伟等:癌症诊疗的光子纳米药物-超低温剥离的2D锡纳米片 高活性纳米酶:原子尺度下设计和调控MOFs中的金属位点
高活性纳米酶:原子尺度下设计和调控MOFs中的金属位点