研究背景
可穿戴超声设备在治疗应用中具有变革性意义,能够实现对深层组织的无创、持续和精准治疗。该技术利用柔性材料(如压电复合材料、可降解聚合物)和可贴合设计,实现与动态解剖表面的稳定集成。核心创新包括空化增强药物透皮输送、机械与电刺激加速组织再生,以及聚焦声波实现精准神经调控。最新进展还包括无线操作、实时监测和闭环治疗,依托高效换能器与人工智能自适应控制。尽管取得进展,材料耐久性、临床验证及规模化制造仍是挑战。未来发展将侧重纳米材料、3D打印结构及多模态传感的整合,以推动个性化医疗,在慢性病管理、术后康复及神经康复中展现巨大潜力。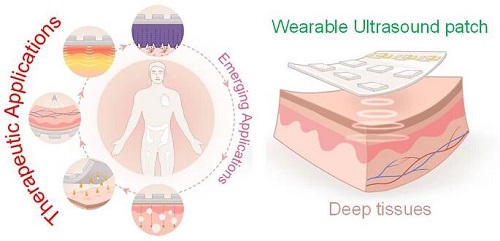
Wearable Ultrasound Devices for Therapeutic Applications
Sicheng Chen, Qunle Ouyang, Xuanbo Miao, Feng Zhang, Zehua Chen, Xiaoyan Qian, Jinwei Xie, Zheng Yan*
Nano-Micro Letters (2026)18: 45
https://doi.org/10.1007/s40820-025-01890-2
本文亮点
1. 柔性超声设备通过可贴合的设计实现深层组织治疗,克服了刚性系统在持续监测和治疗方面的限制。
2. 空化增强的药物输送与神经调控展示了对慢性疾病和神经疾病的无创、靶向干预。
3. 无线化、人工智能集成的平台为家庭和临床环境下的个性化、自适应治疗开辟了道路。
内容简介
随着医疗需求快速增长、人口老龄化以及持续健康监测的必要性日益增加,全球医疗系统面临效率低、可及性差和基础设施不足等挑战。大多数疾病源于久坐、营养不良及不健康生活方式,因此对生命体征的连续监测和实时分析对于疾病预防和健康管理至关重要。然而,传统医疗依赖周期性就诊和笨重设备,存在延迟和不便。可穿戴生物设备因其便携性、可穿戴性、远程监控及实时性,成为传统医疗设备的有力补充,可持续监测血压、脉搏、温度、应变、压力、电生理及生化信号。
目前可穿戴技术主要依赖光学、电学或化学手段,穿透深度有限,难以覆盖肌肉层或内脏等深层组织。超声技术具有穿透深层组织、实时成像且无电离辐射的优势,是深层诊断与治疗的理想方案。传统超声设备体积大、刚性高、依赖操作人员,不适合长期或连续监测。近年来,柔性可穿戴超声系统通过适应性贴合人体表面,实现稳定、高分辨率成像、长期生理监测及治疗,提高患者舒适度和依从性。
这些设备在精准药物递送、组织再生及神经调控等方面展现巨大潜力,可通过空化效应实现乳腺、关节和内脏等部位的靶向治疗,并提供非侵入式神经刺激。美国密苏里大学闫政等人在本篇综述中分析了结合新型材料、柔性结构及多模态传感的柔性可穿戴超声的发展现状,以及代表的未来个性化治疗的重要发展方向。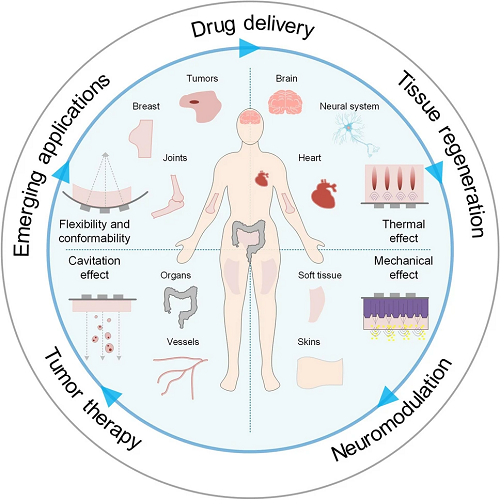
图1. 超声技术在多种治疗领域的应用概述,包括药物递送、组织再生、神经调控及肿瘤治疗。可穿戴生物设备展现出针对特定器官的创新应用潜力。
图文导读
I 超声治疗基础
超声是一种通过介质传播的高频声波,以机械振动形式存在,通常通过压电晶体产生和检测,利用逆压电效应将电能转化为机械波。由于其频率高于人耳可听范围(通常为数百 kHz 到数 MHz),超声能够在穿透组织的同时保持高空间分辨率,广泛应用于医学成像和治疗。连续波超声可连续发射声波,适用于基于多普勒效应的血流测量,但无法确定成像深度;脉冲波超声通过短能量脉冲与回波接收交替,实现深度计算和高分辨率成像,可用于精确治疗。超声在组织中的衰减随频率升高而增加,其衰减系数与频率呈幂律关系(α ∝ fⁿ,n≈1–2)。脉冲参数如周期数、脉冲持续时间及重复周期直接影响超声的生物学效应。可穿戴超声设备通过精确控制热效应、空化动力学和机械应力,实现血–脑屏障开放、肿瘤热疗剂量实时监测以及个性化康复方案等治疗功能。其便携、可连续操作、可闭环反馈的特性克服了传统超声在慢性疾病、长期干预和复杂组织治疗中的局限性,展示了广阔的临床应用前景。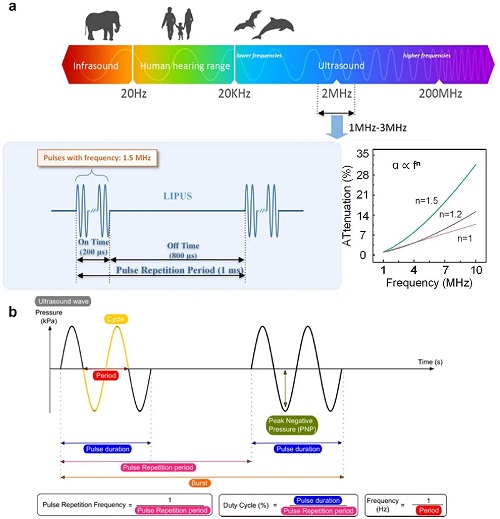
图2. 超声波频率范围及其衰减系数随频率增加而升高的关系。
1.1 超声原理
超声治疗依赖于通过生物组织可控地生成和传播机械波。这些波通常由压电换能器产生,通过铅锆钛酸盐或先进弛豫铁电材料将交变电信号转化为高频机械振动,从而在组织中形成声压波,软组织中的声速约为1540 m/s。超声波在组织中的传播可用声波方程描述,其中声压、组织特定声速及频率相关的衰减系数共同决定治疗效果。频率是关键参数:低频可穿透深层组织但分辨率较低,高频可提供高分辨率但穿透浅;强度描述单位面积的声能量,需控制在安全范围以避免损伤邻近组织。脉冲参数(重复频率和占空比)影响总能量剂量,调控热效应与非热效应的平衡,同时确保安全性。聚焦控制则实现声能在目标区域的精确定位。通过合理调节频率、强度、脉冲参数及聚焦,临床和研究人员可优化超声治疗,实现诊疗应用中安全与疗效的最佳平衡。
1.2 超声治疗的作用机制
超声治疗的主要作用机制包括热效应、空化和机械应力。当声波在组织中传播时,一部分能量被吸收并转化为热量,使局部温度升高,高强度聚焦超声(HIFU)可利用热效应直接消融肿瘤,而较低温度则可增强药物输送或调控肿瘤微环境。同时,空化现象通过微泡的形成、振荡和塌缩产生微流和冲击力,可用于经皮药物渗透、肿瘤消融或局部血–脑屏障开放。超声的机械波作用还能通过辐射力或泡振动施加应力,促进组织再生、血管生成或神经调控。
可穿戴超声技术将这些机制转化为临床应用:柔性超声贴片结合压电换能器,实现高效能量传递和可控治疗深度。贴片可弯曲贴合皮肤,改善能量耦合和患者舒适度,同时通过相控阵控制焦点,实现肿瘤破坏或组织修复。低频(2 MHz)柔性超声可穿透颅骨达60–80 mm,比传统刚性探头信噪比提高约40%。可穿戴超声通过热、空化和机械效应的协同作用,为个性化、微创治疗在肿瘤、再生医学和神经调控等领域提供了重要支持。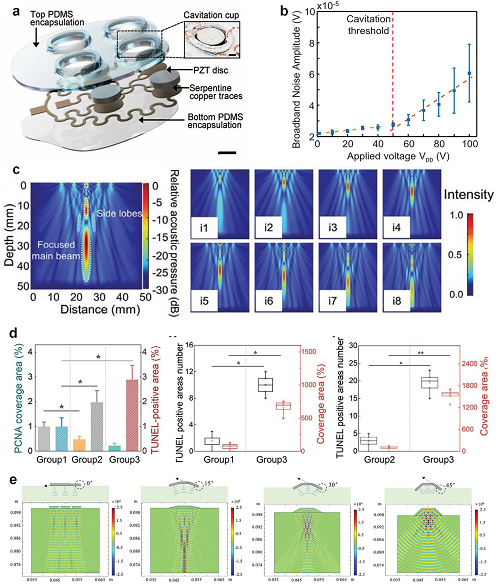
图3. cUSP二维阵列各层结构的剖解示意图,插图显示PZT-D元件与皮肤之间形成的液腔。
II 可穿戴超声设备的发展演变
几十年来,超声以其低成本、无创性、安全性和多功能性成为临床核心工具,但传统刚性探头在弯曲或大面积部位成像及长期个性化监测中存在局限。为此,可穿戴柔性超声传感器、换能器和贴片应运而生,依托柔性材料、能量管理和实时控制技术,实现便携、自主及动态监测与精准治疗。
2.1 柔性技术
可穿戴超声设备需要高度机械适应性,以可靠贴合曲面或不规则的人体部位。实现这种适应性不仅依赖柔软可变形的基底,还需采用在反复弯曲和拉伸下依然稳定的结构化导体。当前研究主要集中于两方面:一是使用柔性基底结合蛇形互连以保证电性能稳定,二是开发具有内在柔性的导电聚合物。柔性基底决定了设备的机械性能、服帖性与耐久性,常用材料包括弹性体(如PDMS、Ecoflex)、软聚合物薄膜及超薄金属箔。PDMS因其生物相容性、高弹性(可承受>170%拉伸应变)及良好加工性,被广泛用于嵌入刚性压电单元和环境封装。Ecoflex则因低杨氏模量适合高服帖性设计,而聚氨酯(PU)因柔韧性、耐疲劳性及声学阻尼性能优异,也常用于超声换能器保护层。其他热塑性聚合物如PI、PET、PEN兼具机械强度与柔性,可用于微加工超声换能器阵列。岛桥式设计结合柔性基底和蛇形互连,有效缓解刚性压电元件应变集中,保证信号传输与能量效率。
压电复合材料因增强的机电耦合性能成为可穿戴超声换能器首选,柱状压电单元嵌入环氧基体可抑制横向振动、增强纵向波传导,银-环氧背板优化声学匹配并确保电连接。整体封装于薄硅弹性层内,实现机械保护、声学性能优化和皮肤服帖,适用于动态环境中的连续监测。
可降解压电材料的发展推动了新一代可穿戴超声器件的生物可控降解,如PLLA纳米纤维展示稳定压电性能,用于压力传感器、血脑屏障打开及可植入超声设备。甘氨酸-PCL复合材料结合Mo电极和PLA封装,实现生物降解且免二次手术的植入器件。
导电聚合物(如PEDOT:PSS、PTh、PANi、PPy)提供高导电性与柔韧性,可用于可拉伸的生物兼容电极,增强器件服帖性与可靠性。液态金属亦可实现高拉伸性导电,但因毒性限制,需要开发兼具柔性与生物相容性的替代材料。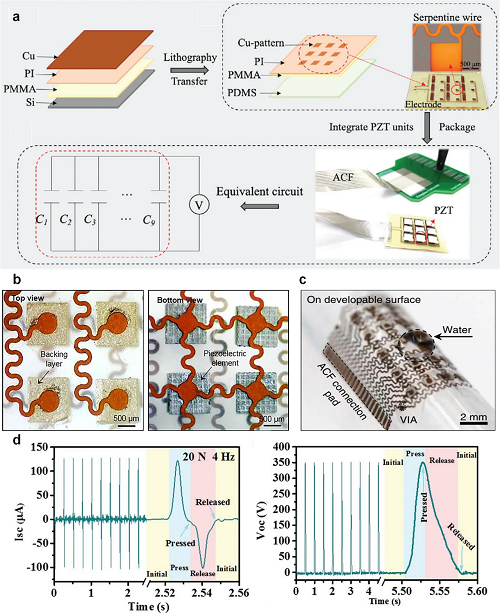
图4. 在硅基底上通过旋涂PMMA、PI和铜层,并结合光刻、蚀刻及转印工艺制备柔性电路,将PZT-4压电超声单元集成其中,并以约200 μm厚水凝胶薄片封装。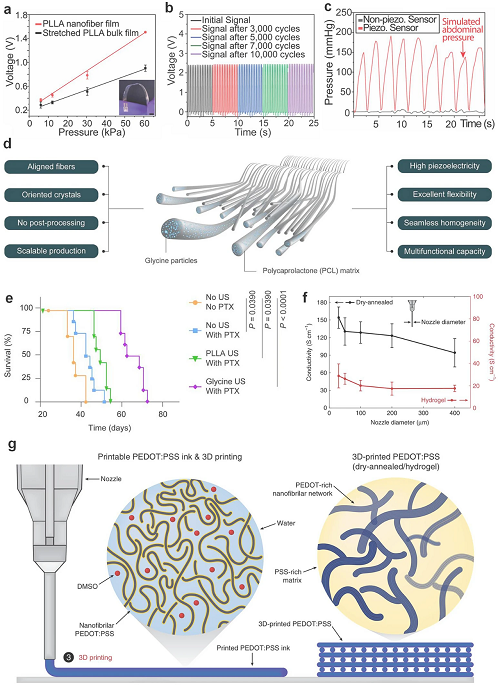
图5. 可降解传感器的校准曲线对比:拉伸大块PLLA薄膜(蓝色)与4000 rpm静电纺丝PLLA纳米纤维薄膜(红色)。
2.2 能量管理
柔性可穿戴超声设备的高效能源管理对连续生理监测和长期治疗至关重要,但其轻量化和微型化设计对能源供应提出了挑战。传统电池在体积、重量和续航方面受限,使能量收集、传输与利用成为关键。无线供电技术(如感应耦合、射频、声学能量传输)可实现无物理连接的充电,提高便捷性和耐用性,其中声学传输在组织衰减低、波长短方面具优势,适合植入式器件。能源收集技术同样重要,可利用环境或设备运动能量,如摩擦纳米发电机(TENG)将皮肤运动或压力转化为电能,实现自供能操作;外部超声波也可驱动植入式TENG,为设备提供直接能量来源。降低功耗是延长设备续航的核心策略,通过低功耗设计、优化超声换能器效率、选择高性能压电材料和高效传感机制,实现最小能耗下的可靠功能。综合无线供电、能量收集与低功耗设计,可显著提升柔性可穿戴超声设备的自持运行能力和实用性。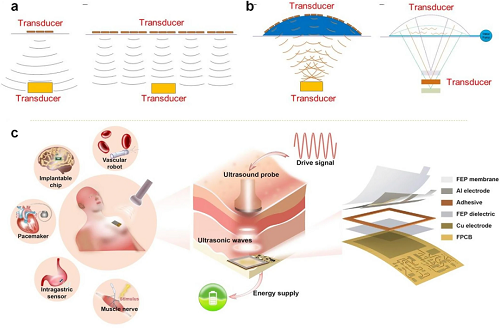
图6. 单个超声换能器与拼接阵列换能器的超声传输比较。
2.3 通信与控制技术
可穿戴超声传感器作为连续生理监测的关键技术,通过柔性贴合皮肤的设计非侵入性地采集生物信号,并将数据无线传输至外部设备,实现实时分析、远程监控和疾病早期检测。柔性超声贴片可连续监测血压、心输出量及动脉僵硬度,为无袖带评估提供非侵入性替代方案。深部植入设备也可利用超声实现无线能量传输与双向通信,如微型神经刺激器StimDust和超声驱动视网膜刺激装置,克服了传统有线或电磁方式的局限。
为支持持续、低能耗的数据传输,可穿戴超声设备通常采用低功耗蓝牙(BLE),结合多传感器平台实现血压、体液及汗液等多模态健康监测。所有数据集中分析,可提供心血管、代谢及水化状态的整体健康评估,增强个性化医疗和AI辅助诊断能力。未来,超低功耗无线芯片、柔性天线及边缘计算系统的创新,将进一步提升信号可靠性、能效及实时数据处理能力,推动下一代生物集成可穿戴超声设备的发展。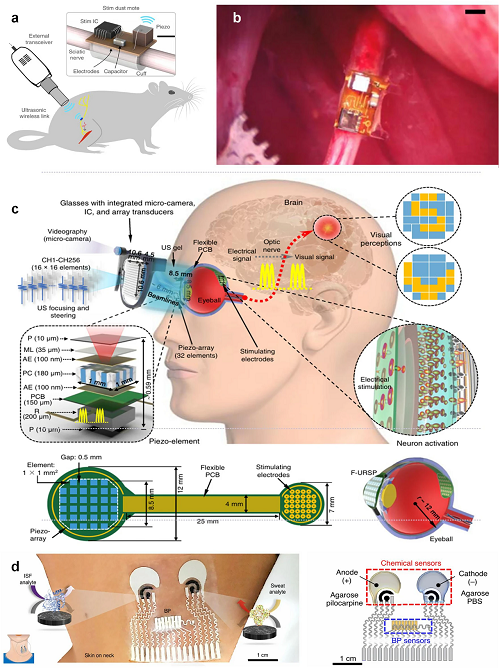
图7. StimDust 系统示意图,用于刺激大鼠坐骨神经。
III 可穿戴超声设备在治疗中的应用
可穿戴超声在药物递送中可增强药物穿透和靶向性;在组织修复与再生中,可加速伤口愈合和促进骨生长;在神经调控领域,可通过超声刺激神经活动,为慢性疼痛、抑郁及运动障碍等神经疾病提供潜在治疗方案。
3.1 药物递送
超声辅助药物递送通过增强组织穿透性和克服生物屏障,提高药物疗效。可穿戴超声设备利用空化效应和膜通透性增强,实现局部、可重复的药物输送,精准作用于靶组织,同时减少系统性副作用,尤其适用于慢性病的频繁给药,并向个性化、按需递送平台发展。
研究显示,可穿戴柔性超声微针贴片(wf-UMP)结合无铅压电换能器和可溶微针载药,通过超声刺激显著增强药物在水凝胶和猪皮中的扩散深度,翻倍穿透力并加快药物释放。声学超材料介导的可编程贴片也实现了动态多波次递送,提高透皮效率9.3倍,并在小鼠实验中优于皮下注射。MR引导聚焦超声(MRgFUS)在脑转移瘤患者中安全提升单抗药物跨血脑屏障递送。柔性超声贴片和可拉伸电子面膜通过空化和声流增强化妆品和治疗性大分子药物的皮肤穿透,显著提高递送效率和深度。
这些研究表明,柔性可穿戴超声技术能够实现无创、高效、可控的局部药物递送,为个性化治疗和美容应用提供了新途径。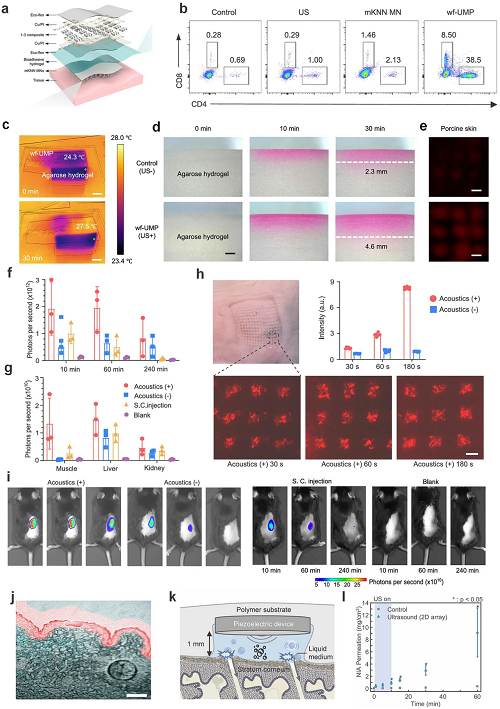
图8. 集成系统级 wf-UMP 电子装置,包括柔性超声换能器阵列用于高效超声发射、生物粘附水凝胶弹性层用于稳固贴合及声学耦合,以及载 mKNN 纳米颗粒的微针贴片用于药物递送。
3.2 组织修复与再生
可穿戴超声系统通过持续、局部且非侵入性的机械刺激,为组织修复与再生提供了独特手段。软性、贴肤设计使设备能够施加低强度超声,促进细胞增殖、血管生成和基质重塑,从而加速伤口愈合和骨组织再生,同时兼具便携性,可实现长期个性化治疗。
Meng等开发的生物粘附摩擦纳米发电机(BA-TENG)结合超声驱动的电刺激,实现快速止血与伤口愈合。在大鼠肝脏出血模型中,BA-TENG即时止血,减少约82%出血量。超声激活后产生的电场增强成纤维细胞迁移与增殖,使伤口在3天内接近完全再上皮化。
Lyu等设计的柔性超声贴片用于慢性伤口治疗,通过PZT-4压电陶瓷单元与水凝胶层实现贴合与防感染处理。每日20分钟超声刺激显著加快糖尿病大鼠全层伤口愈合,逆转成纤维细胞衰老。
Chen等提出全整合超声-电耦合贴片(UEP),实现多模态深层与表面同时刺激,并结合阻抗监测生成伤口“三维恢复曲线”,可预测愈合阶段。Liu等设计的可拉伸超声阵列则针对骨折愈合,通过1–3压电复合材料与蛇形金属互连确保贴肤性。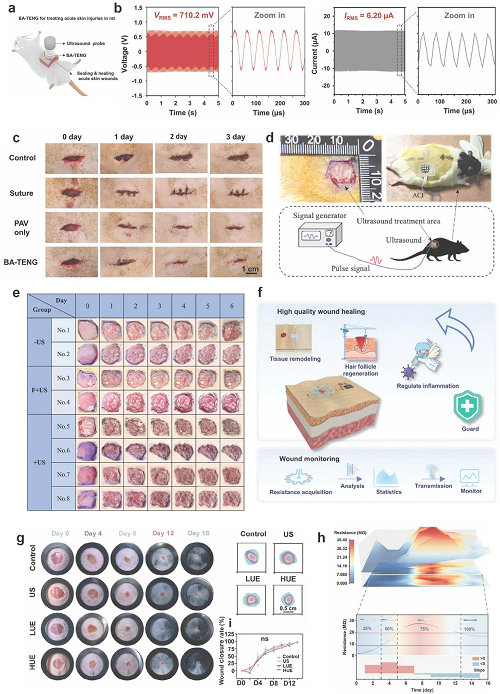
图9. BA-TENG 在大鼠皮肤损伤中实现止血与超声驱动电刺激促进愈合的示意图。
3.3 神经调控
超声可穿透软组织而无需与神经直接接触,通过声辐射力或空化等机械作用调节神经活动,为治疗神经疾病、增强神经可塑性及损伤后功能恢复提供新策略。超声神经调控通过机械压力波激活神经元的机械敏感离子通道,可非侵入性作用于深层神经靶点。例如,可穿戴耳部迷走神经刺激器通过贴合耳部的超声换能器实现非侵入性调控,相比植入式电刺激器更安全、便捷。
研究显示,基于KNN纳米纤维的可降解压电支架在脊髓损伤部位经超声刺激可产生局部电场,促进神经再生;体外实验中,该支架对神经干细胞提供可控电刺激,显著提高Nestin和GFAP表达,增强神经分化和活化。进一步,AhSonogenetics结合3D打印超表面生成聚焦Airy波束,可精准刺激表达超声响应通道的神经元,实现亚毫米级深脑靶向调控。帕金森模型小鼠实验表明,该技术可显著提高运动速度,展示神经功能恢复潜力。
总体来看,超声神经调控具有非侵入、深层穿透、高时空精度等优势,可实现浅表及深部神经靶向刺激,无需手术植入,并可与基因、光学和电生理技术结合,为基础研究和临床转化提供强大工具,未来有望成为精准、适应性和微创的神经调控核心技术。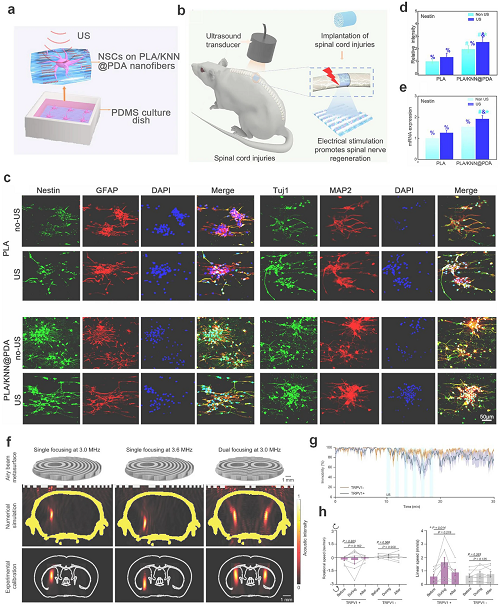
图10. 压电纳米纤维支架示意图,展示超声促进神经干细胞(NSCs)分化的作用。
IV 挑战和展望
可穿戴超声技术在临床应用中面临多重挑战。材料方面,传统PZT压电陶瓷虽性能优异,却刚硬易脆,不适合柔性设备;PVDF等压电聚合物柔韧性好,但电机械耦合效率低,限制灵敏度与带宽。1–3型压电复合材料和纳米材料在性能折中上展现潜力,但在反复变形下保持极化稳定性及实现低成本可规模化制造仍具挑战。生物界面同样复杂:可拉伸相控阵设计虽支持波束聚焦,但增加换能器间距限制高频分辨率;长期皮肤接触可能引发皮炎,植入组件需考虑降解产物的炎症反应。连续监测还面临运动伪影及缺乏长期使用监管标准的问题。潜在解决方案包括气溶胶喷墨打印柔性阵列、机器学习修正运动伪影、控水性生物粘附水凝胶维持耦合效率,以及压电-摩擦电混合能量收集系统。未来发展依赖新型压电纳米复合材料和二维MXene材料、3D打印个性化贴片、嵌入式波束形成芯片及自适应反馈系统,结合AI和物联网实现实时分析和远程监控。应用前景广阔,涵盖药物递送、组织再生、神经调控及生理监测,但仍需完善信号标准化与监管框架,推动从实验室到临床的转化。
V 总结
可穿戴超声器件作为新兴多功能技术,展现出在治疗应用中的巨大潜力。最新进展已实现其在无创药物递送、组织修复加速、靶向神经调控及癌症治疗中的应用。这类器件利用超声增强通透性、促进再生、调节神经等效应,并结合柔性材料与电子技术,打造便携、患者友好的方案。临床前与早期试验显示,其可加速创口愈合、促进骨折修复、实现无创神经刺激并抑制肿瘤生长,突显出显著疗效。其核心优势在于可实现持续或按需的非侵入性治疗,提高疗效并改善依从性。然而,其材料耐久性、器件性能、临床转化及规模化仍存挑战。跨学科研究正积极攻关,未来有望在个性化医疗、远程健康及AI诊断等领域发挥关键作用,推动智能、实时、以患者为中心的医疗新时代。
作者简介

关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2024 JCR IF=36.3,学科排名Q1区前2%,中国科学院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 美国密苏里大学闫政等综述:可穿戴超声设备在治疗中的应用
 Nano-Micro Letters
Nano-Micro Letters 广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机
广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机 松山湖材料实验室林生晃&湖南大学杨蓉:多模态神经形态器件与集成
松山湖材料实验室林生晃&湖南大学杨蓉:多模态神经形态器件与集成 安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化
安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化 浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池
浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池