最近,CRISPR-Cas系统开始被应用在核酸检测中,由于它具有同时切割靶向核酸和非靶向核酸(用作报告分子)并输出信号的特性,在新型生物传感器构建中表现出了巨大的潜力。同时,电化学分析方法具有的高灵敏度、快速响应和成本效益优势使电化学生物传感器成为医学诊断中强大的分析工具。因此,本研究开发了一种基于CRISPR-Cas系统的新型电化学生物传感器,称为MoECS(Methodology of Electrochemical CRISPR Sensing),用于检测SARS-CoV-2变异株。
CRISPR-Cas12a-Empowered Electrochemical Biosensor for Rapid and Ultrasensitive Detection of SARS-CoV-2 Delta Variant
Chenshuo Wu, Zhi Chen,* Chaozhou Li, Yabin Hao, Yuxuan Tang, Yuxuan Yuan, Luxiao Chai, Taojian Fan, Jiangtian Yu, Xiaopeng Ma, Omar A. Al-Hartomy, S. Wageh, Abdullah G. Al-Sehemi, Zhiguang Luo, Yaqing He, Jingfeng Li,* Zhongjian Xie,* Han Zhang*
Nano-Micro Letters (2022)14: 159
https://doi.org/10.1007/s40820‑022‑00888‑4
1. 以与 SARS-CoV-2 Delta S基因序列相同的 DNA 模板为模型,传感器可以在无扩增实验的情况下实现50 fM的检测限和100 fM至10 nM的检测区间,同时也具有高特异性和稳定性。
2. 设计的特异性crRNA可以匹配SARS-CoV-2 德尔塔变异株核酸序列上的突变位点,为诊断其它新出现的SARS-CoV-2变体提供了借鉴。
3.基于无线微型电化学平台,所构建的传感器在即时检测(POCT)中显示出良好的应用前景。
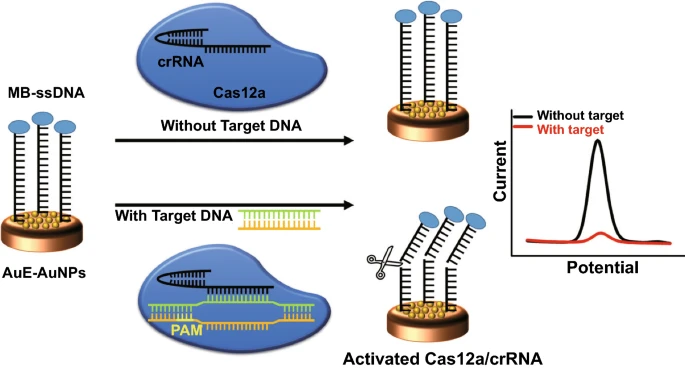
由SARS-CoV-2引起的COVID-19已在全球迅速蔓延,世界正承受着相当大的健康、社会和经济负担。因此,快速准确地识别和监测SARS-CoV-2感染对于预防疾病传播和最终挽救生命至关重要。深圳大学张晗教授课题组首次提出电化学 CRISPR 传感 (MoECS) 的概念和方法,以满足快速准确检测 SARS-CoV-2 变体的需求。为了增强传感性能,工作电极 (AuE) 使用电沉积高质量金纳米颗粒修饰得到AuE-AuNPs,以增加导电性和活性比表面积。然后用亚甲蓝单链DNA (MB-ssDNA)修饰AuE-AuNPs。为了稳定的电化学信号和长时间存储,我们选择了Cas12a蛋白来制造生物传感器。当生物传感器被Cas12a-crRNA-靶标DNA混合溶液处理时,在特异性识别靶标DNA的作用下,Cas12a的反式切割活性激活,MB-ssDNA将从电极表面被切割。因此,AuE-AuNPs和ssDNA上的氧化还原介体(MB)之间的电子转移在切割前后发生了变化,而这种变化可以通过电化学转导和检测。研究分别通过生物学和电化学策略检验了该传感器的可行性,并继续传感器的检测限(LOD)、特异性、稳定性以及在即时检测(POCT)中的性能和应用潜力。
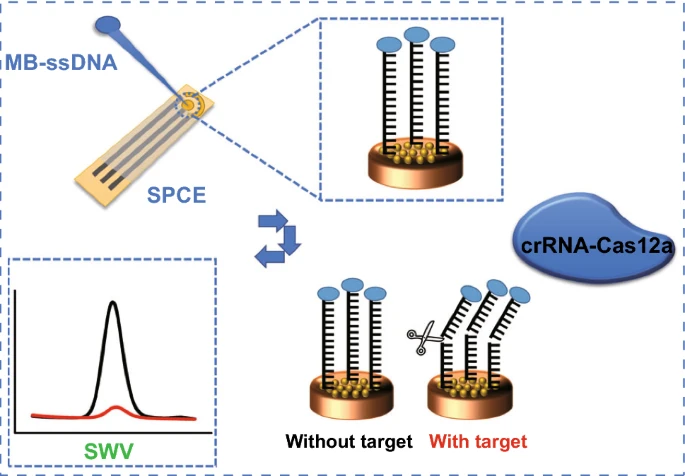
I 金纳米颗粒辅助CRISPR电化学生物传感器的原理
首先将MB-ssDNA报告基因固定于修饰电极表面。基于靶标的前间区序列邻近基序(PAM)以及靶标DNA与crRNA的互补性,设计了导向Cas12a/crRNA双链体,以特异性识别SARS-COV-2的靶标DNA。在没有目标DNA的情况下,Cas12a-crRNA的切割活性未被激活,MB-ssDNA报告分子保留在修饰电极表面,从而产生了明显的MB电化学信号。在靶标DNA存在的情况下,Cas 蛋白识别 PAM 序列,Cas12a的反式切割活性被激活,因此MB-ssDNA报告基因被从电极表面非特异性切割,导致MB的电化学信号降低。得益于金纳米颗粒的大比表面积,可以将目标识别事件转化为电极上ssDNA报告基因的大量切割,用于设计高灵敏度的电化学核酸生物传感器。
图1. 金纳米颗粒辅助CRISPR电化学生物传感器的原理示意图。
II CRISPR电化学生物传感器的生物可行性探究
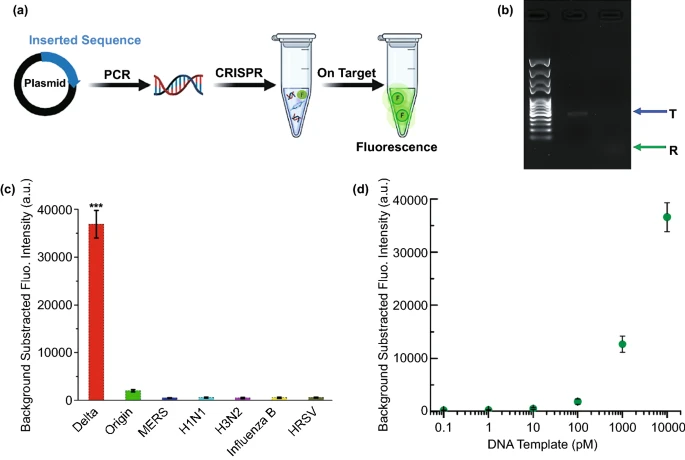
为了检验基于CRISPR-Cas12a的电化学生物传感器用于核酸检测的可行性,在设备上检测之前进行了验证实验。如图2A所示,设计了不同的目标模板并将其插入pUC57质粒中。使用琼脂糖凝胶电泳确认顺式和反式切割。如图2B所示,观察到完整dsDNA模板的条带(表示为“T”)。在图2C中,只有Delta变体的DNA模板与CRISPR系统发生反应并观察到强荧光。此外,FAM-ssDNA-BHQ探针被用作 Cas12a的报告基因,用于荧光检测具有不同浓度(从100 fM到10 nM)的目标Delta DNA,计算检测下限约为100 pM(图 2D)。
图2. (A) CRISPR反应示意图;(B)通过琼脂糖凝胶电泳验证反式和顺式切割;(C) crRNA的特异性;(D)荧光浓度结果,灰线表示检测限。
III CRISPR电化学生物传感器的电化学可行性探究
首先对生物传感器不同阶段的EIS进行了验证,如图3A所示,AuE-AuNPs具有优异的电化学电导率(黑色曲线)。在将MB-ssDNA固定在AuE-AuNPs上后,Ret值显着增加至4795 Ω(红色曲线),在用Cas12a-crRNA-靶 DNA混合溶液处理后,由于 Cas12a 的活化切割活性,大部分MB-ssDNA已被切割并与AuE-AuNPs分离导致Ret在蓝色曲线中大幅下降(约1612 Ω)。SWV如图3B所示,当生物传感器用Cas12a-crRNA混合溶液处理没有靶DNA时,在-0.27 有明显的MB的氧化还原峰(黑色曲线);当生物传感器用 Cas12a-crRNA与靶DNA一起处理时,MB的氧化还原峰显着降低(红色曲线),这进一步证实了MB-ssDNA的成功切割和MB在生物传感器表面的释放。图 3C显示了MB的氧化还原峰的SWV,靶DNA浓度范围为100 fM至 10 nM,其中随着靶DNA浓度的增加,电流逐渐减小。在图4中,电流变化 (ΔI%) 与目标 DNA 浓度的对数得到的回归方程为:ΔI% = 14.37 lg C + 192.67,R₂和LOD分别计算为0.987和50 fM。

图3. (A)电化学阻抗谱 (EIS)表征;(B)方波伏安 (SWV) 曲线;(C)不同浓度靶DNA的 SWV曲线;(D)电流变化 (ΔI%) 与目标 DNA 浓度的对数之间的线性关系。
IV CRISPR电化学生物传感器的特异性探究
如图4所示,当靶标DNA被来自原始SARS-CoV-2病毒的核酸取代时,观察到明显降低的ΔI%(16.1%),这证实了crRNA靶向Delta变体的特异性。此外,MERS、H₁N₁、H₃N₂、B型流感和HRSV均表现出不明显的信号变化(△I%<10%),而仅来自Delta变体的靶标DNA表现出显著的电化学响应(ΔI%=77.9%)。该实验结果表明建立的电化学生物传感器能够以高特异性检测SARS-COV-2 Delta变体。
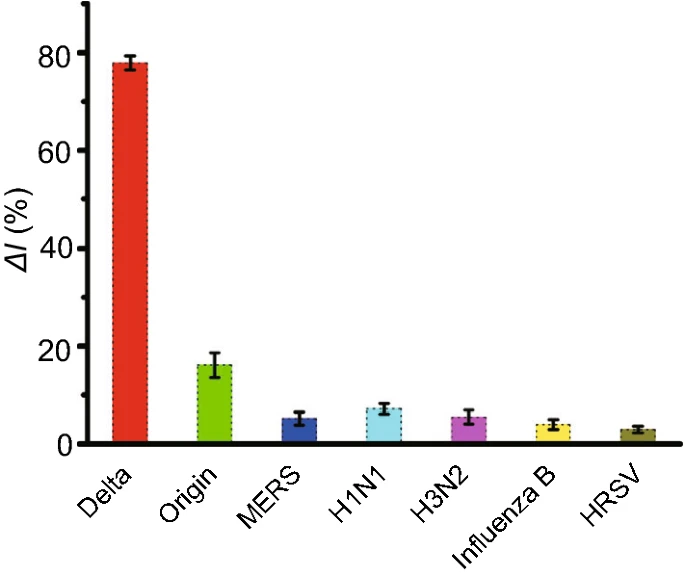
图4. AuNPs辅助E-CRISPR对SARS-COV-2 Delta变体的特异性分析。根据SWV电流计算信号变化,分别添加目标 DNA (10 nM) 和非目标病毒 (10 nM)。
V CRISPR电化学生物传感器的即时检测应用探究
微型电化学工作站由智能手机连接直接控制,实验数据可通过蓝牙及时传输。迄今为止,丝网印刷技术对于SPE的制备已经成熟,因此SPE成本非常低。POCT检测中靶标DNA的浓度选择为10 nM,以证明POCT微电化学工作站检测SARS-COV-2变异株的可行性。如图5所示,从SWV曲线得到的 MB 的氧化还原峰电流分别为933.05 nA(不含靶标DNA)和280.11 nA(含靶标DNA),ΔI% 计算为 69.97%,与从传统电化学工作站获得的相应ΔI%相比仅10%的差异。显然,MoECS结合微型电化学平台可用于POCT进行快速SARS-CoV-2 Delta变体的诊断,无需繁琐的样品处理。

图5.传感器在POCT中用于SARS-CoV-2 Delta变异检测的示意图、初步分析照片和实验结果。

本文通讯作者
广州医科大学第六附属医院 研究员
深圳大学 研究员
与光学/电化学传感联用的CRISPR基因编辑技术拓展。

本文通讯作者
光纤激光器、非线性光学、光纤通信与电子器件、新型功能材料光电子特性、基于石墨烯/类硫化钼异质结的高速光调制器关键技术研究等。
▍主要研究成果
深圳大学物理与光电工程学院特聘教授,博士生导师,美国光学学会会士,英国皇家化学学会会士,主要从事二维材料光电器件研究。入选教育部“新世纪优秀人才支持计划” ,“广东特支计划”青年拔尖人才,深圳市青年科技奖,深圳市海外高层次人才孔雀团队项目负责人。获教育部科技二等奖、国家自然科学基金委“优秀青年科学基金”,主持多项国家重点研发项目、国家自然科学基金重点项目、国家自然科学基金面上项目等。累计发表SCI论文300余篇,封面论文近百篇,SCI总引6万余次,H指数135,2018-2021连续4年入选科睿唯安“全球高被引用科学家”。
▍Email:hzhang@szu.edu.cn
撰稿:原文作者

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2021JCR影响因子为 23.655,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » CRISPR-Cas12a赋能的电化学生物传感器用于快速和超灵敏检测 SARS-CoV-2 德尔塔变异株







 Nano-Micro Letters
Nano-Micro Letters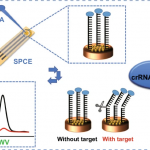 CRISPR-Cas12a赋能的电化学生物传感器用于快速和超灵敏检测 SARS-CoV-2 德尔塔变异株
CRISPR-Cas12a赋能的电化学生物传感器用于快速和超灵敏检测 SARS-CoV-2 德尔塔变异株 NML研究文章|机器学习方法:提高磁性免疫层析反应检测性能
NML研究文章|机器学习方法:提高磁性免疫层析反应检测性能 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人