Chenglong Lin, Shunshun Liang, Yusi Peng, Li Long, Yanyan Li, Zhengren Huang, Nguyen Viet Long, Xiaoying Luo, Jianjun Liu, Zhiyuan Li, Yong Yang
Nano-Micro Letters (2022)14: 75
https://doi.org/10.1007/s40820-022-00803-x
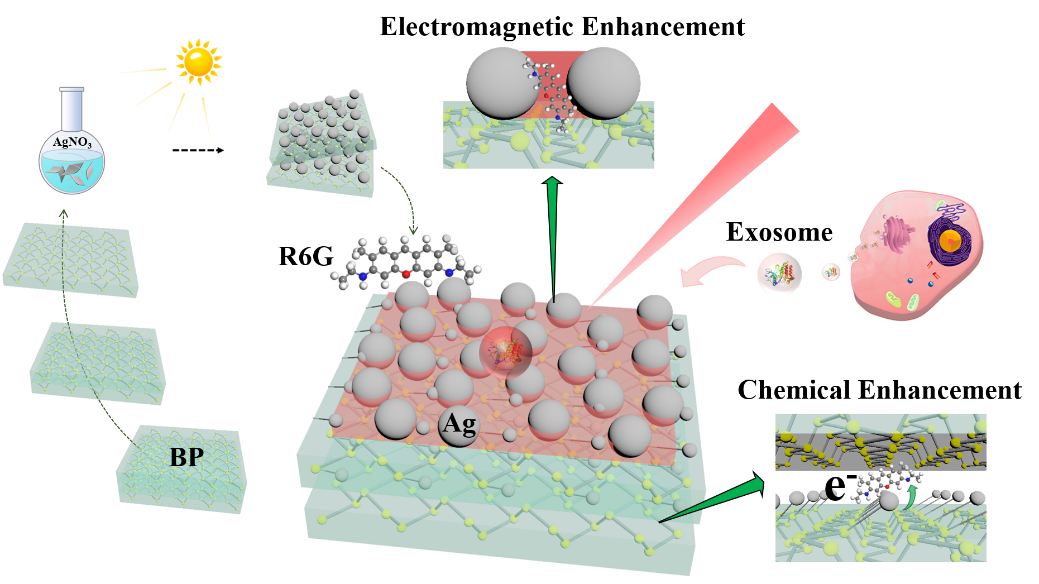
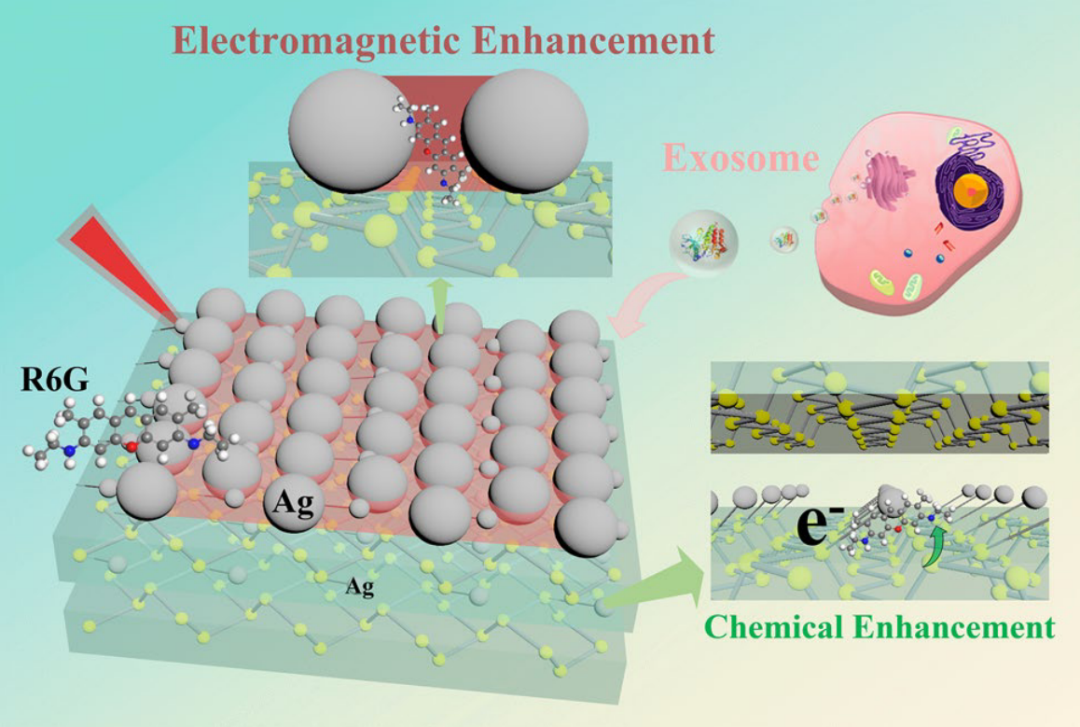
图1. Ag/BP-NS SERS传感器合成与应用示意图。
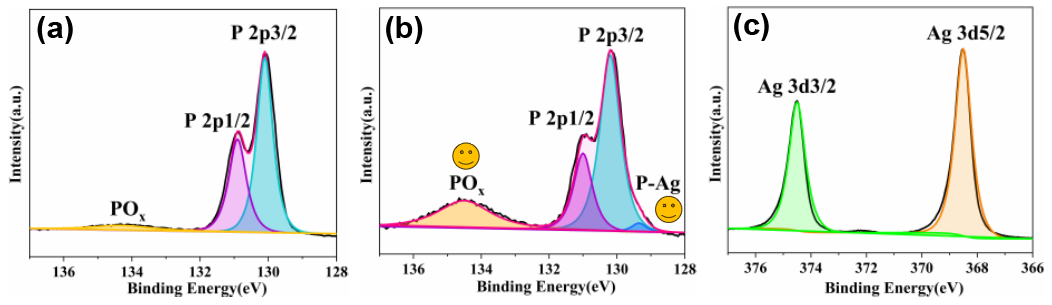
如图2所示,在这项工作中合成的复合纳米片与已报道的Ag/BP-NS复合材料有显著不同。除了表面上的大银纳米粒子外,BP纳米片的表面和插层之间还分布着许多超小的银纳米粒子。大多数银纳米颗粒(50-100 nm)很好地附着在BP纳米片上(图2a)。随后,将Ag/BP-NS悬浮液稀释并剥离纳米片以暴露纳米片内层。如高角度环形暗场(HAADF)图像(图2c)所示,可以观察到大量直径约3-5 nm均匀分布的超小Ag纳米颗粒紧密附着在表面或嵌入BP纳米片。然而,在没有光照的情况下合成的Ag/BP-NS样品中几乎没有观察到小尺寸的银纳米颗粒(图2d)。这是由于BP纳米片在光激发下可以产生大量的光生电子,使得Ag纳米粒子的成核速度迅速提高,从而提高了溶液中Ag纳米粒子的还原效率。此时一些成核纳米粒子在溶液中Ag⁺耗尽之前将无法生长,因此超小的Ag纳米粒子原位沉积在纳米片的表面和插层。

II Ag/BP-NS纳米片上的单分子检测
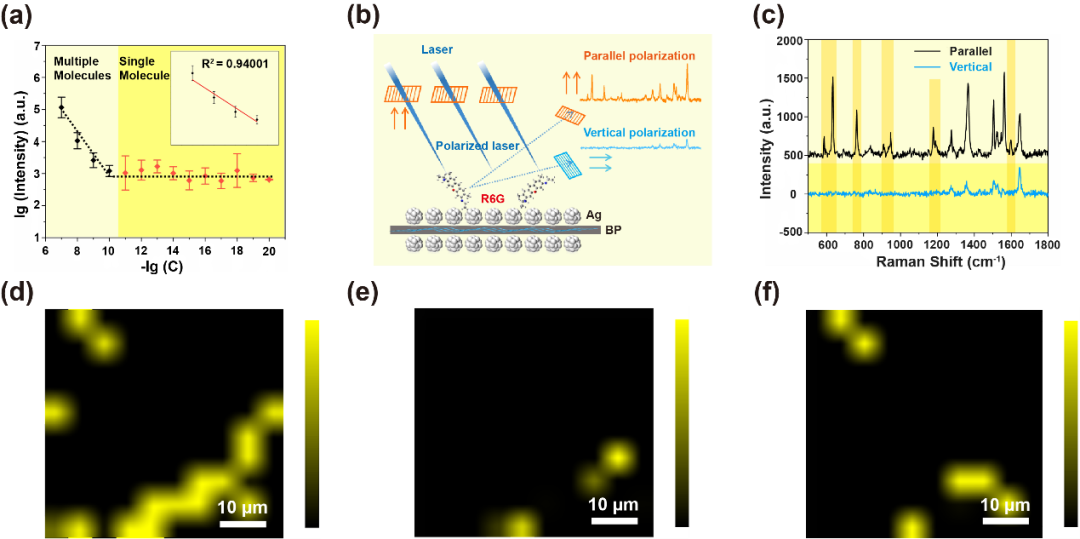
为了验证Ag/BP-NS的单分子检测能力,进行了以下验证。一般来说,如果探针分子的浓度小于10⁻¹¹ M,在不考虑基底对探针分子富集的情况下,显微拉曼测量区域(激光聚焦区)中可检测分子数仅有单个分子或几个分子。如图4a所示,这里收集了从10⁻⁸到10⁻²⁰ M的一系列浓度梯度的R6G分子的拉曼信号。需要注意的是,由于R6G分子的极化特性,在低浓度下R6G的指纹峰不会全部出现,只有分子极化方向与偏振光方向相同的振动才会被增强。图4c-e给出了不同浓度(10⁻¹⁸-10⁻²⁰ M) R6G在Ag/BP-NS基底上的拉曼映射(Mapping)图像和SERS成像结果。
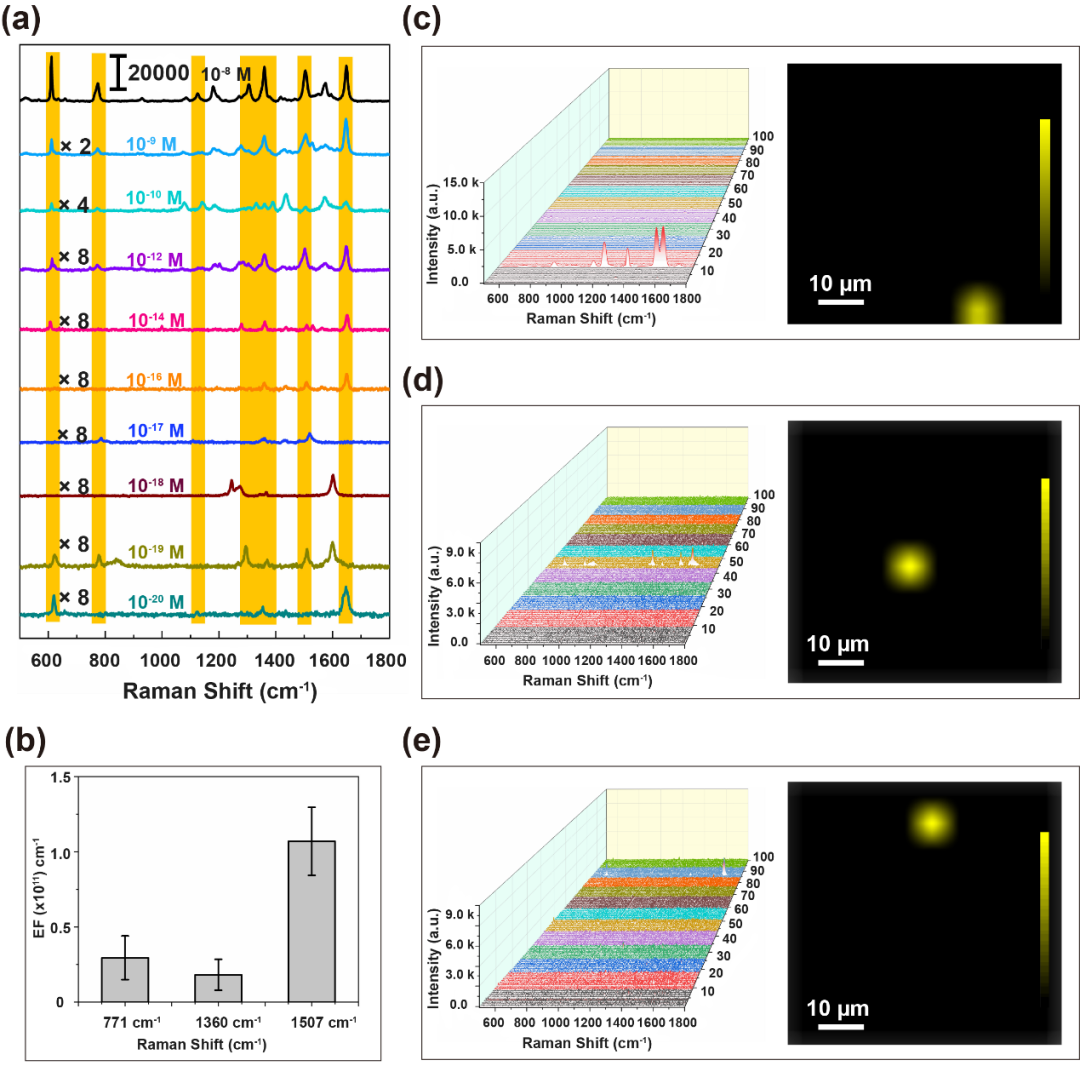
在如此低的浓度下,可以排除分子聚集的干扰,所以可以认为真正得到了单分子的信号。随后,计算了Ag/BP-NS基板上R6G在1360 cm⁻¹处的特征峰强度。如图5a所示,拉曼信号在10⁻⁷到10⁻¹⁰ M范围保持很好的内线性关系,相关系数为0.94001。然而,当浓度低于10⁻¹¹ M时,获得的探测信号不再与之前的数据线性相关。并且数据之间的强度波动变化不大,说明在出现信号的区域处只有一个或几个R6G分子。然后,这里提出了一种偏振-映射方法来分析从超低浓度溶液中获得的R6G信号是否由单分子发射。图5b给出了偏振-映射策略的示意图。R6G分子是不对称的,所以分子具有极性。因此,其拉曼光谱具有偏振特性。如果拉曼光谱不是单分子发射的,而是大量分子吸附在基板上并随机分布。那么采集到的分子信号在各个方向的极化张量是具有平均效应的统计结果。因此,当在光路中添加偏振片时,偏振光谱之间只会存在强度差异。相反,对于单分子偏振光谱,与偏振光方向不同的极化方向就不会被增强,所以光谱的差异不仅会表现在强度上,还会导致一些峰的消失和相对强度的变化。因此,可以通过研究R6G分子的偏振拉曼光谱来判断信号是否是单分子发出的。
在这里,分别在激光器后方和信号收集器之前各放置一个偏振片,随后通过mapping在10⁻¹⁵ M R6G样本中扫描60×60 μm²的矩形区域并分析其中的清晰信号。通过转动信号收集器前面的偏光片,使其与激光器后面的偏光片平行或垂直, R6G的平行和垂直偏振光谱均在同一点采集。如图5c所示,将信号采集器前的偏振片旋转90°后,部分指纹峰明显消失,平行偏振光谱与垂直偏振光谱的特征峰的相对强度也发生了变化。这是由于偏光片滤掉了单分子在其他方向上的散射光子,该实验给出了单分子存在的重要证据。基于上述原理和实验结果,我们提出了一种结合映射和偏振光谱来表征单分子的方法。如图5d-f所示,在这里,我们采用1648 cm⁻¹的拉曼强度进行映射成像。当没有在光路中添加偏振片时,获得了16个清晰的分子信号(图5d)。在光路中加入偏振器后,指纹峰的变化反映在垂直偏振映射光谱中,部分信号消失(图5e)。继续旋转偏振片,如图5f所示,原本在垂直映射中出现的一些清晰信号也消失了。但无论是平行偏振光谱还是垂直偏振光谱,信号的位置都可以与未放置偏振片的光谱一一对应。上述现象表明,可以实现基于Ag/BP-NS的单分子可视化检测和表征。
如图6a所示,分别通过(1)光还原法和(2)普通方法合成了Ag/BP-NS的悬浊液,以及通过(3)化学还原法合成了Ag的悬浊液。通过不同方法合成的Ag纳米颗粒的尺寸相似(图6b-e)。然而,通过光还原合成的杂化纳米片的悬浊液外观更接近银胶体,既产生了更多的银纳米颗粒,这也由SEM图像所证实(图6b、d)。正如上面提到的,BP纳米片在激发光下可以产生大量的光生电子,以提高Ag纳米粒子的还原效率。因此,光还原方式带来了像化学还原一样更高的还原效率,必然会带来更多的“热点”。

如图7a-c所示,通过有限差分时域(FDTD)模拟了BP纳米片和Ag/BP-NS纳米片的电磁场分布情况。BP的局部等离子体共振可以被532 nm入射光激发(图7a)。随后,计算了吸附在BP上的二聚体(Ag纳米颗粒)。如图7b所示,直径为50 nm 的Ag颗粒提供了明显的电磁增强。强耦合共振主要分布在二聚体(Ag纳米粒子)的“间隙”和BP表面。根据SERS增强因子与局域电场增强因子的对应关系,电磁可以提供大约10⁸的增强。
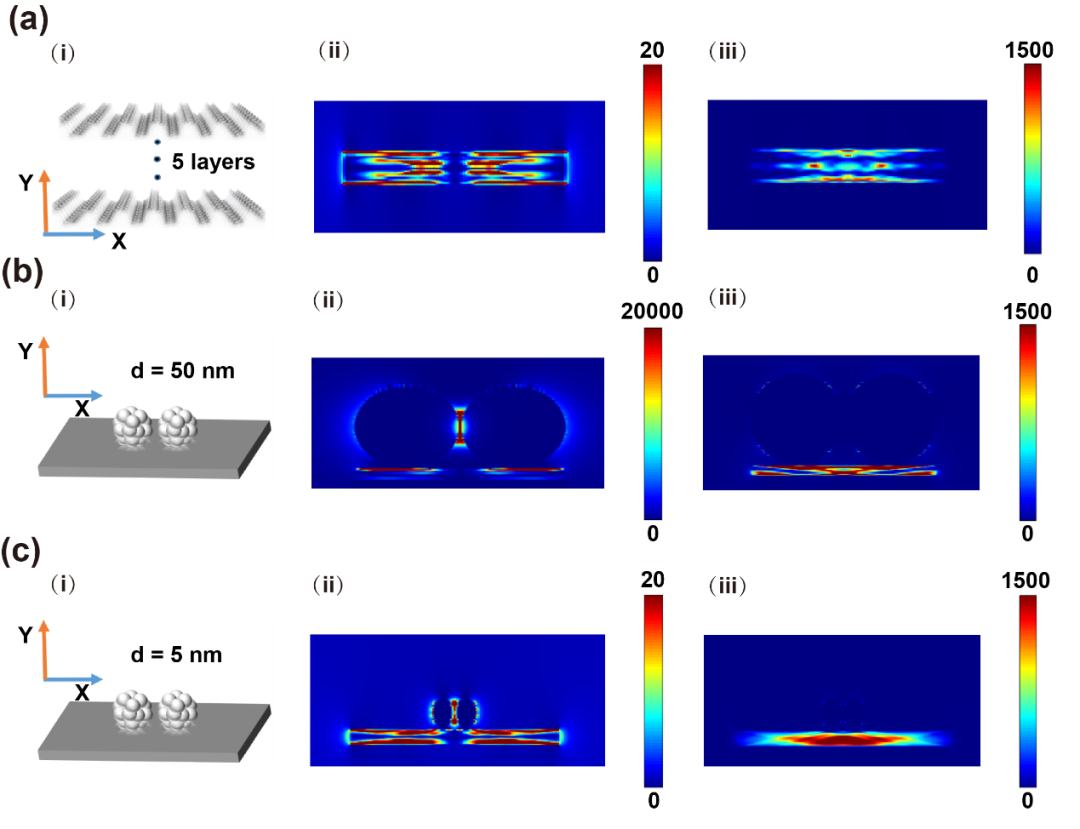
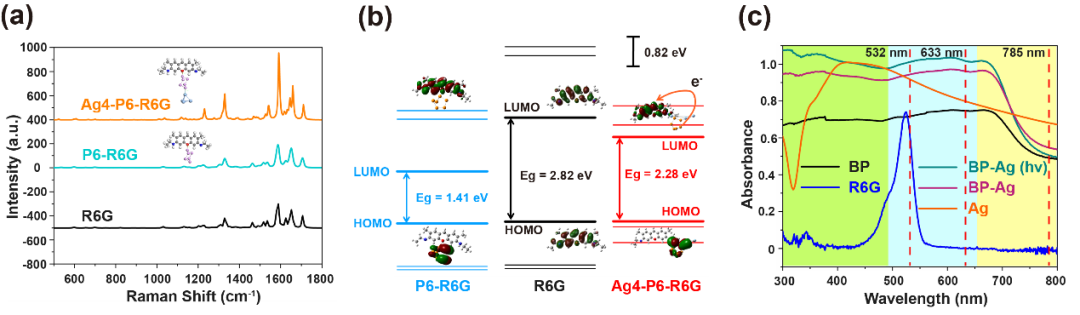
虽然直径为5 nm的Ag纳米粒子没有提供明显的电磁增强(图7c),但BP/Ag异质结构中高效的载流子迁移率可以有效地促进化学增强过程和光活性。如图8a所示,通过Gaussian计算的R6G光谱表明Ag4-P6簇中存在明显的化学增强。更重要的是,Ag4-P6-R6G簇的计算带隙(图8b)更接近532 nm激光下的“带隙共振”(2.33 eV)。
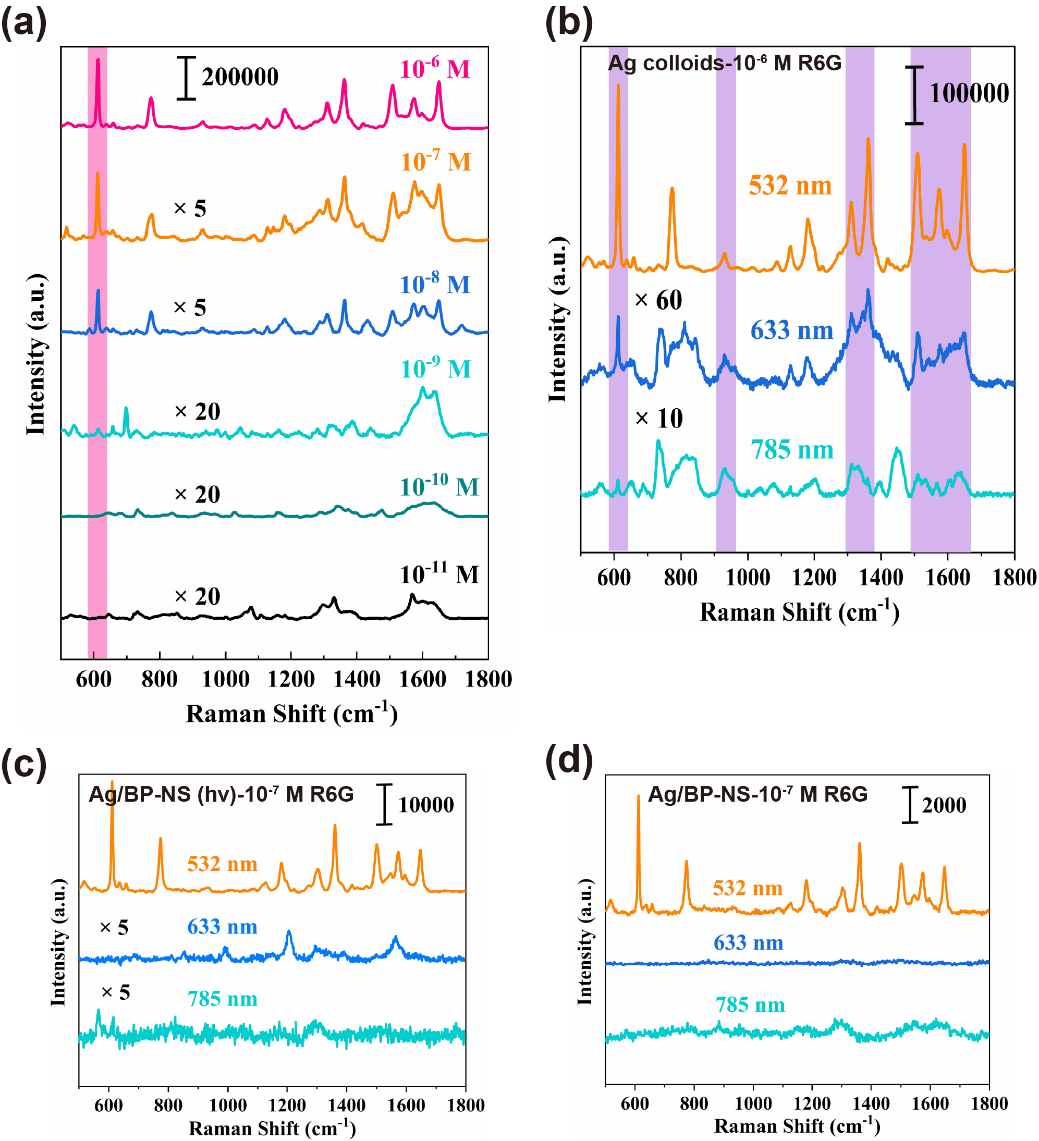
除了EM和CM的计算结果,下面又通过实验进一步证明了该体系存在显著的电荷转移。如图9a所示,Ag纳米颗粒(约50 nm)由于等离子体共振和R6G在532 nm处的光吸收之间的耦合,可以强烈增强分子的拉曼信号。Ag纳米粒子的光吸收在532 nm后逐渐下降(图8c)。所以推测,在633和785 nm波长下增强效果会逐渐减弱。如图9b所示,实验结果确实与预测结果一致。虽然Ag/BP-NS 的光吸收在785 nm处迅速下降,但在633 nm处并未下降。然而,在改变激发波长后,基底的增强作用迅速消失(图9c、d),这不符合EM定律。因此,在Ag/BP-NS中必然存在“带隙共振”的化学增强。与未光照制备的纳米片相比,光还原(hv)制备的Ag/BP-NS在633 nm激发光下仍保持一定的增强,这也证实了光还原可以给纳米片带来更多的“热点”。此外,光还原基底的光吸收强度也显着高于其他基底。总之,通过光还原制备的Ag/BP-NS具有三各方面的协同共振,包括Ag纳米粒子周围的电磁共振(约50 nm)、光诱导电荷转移共振(Ag-P-R6G簇)和分子共振。
IV 基于Ag/BP-NS的肿瘤外泌体检测
最后利用机器学习的方法进行光谱识别,研究中选择了两种外泌体和PBS干扰各自100个光谱进行训练和测试。随机选择300个光谱中的60%作为训练集,其余光谱作为测试集。如图10a、b所示,经过训练的模型在预测训练集和测试集时的灵敏度值分别为100%和99.17%。事实上,测试集中只出现了1例误判,这表明Ag/BP-NS结合机器学习方法具有在单囊泡水平上区分肿瘤外泌体的能力。
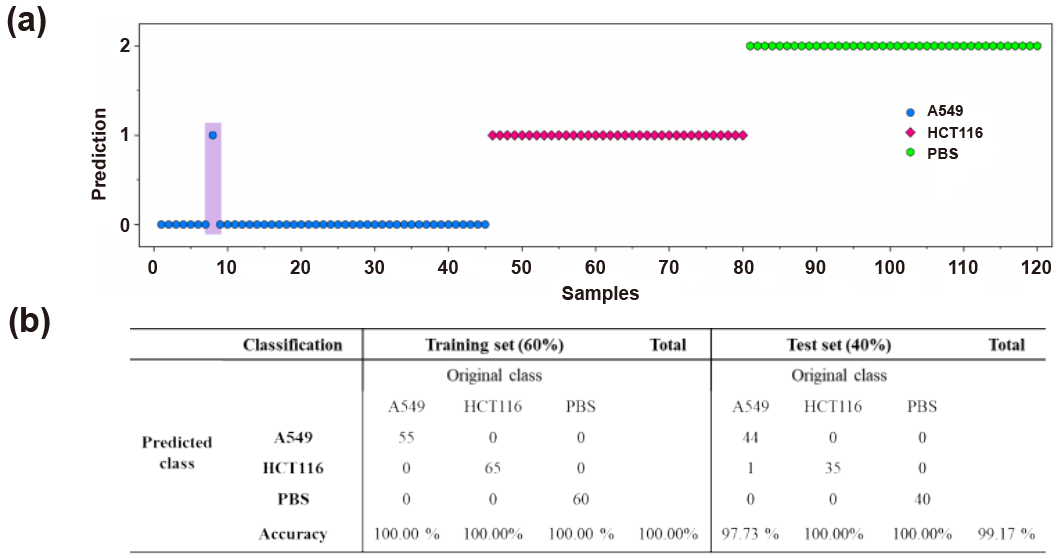
图10
结论:研究通过光还原方法合成了一种独特的Ag/BP-NS纳米片。Ag/BP-NS表现出惊人的本征SERS灵敏度,EF为0.101×10¹²,LOD可以达到单分子水平。检测过程无需任何物理富集,即可在10⁻²⁰ M R6G 溶液中获得清晰的单分子信号。Ag/BP-NS基底优异的SERS增强能力来自于电磁共振、光诱导电荷转移共振和R6G分子共振的协同共振增强。此外,我们通过提出的偏振-映射光谱,实现了单个R6G分子在Ag/BP-NS上的精确定位和SERS成像。该基底在实际应用中也具有优异的性能,具有良好的生物相容性和均匀性。结合SERS成像和机器学习,可以区分和识别不同细胞系中的肿瘤外泌体。所制备的二维Ag/BP-NS具有单分子/囊泡检测能力,结合其在肿瘤治疗领域的优异性能,有望建立独特的肿瘤检测和治疗体系。
 杨勇
杨勇
本文通讯作者
中国科学院上海硅酸盐研究所 研究员
(1) 用于能源和环境的纳米光电材料与纳米生物传感器件;(2) 激光与物质表界面光学作用,陶瓷表面改性及光学薄膜;(3) 陶瓷增材制造科学与空间应用。
▍个人简介
▍个人主页:
sourcedb.sic.cas.cn/zw/rck/200910/t20091010_2541974.html

Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 单分子可视化表面增强拉曼散射成像:二维Ag/BP(黑磷)纳米传感器识别肿瘤外泌体
 Nano-Micro Letters
Nano-Micro Letters 广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机
广西大学徐传辉等: 仿植物蒸腾系统的生物基柔性太阳能驱动可持续发电机 松山湖材料实验室林生晃&湖南大学杨蓉:多模态神经形态器件与集成
松山湖材料实验室林生晃&湖南大学杨蓉:多模态神经形态器件与集成 安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化
安徽医科大学王咸文等:掀起ROS风暴!铜单原子驱动细菌“类铜死亡”终结耐药进化 浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池
浙江大学吕建国等:碱金属层间支柱调控层氧正极材料实现超高倍率与长循环钠离子电池