CaCO₃-Assistant Preparation of pH-Responsive Immune-Modulating Nanoparticles for Augmented Chemo-Immunotherapy
Yujie Zhu, Zhijuan Yang, Ziliang Dong, Yimou Gong, Yu Hao, Longlong Tian, Xianzhu Yang, Zhuang Liu*, Liangzhu Feng*
Nano-Micro Letters (2021)13: 29
https://doi.org/10.1007/s40820-020-00549-4
1. 发展了一种能够同时有效负载亲水型、输水型小分子药物以及生物大分子的碳酸钙基纳米载体构建方法。
2. 利用碳酸钙的微酸响应性分解性质,实现了药物分子在肿瘤内的响应性释放与深部递送。
3. 开发了一种能有效调节酸性肿瘤微环境的策略,并实现了有效的化疗与免疫联合治疗。
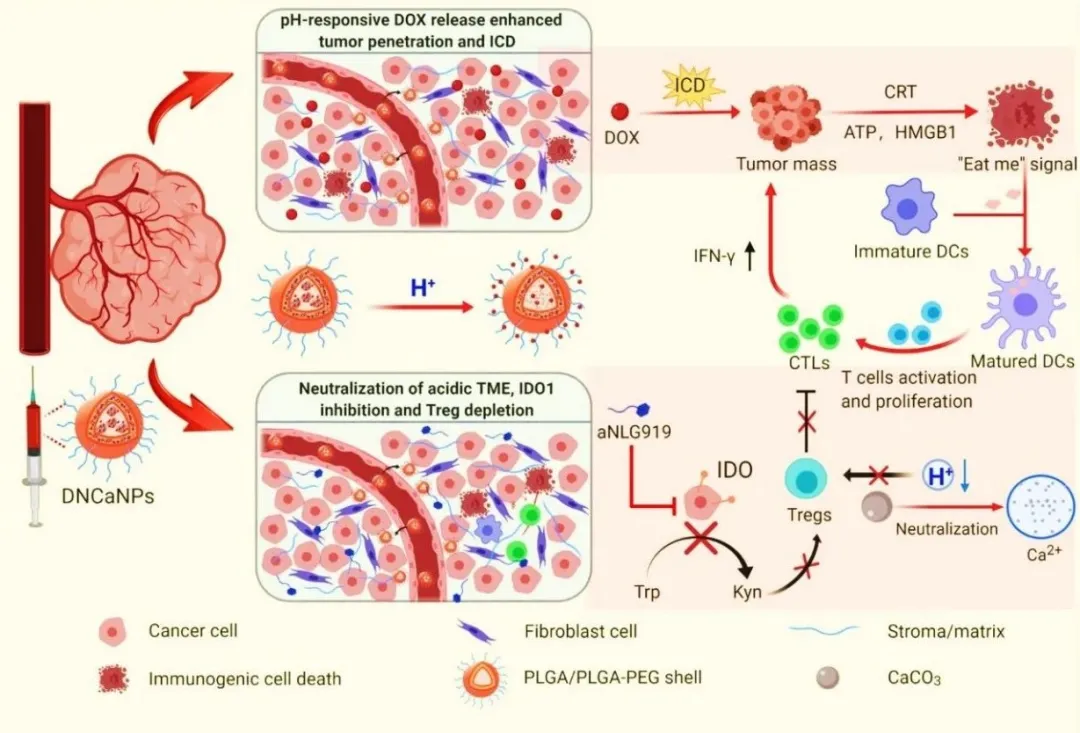
近年来,越来越多的实验数据证据表明肿瘤微环境(TME)会严格阻碍包括化疗在内的多种癌症治疗手段的疗效,是肿瘤治疗失败的重要原因之一。例如,实体瘤内致密的细胞外基质和较高的组织间液压阻碍了药物在肿瘤内的扩散,进而限制了化疗等的治疗效果;此外,免疫抑制性是肿瘤微环境的另一个重要特征,它表现为肿瘤内免疫系统功能障碍或耗竭,丧失对对肿瘤细胞的杀伤能力。因此,通过利用具有独特功能的生物材料来克服肿瘤微环境对肿瘤治疗疗效的制约,实现安全高效的肿瘤治疗,以成为生物材料与纳米医学领域一个重要的研究课题。苏州大学功能纳米与软物质研究院刘庄教授与冯良珠副研究员团队开发了一种碳酸钙辅助的双微乳法制备pH响应性纳米颗粒的新策略,实现对阿霉素(一种免疫原性细胞死亡(ICD)诱导剂)和烷基化NLG919 (aNLG919,一种吲哚胺2,3-双加氧酶1 (IDO1)抑制剂)的有效共包封。制备的DOX/ aNLG919负载的PLGA-CaCO₃纳米颗粒(DNCaNPs)能够引起癌细胞ICD,并通过抑制IDO1来降低免疫抑制分子——犬尿氨酸的产生。经静脉注射后,DNCaNPs可以有效地积聚在肿瘤部位并促进负载的小分子药物在肿瘤内的扩散,同时还能中和酸性TME。进一步研究发现,DNCaNPs可以引起有效的抗肿瘤免疫反应(如:增加肿瘤浸润CD8⁺细胞毒性T细胞,减少免疫抑制调节性T细胞亚群Treg),从而通过化疗与免疫联合治疗有效地抑制皮下CT26肿瘤模型和原位4 T1肿瘤模型的生长。
本研究提出了一种简易构建pH响应性纳米粒子的策略,克服免疫抑制的TME,显著增强肿瘤的化疗免疫治疗。通过在经典的双乳液法制备聚乙二醇-b-聚乳酸-羟基乙酸(PLGA-PEG)纳米颗粒,将CaCO₃引入颗粒内部水相,与传统方法制备的PLGA-PEG纳米颗粒相比,获得的CaCO₃@PLGA-PEG纳米颗粒(CaNPs)显著提高了这一载体对一系列不同分子的装载效率。后续实验中同时包封化疗ICD诱导剂阿霉素(DOX)和IDO1抑制剂烷基化NLG919 (aNLG919),获得pH响应型DNCaNPs纳米颗粒。研究发现,DNCaNPs能够有效地穿透肿瘤内屏障,并在酸性肿瘤微环境中有效释放,同时与实体肿瘤内的质子发生反应,中和酸性的TME。并且,这种DNCaNPs给药后不仅能有效的引起癌细胞ICD,从而诱发宿主的抗肿瘤免疫,还能协同抑制IDO1,中和肿瘤酸度,从而降低TME内免疫抑制性Treg的密度。因此,无论在皮下CT26结肠肿瘤模型还是原位4T1乳腺肿瘤模型中,静脉注射DNCaNPs均能取得较好的肿瘤抑制效果。综上,本研究提出了一种简便的碳酸钙辅助制备pH响应型纳米药物的方法,该纳米药物具有有效的TME调节作用,可用于癌症的高效化疗-免疫治疗。
I DNCaNPs的制备与性能表征
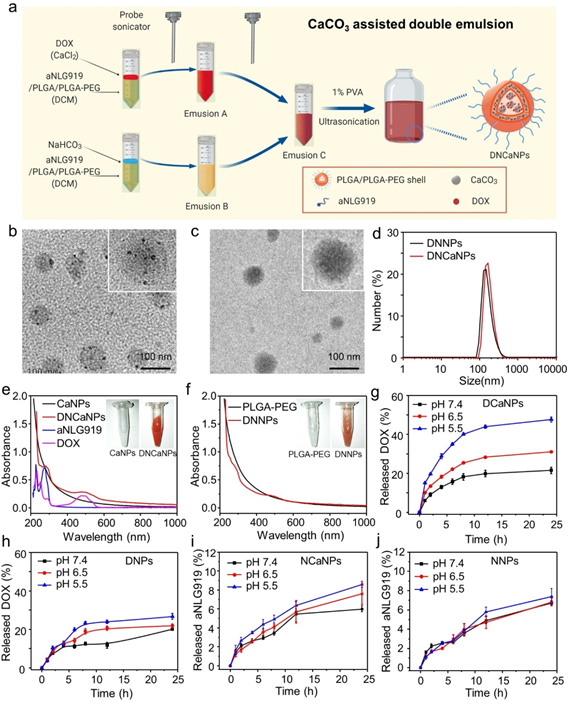
通过碳酸钙辅助的双微乳法制备DOX和aNLG919共装载纳米颗粒DNCaNPs的制备流程如图1a所示。通过图1b、c透射电镜结构所示,制备得到的DNCaNPs纳米颗粒与无碳酸钙组分配方DNNPs相比,DNCaNPs内部有衬度明显较高的碳酸钙颗粒证明了碳酸钙的成功负载。并且由DLS图1d可知制备得到的DNCaNPs有较为均匀的粒径分布。负载DOX及aNLG919后紫外吸收的变化也表明药物的成功负载(图1e, f)。并且由于碳酸钙的存在,为DNCaNPs提供了优异的酸响应药物释放能力。如图1g,h所示,与无碳酸钙组分配方DNNPs相比,在酸性环境中DNCaNPs能够更快更有效的释放出负载药物DOX。而aNLG919由于负载在疏水的PLGA层中,释放速率较慢,能够实现长效免疫调节功能(图1i, j)。
图1. (a) DNCaNPs的制备流程图;(b, c) DNCaNPs与DNNPs的TEM图;(d) DNCaNPs与DNNPs的DLS图;(e) DNCaNPs及(f) DNNPs的紫外吸收谱,(g) DCaNPs和(h) DNPs的pH响应性DOX曲线;(i) NCaNPs和(j) NNPs的aNLG919释放曲线。
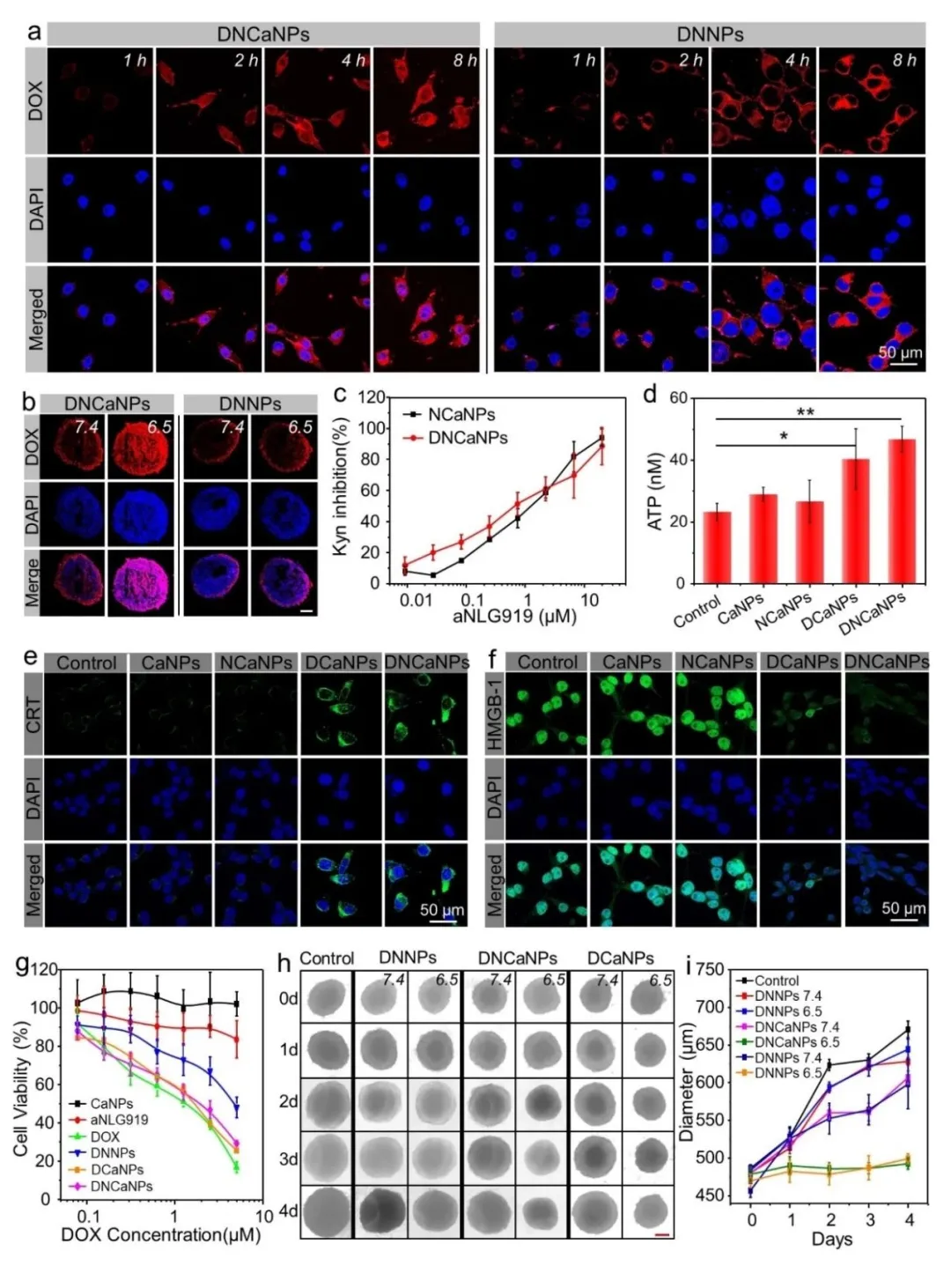
体外细胞实验证明被肿瘤细胞摄取后,碳酸钙的存在还能显著提升化疗药物DOX从酸性溶酶体中释放从而进入细胞核(图2a)并发挥更强的细胞杀伤作用(图2g)。随后的肿瘤细胞微球渗透实验表明,与DNNPs相比,碳酸钙的存在能辅助DNCaNPs在酸性条件下更好的渗透到肿瘤微球内部(图2b),并更好的抑制肿瘤微球的生长(图2h, i)。在图2c中,组分aNLG919的功能也得到了充分验证,表明无论是单独装载aNLG919的NCaNPs还是共装载DOX和aNLG919的DNCaNPs都能有效的抑制肿瘤细胞IDO功能,减少免疫抑制分子犬尿氨酸的产生。通过将DNCaNPs及其对照组分与癌细胞共孵育实验表明,DNCaNPs以及DCaNPs都能有效引发癌细胞的免疫原性细胞死亡,诱发ATP释放(图2d)、钙网蛋白(CRT)表达(图2e)以及高迁移率族蛋白(HMGB1)释放(图2f)。为之后与免疫治疗策略联合提供了理论基础。
图2. (a) DNCaNPs和DNNPs的进细胞行为共聚焦图;(b) DNCaNPs与DNNPs的在不同pH下的渗透进入肿瘤细胞微球的冷冻切片共聚焦图;(c) NCaNPs与DNCaNPs的犬尿氨酸抑制性能测试;(d) DNCaNPs及其对照组分引发的细胞ATP释放测试;(e) DNCaNPs及其对照组分引发的细胞CRT表达检测;(f) DNCaNPs及其对照组分引发的细胞HMGB1释放检测;(g) DNCaNPs及其对照组分对癌细胞活力影响MTT测试;(h) DNCaNPs及其对照组分在不同pH下与肿瘤细胞微球共孵育后肿瘤微球生长光学图像及(i) 尺寸变化曲线。
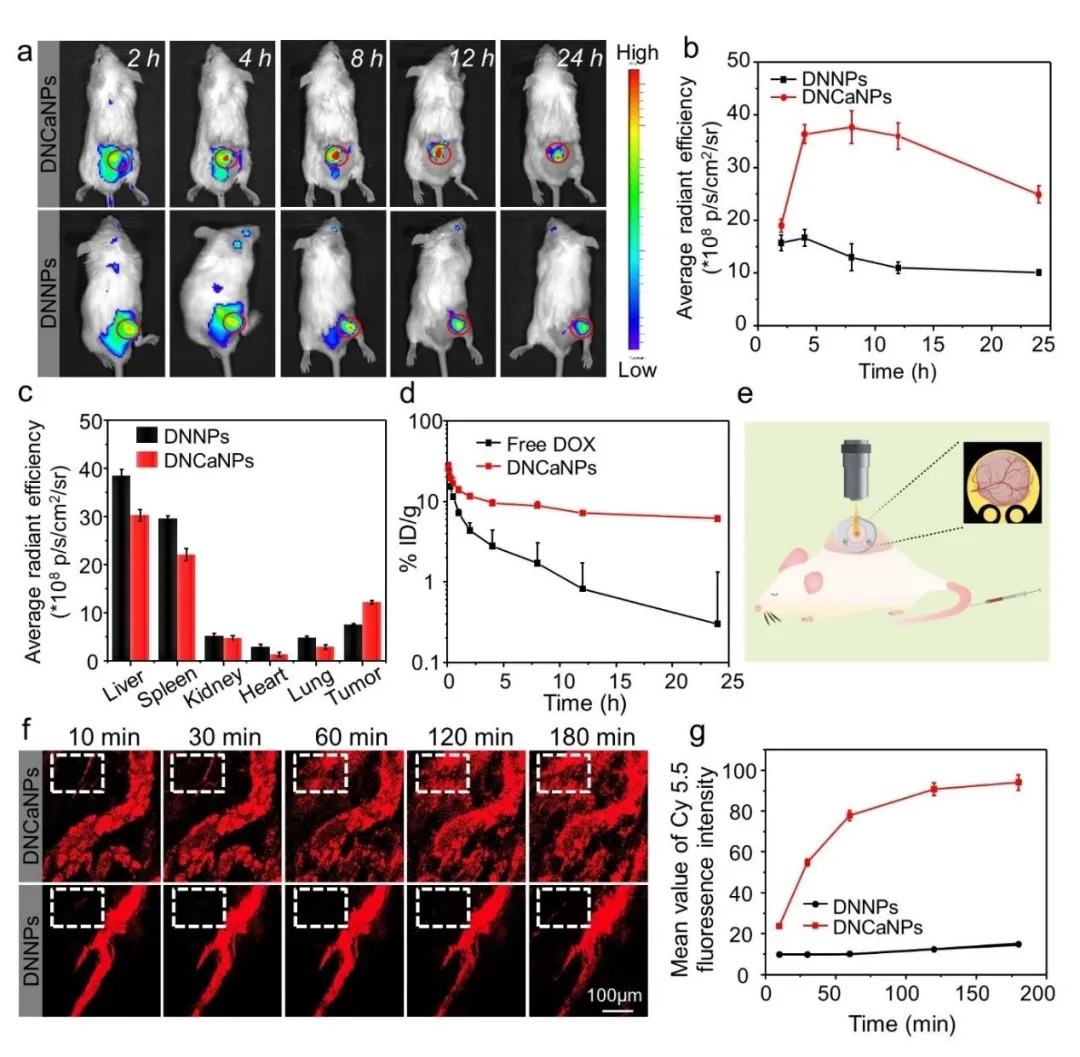
随后的活体肿瘤富集实验表明,静脉注射荧光标记的DNCaNPs与DNNPs相比具有更好的肿瘤富集效果,如图3a、b和c所示。并且,与游离药物DOX相比纳米剂型的DNCaNPs具有更好的血液循环延长能力(图3d)。同时,我们我们实施了活体肿瘤血管渗透实时成像,结果表明相比于DNNPs,含有碳酸钙的DNCaNPs能更好的将负载药物释放渗透进入远离血管的肿瘤内部(图3e-g)。
图3. (a) DNCaNPs与DNNPs的肿瘤富集荧光成像及(b) 荧光强度统计曲线;(c) DNCaNPs与DNNPs给药后的组织分布;(d) DNCaNPs与游离DOX的体内血液循环;(e) 肿瘤血管渗透成像实施简图及(f) DNCaNPs与DNNPs给药后随时间的肿瘤血管渗透成像和(g) 血管外荧光强度随时间的变化曲线。
IV DNCaNPs的CT26模型治疗效果及其免疫评价
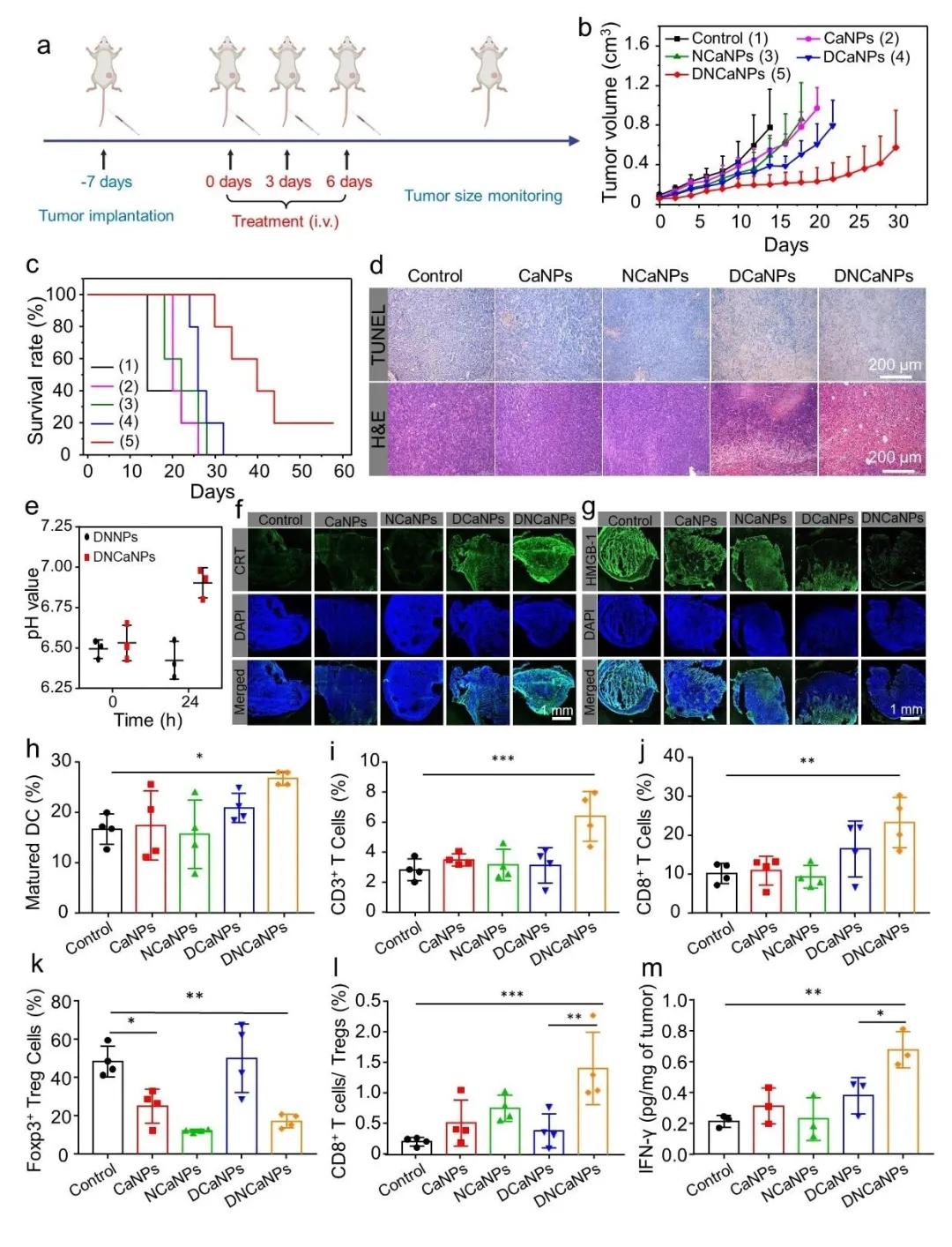
进而,我们对DNCaNPs的治疗效果进行了研究,实施方案如图4a所示,荷瘤7天后,开始治疗,以开始治疗为第0天分别在第0,3,6天 静脉注射治疗药物。通过静脉注射3次给药之后,DNCaNPs组与其他对照组相比,拥有最好的肿瘤生长抑制效果(图4b),有效延长了小鼠生存时间(图4c)。治疗之后的肿瘤H&E和TUNEL染色切片也表明DNCaNPs具有最好的肿瘤杀伤效果(图4d)。并且与单独载DOX组的DCaNPs相比,DNCaNPs组更好治疗效果说明,除了化疗药物的作用外,aNLG919促进的免疫反应也在肿瘤治疗中发挥了重要作用。于是,我们随后对经过治疗后的小鼠肿瘤进行了免疫评价。图4h表明,与其他对照组相比,经过DNCaNPs治疗小鼠的瘤周淋巴结中,成熟的DC细胞比例更高。同时,如图4i-m所示,经过DNCaNPs治疗小鼠的肿瘤组织中,T细胞浸润比例更高(图4i);CD3⁺CD8⁺ T细胞比例更高(图4j);免疫抑制性CD4⁺Foxp3⁺ Treg细胞比例更低(图4k);CD8⁺ T细胞/Treg细胞比例更高(图4l);并且IFN-γ含量更高(图4m)。这一结果充分说明了经过DNCaNPs的治疗后,小鼠肿瘤中的免疫应答被激活,与化疗联合共同抑制了肿瘤的生长。
图4. (a) Balb/c小鼠CT26皮下模型治疗流程简图;(b) DNCaNPs及其对照实验组治疗后小鼠肿瘤生长曲线;(c) DNCaNPs及其对照实验组治疗后小鼠生存率(肿瘤体积到达1000 mm³视作死亡);(d) DNCaNPs及其对照实验组治疗后肿瘤组织H&E及TUNEL染色切片;(e) 分别经过DNCaNPs和DNNPs治疗后,小鼠肿瘤内pH变化;经过DNCaNPs及其对照实验组治疗后(f) 肿瘤组织中CRT及(g) HMGB1免疫荧光染色切片;经过DNCaNPs及其对照实验组治疗后(h) 瘤周淋巴结内树突细胞(DCs)成熟;(i) 肿瘤浸润T细胞;(j) 肿瘤杀伤CD3⁺CD8⁺ T细胞;(k) CD4⁺Foxp3⁺ Treg细胞及(l) CD8⁺ T细胞/Treg比例;(m) 肿瘤组织内IFN-γ含量。
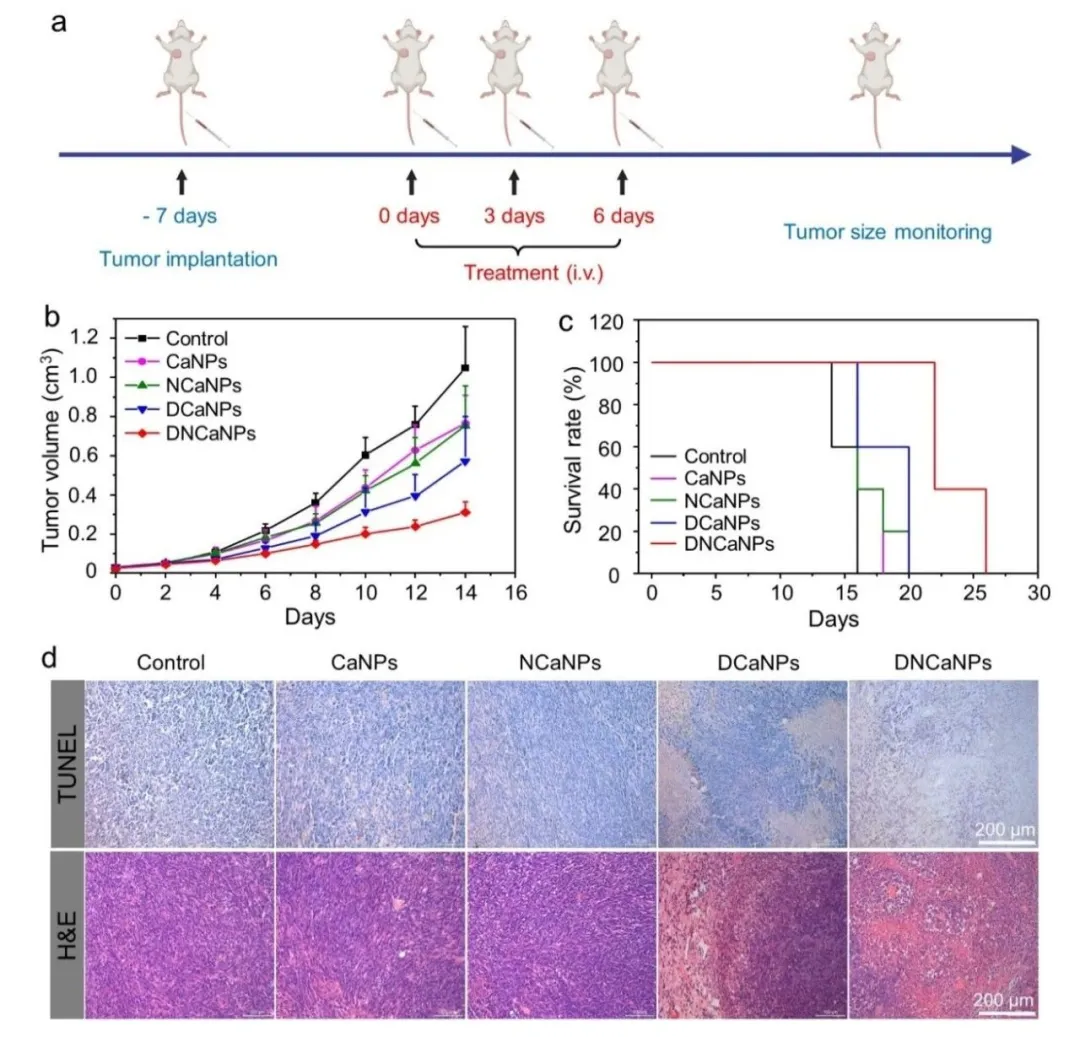
由于在CT26皮下模型中取得了良好的治疗效果,我们尝试在更具挑战的原位4T1模型上验证DNCaNPs的治疗效果,实施方案如图5a所示。荷瘤7天后,开始治疗,以开始治疗为第0天,分别在第0,3,6天 静脉注射治疗药物。通过静脉注射3次给药之后,DNCaNPs组与其他对照组相比,同样拥有最好的肿瘤生长抑制效果(图5b),同时有效延长了小鼠生存时间(图5c)。治疗之后的肿瘤H&E和TUNEL染色切片也表明DNCaNPs具有最好的肿瘤杀伤效果(图5d)。实验结果与CT26模型类似,说明DNCaNPs在原位4T1肿瘤模型中同样拥有良好的治疗效果。证明DNCaNPs所提供的肿瘤化疗与免疫联合治疗是一种广泛有效的治疗策略。
图5. (a) Balb/c小鼠原位4T1模型治疗流程简图;(b) DNCaNPs及其对照实验组治疗后小鼠肿瘤生长曲线;(c) DNCaNPs及其对照实验组治疗后小鼠生存率(肿瘤体积到达1000 mm³视作死亡);(d) DNCaNPs及其对照实验组治疗后肿瘤组织H&E及TUNEL染色切片。
 刘庄
刘庄
本文通讯作者
苏州大学 教授
近年来在生物材料与肿瘤纳米技术领域从事研究,围绕肿瘤诊疗中的若干挑战性问题,发展了一系列新型纳米探针用于体外生物检测与活体分子影像,并探索了多种基于纳米技术和生物材料的肿瘤光学治疗、放射治疗、与免疫治疗新策略。
▍主要研究成果
共发表学术论文320余篇,论文总引用超过55,000次,SCI H-index=125。2014年起连续入围Elsevier出版社发布的“中国高被引用学者榜单”(材料科学类);2015年起连续入选美国美国科睿唯安(原汤森路透集团)公布的“全球高被引科学家名单”(Highly Cited Researchers)(化学、材料)。获国家杰出青年基金、基金委优秀青年基金、江苏省杰出青年基金的资助。
▍Email: zliu@suda.edu.cn
▍个人主页
nano.suda.edu.cn/lz/lzls/list.htm
 冯良珠
冯良珠
本文通讯作者
苏州大学 副研究员
功能化纳米药物载体的构建、肿瘤微环境调节与新型肿瘤治疗等。
▍主要研究成果
迄今在Chem, J. Am. Chem. Soc., ACS Nano, Nano Lett., Adv. Funct. Mater., Coord. Chem. Rev., Biomaterials 等高水平学术期刊上发表论文90余篇,文章的总他引11000余次,SCIH-index为51;2019年入选美国美国科睿唯安(原汤森路透集团)公布的“全球高被引科学家名单”(Highly Cited Researchers);获国自然面上项目、青年基金项目、江苏省青年基金项目等的资助。目前,担任NatureCommunications, ACS Nano, Nano Letters, Biomaterials, Journal of Controlled Release等多个生物材料类学术期刊的特邀审稿人。
▍Email: lzfeng@suda.edu.cn
▍个人主页
nano.suda.edu.cn/lz/flzls/list.htm

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2020 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前10%)。2020 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 苏州大学刘庄教授:肿瘤微环境多重调控与化疗/免疫联合治疗新策略-碳酸钙基纳米载体

 刘庄
刘庄 冯良珠
冯良珠
 Nano-Micro Letters
Nano-Micro Letters 肿瘤化疗耐药性的”克星”:基因与小分子联动治疗新策略
肿瘤化疗耐药性的”克星”:基因与小分子联动治疗新策略 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展