https://doi.org/10.1007/s40820-020-00452-y
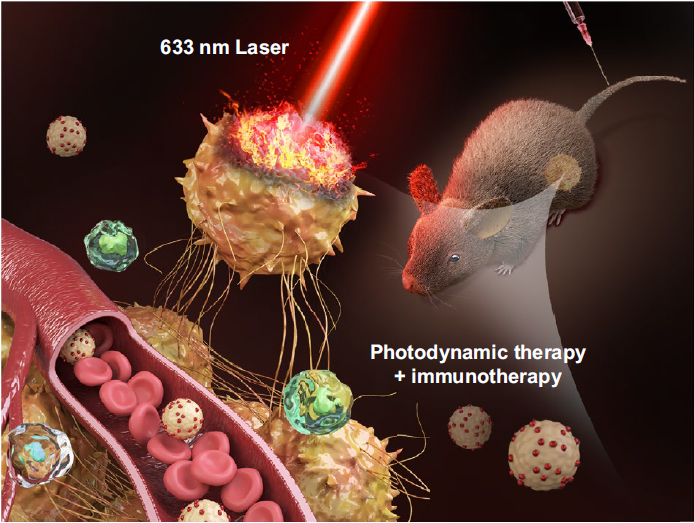
1. 荷载二氧化锰纳米探针的诱导型多功能干细胞(iPS)作为具有肿瘤主动靶向特性的治疗平台。
2. 在多模态成像引导下,在荷瘤鼠模型上获得了增强的光动力治疗效果的同时激发出强烈的抗肿瘤免疫反应。
癌症的发生和发展与肿瘤细胞的高增殖率及其对免疫监视系统的逃避高度相关,理想的癌症治疗策略旨在杀伤肿瘤细胞的同时可以激活机体免疫系统从而彻底消灭肿瘤细胞。因此在本研究中设计出荷载二氧化锰纳米探针的诱导型多功能干细胞(iPS)用于肺癌的治疗研究,此治疗策略旨在获得增强的光动力治疗效果的同时激发出强烈的抗肿瘤免疫反应,藉以提高治疗肺癌的疗效。
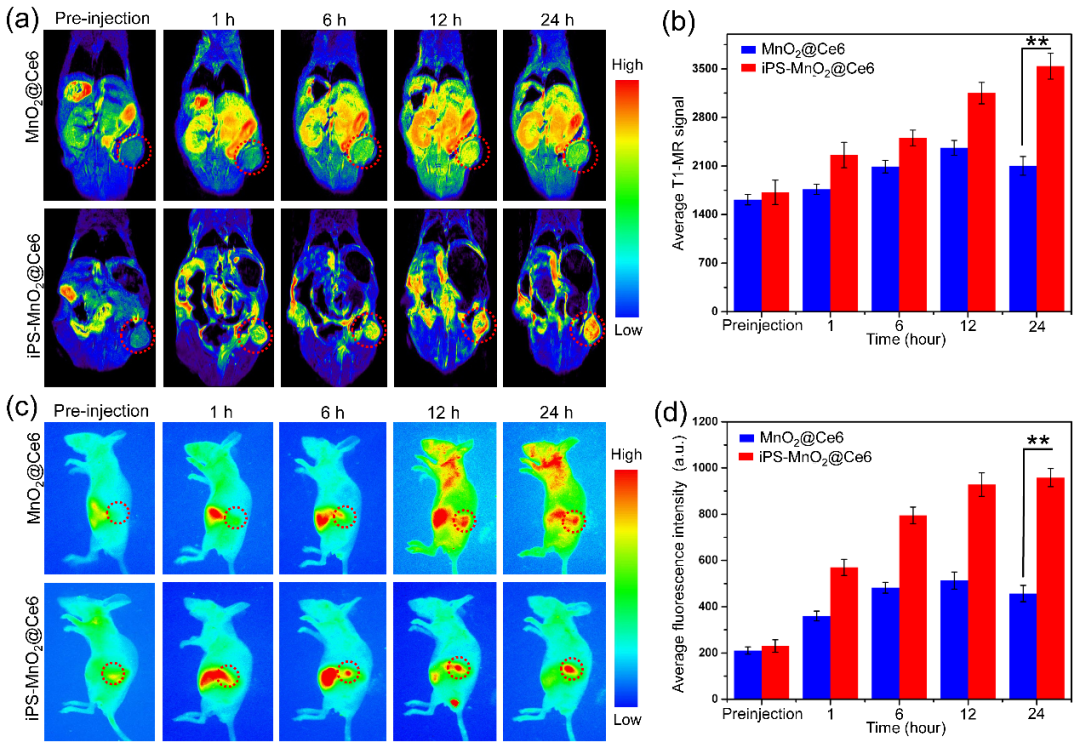
II 在激光介导的光动力治疗过程中iPS细胞释放出类肿瘤样免疫抗原
在体内治疗实验中,在激光介导的光动力治疗过程中,iPS细胞由于死亡裂解释放出大量的类肿瘤样免疫抗原,激发出强烈的多种免疫细胞参与的抗肿瘤免疫反应。
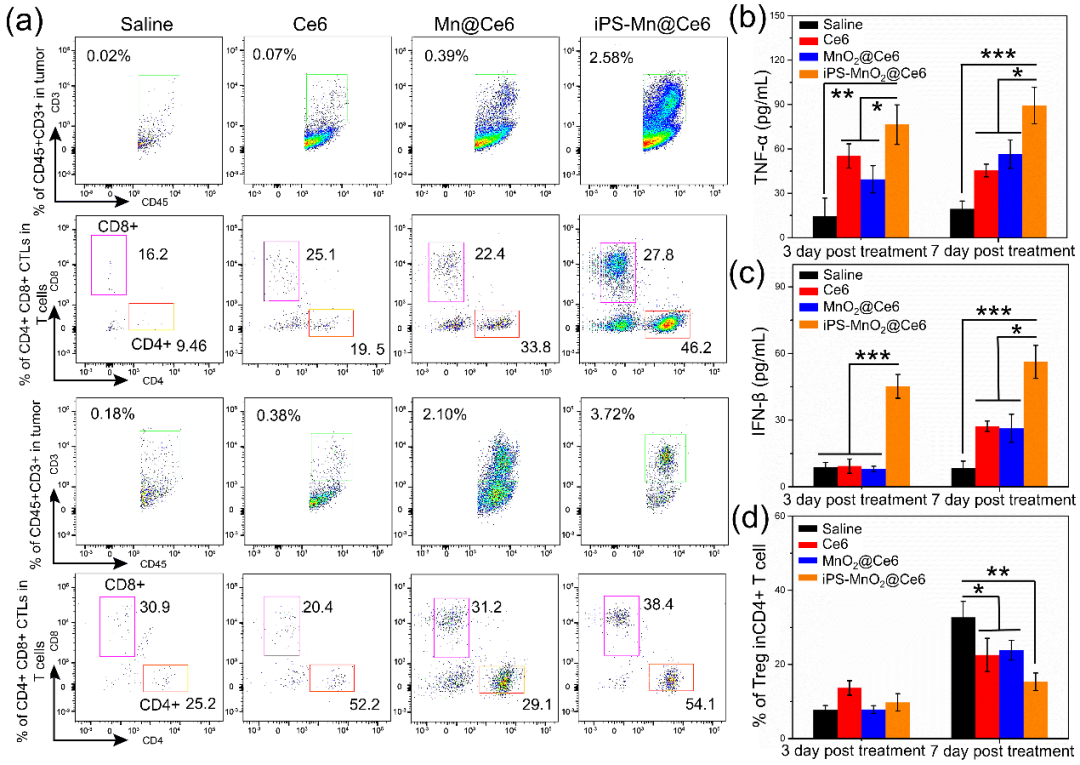
图2. iPS-MnO2@Ce6诱导的基于T细胞应答的肿瘤免疫治疗。(a)激光治疗后不同时间点各组肿瘤CD45+CD3+ T细胞CD4+和CD8+ CTL的流式细胞分析图。各组治疗后不同时间点肿瘤组织中(b)TNF-α和(c)IFN-β的含量。(d)CD4+Foxp3+调节性T细胞(Treg)在CD4+T细胞中的比例。
 崔大祥
崔大祥
本文通讯作者
上海交通大学 讲席教授
在Advanced Materials, ACS Nano, Advanced Functional Materials, CancerRes, Molecular Therapy, Scientific Reports,Biomaterials, Analytical Chemistry, Small, Biosensors & Bioelectronics, Applied Physics Letters等国际专业杂志上发表SCI论文200多篇,ESI高引论文12篇,他引100次以上论文15篇。研究成果获国家科技进步二等奖1项,中国电子学会技术发明二等奖1项,中国产学研创新成果奖1项,军队科技进步2等奖1项,陕西省科技进步2等奖1项,获欧洲与美国专利1项,中国专利授权30项, 主编专著1部,参与编写出版专著8部,其中英文专著5本,参与开发的部分产品获医疗器械证5个。
 张春富
张春富
本文通讯作者
上海交通大学 教授
作为第一或通讯作者发表包括Advanced Science, ACS Nano, Advanced Functional Materials, Cancer Research, Theranostics, Biomaterials, Nanoscale等文章66篇,授权专利2项。曾先后获得教育部自然科学奖二等奖和上海市科学技术奖一等和二等奖各一项。目前为包括Nanomedicine: Nanotechnology Biology and Medicine在内多个英文杂志编委,担任ACSNano、Advanced Materials、Advanced Functional Materials、Journal of American Chemical Society、Small、Theranostics等二十多个期刊特约审稿人。目前承担有国家自然基金项目、上海市科委重点课题和国家重大研发计划子课题的研究。

Nano-Micro Letters《纳微快报》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2019 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前15%)。2019 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
Tel:021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 封面文章|崔大祥教授团队:荷载纳米探针的iPS干细胞用于癌症的光动力和免疫联合治疗
 Nano-Micro Letters
Nano-Micro Letters 复旦大学王建新:一石四鸟—基于人参皂苷的新型多功能肿瘤靶向治疗脂质体
复旦大学王建新:一石四鸟—基于人参皂苷的新型多功能肿瘤靶向治疗脂质体 韩国国家癌症中心:纳米凝胶增强肿瘤成像和光动力治疗效果
韩国国家癌症中心:纳米凝胶增强肿瘤成像和光动力治疗效果 高效光热治疗:香港中文大学王建方&澳门科技大学竺晓鸣合作提出肿瘤治疗新方法
高效光热治疗:香港中文大学王建方&澳门科技大学竺晓鸣合作提出肿瘤治疗新方法 NML通讯 | 聚集诱导发光有机纳米颗粒应用于可视化光动力治疗
NML通讯 | 聚集诱导发光有机纳米颗粒应用于可视化光动力治疗