Red Blood Cell-Mimic Nanocatalyst Triggering Radical Storm to Augment Cancer Immunotherapy
Jiong Li, Sijia Wang, Xinyi Lin, Yanbing Cao, Zhixiong Cai, Jing Wang, Zhenxi Zhang, Xiaolong Liu, Ming Wu*, Cuiping Yao*
Nano-Micro Letters (2022)14: 57
https://doi.org/10.1007/s40820-022-00801-z
1. 构建同时具有光动力/化学动力、类过氧化氢酶和类谷胱甘肽过氧化物酶活性的仿生红细胞纳米催化材料(FTP@RBCM),FTP@RBCM可以引发自由基风暴杀伤肿瘤细胞,同时造成肿瘤细胞的免疫原性死亡。
2. FTP@RBCM结合Tim-3免疫检查点阻断能够系统性地增强机体的抗肿瘤免疫效应,同时抑制原发瘤和远端瘤的生长。
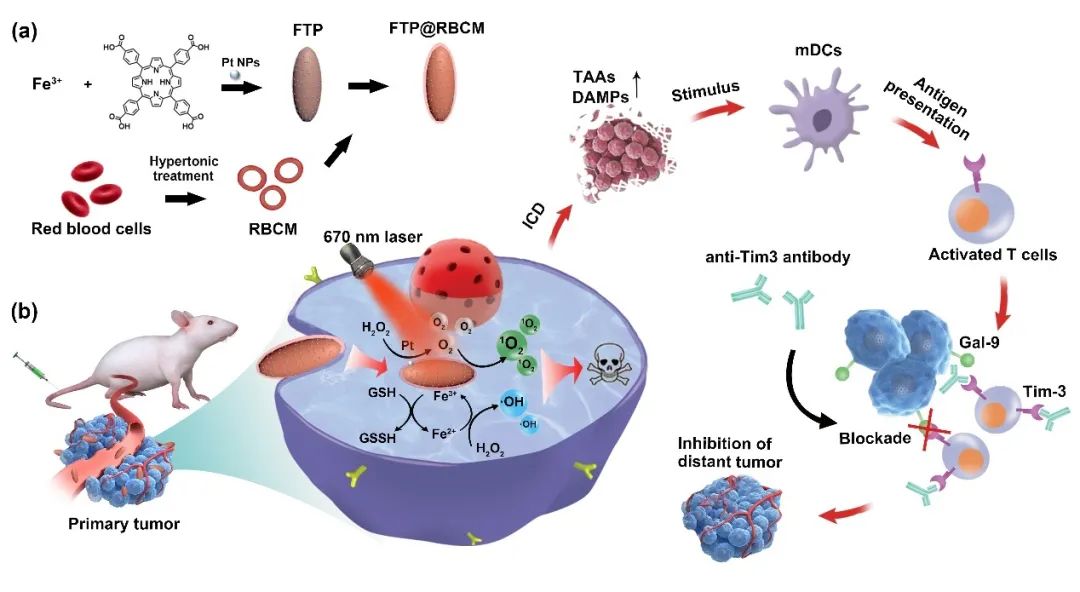
红细胞具有来源广泛、体内半衰期长、生物相容性好优势,可用于体内药物递送和缓解肿瘤乏氧等方面。不仅如此,红细胞还能通过产生活性氧自由基(ROS)清除病原体,参与先天免疫。然而,由于红细胞微米级的大尺寸,极大限制了其在肿瘤内部的渗透和富集,此外,红细胞还面临着储存条件苛刻、易被细菌和病毒污染、以及需要严格配型等不利因素。更为重要的是,血红蛋白的携氧能力和ROS的生成能力有限,使得直接利用红细胞作为载体的ROS疗法在肿瘤治疗中难以取得理想的治疗效果。因此,我们设计合成了一种纳米尺寸、且具有光动力/化学动力(PDT/CDT)和多种类酶活性(类过氧化氢酶和类谷胱甘肽过氧化物酶)的人工红细胞(FTP@RBCM),通过引发胞内的自由基风暴,有效杀伤肿瘤细胞,同时造成肿瘤细胞的免疫原性死亡,进一步协同Tim-3免疫检查点阻断疗法,能够实现“远端效应”,抑制远端瘤的生长。西安交通大学姚翠萍教授团队和福建医科大学孟超肝胆医院吴名、刘小龙教授团队合作开发了一种与天然红细胞组成相近拟合物—红细胞膜包覆的Fe-卟啉基金属有机框架化合物(FTP@RBCM)。FTP@RBCM可以有效发挥光动力/化学动力的作用,同时具有类过氧化氢酶和类谷胱甘肽过氧化物酶活性,能够促进活性氧自由基(ROS)在胞内的大量蓄积,形成自由基风暴,杀伤肿瘤细胞;外层红细胞膜的包覆延长了FTP@RBCM在体内的循环时间,增加了其在肿瘤部位的富集。更为重要的是,胞内的ROS风暴还能引发局部炎症和肿瘤细胞的免疫原性死亡,结合Tim-3免疫检查点抑制剂,既可以有效治疗原发瘤,又可以抑制远端瘤的生长。
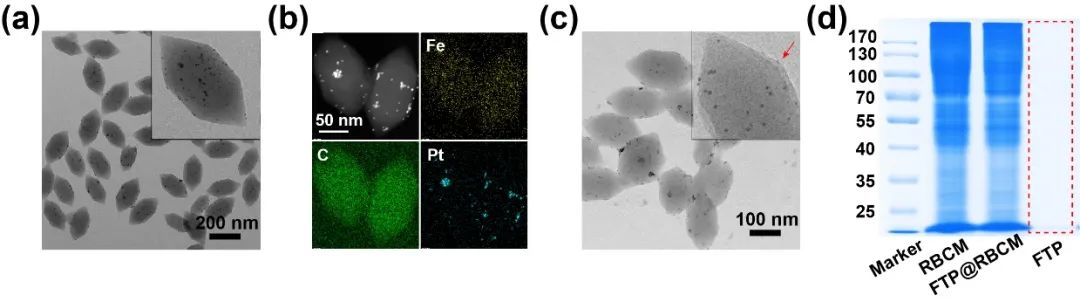
首先,通过乙二醇还原法合成粒径约为3 nm的铂(Pt)纳米颗粒,随后再将Pt纳米颗粒掺入Fe-卟啉金属有机框架化合物FTPs中(图1a)。透射电镜(TEM)及其元素Mapping图谱(图1b)均可证明Pt纳米颗粒的成功修饰。将提取的小鼠红细胞膜包覆在FTPs表面,可得到尺寸均一、形貌为梭形(长为223±24 nm;宽为110 nm±19 nm)的人工红细胞纳米催化材料FTP@RBCM(图1c)。通过包膜前后纳米材料的考马斯染料再次证实了红细胞膜的成功包覆,同时也证明膜蛋白组分在修饰前后并没有发生明显的改变(图1d)。
图1. (a) FTPs的TEM图像;(b) FTPs的元素Mapping图谱;(c) 人工红细胞FTP@RBCM的TEM图像;(d) FTP@RBCM的SDS-PAGE图。
II FTP@RBCM反应活性的表征
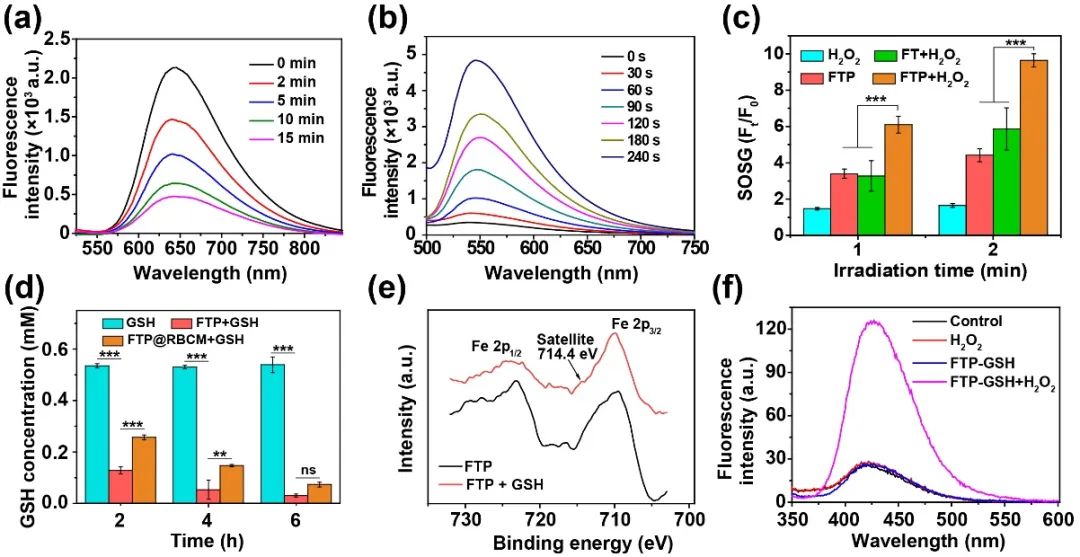
人工红细胞FTP@RBCM同时具有光动力/化学动力,以及类过氧化氢酶和类谷胱甘肽过氧化物酶活性。在含有H₂O₂的溶液中,FTP@RBCM可以引起氧气检测探针([Ru(dpp)₃]Cl₂)荧光强度(650 nm)的显著下降(图2a),说明FTP@RBCM具有类过氧化氢酶活性,能够催化H₂O₂生成O₂。此外,在670 nm激光照射240 s后,溶液中单线态氧检测探针SOSG的荧光(530 nm)增加了超过12倍(图2b),证明了其良好的光动力作用。相较于无Pt纳米颗粒掺杂的FT,FTP在H₂O₂存在的条件下表现出更强的SOSG荧光信号(图2c),表明FTP@RBCM可以通过自催化产氧,提高¹O₂的生成能力。通过还原型GSH检测试剂盒测得FTP@RBCM可以有效降低溶液中GSH的水平(图2d),证明其具有良好的GSH过氧化物酶活性,能够消耗GSH,避免生成的¹O₂被快速清除。与此同时,通过Fe 2p的XPS图谱可以看出,FTP中的Fe³⁺离子可以被GSH还原,生成Fe²⁺离子,而Fe²⁺离子能够发生芬顿反应,生成羟基自由基·OH,发挥化学动力(CDT)作用(图2e, f)。
图2. (a) 氧气检测探针([Ru(dpp)₃]Cl₂)的荧光光谱图;(b) SOSG探针的荧光光谱图;(c) SOSG探针在530 nm处的相对荧光强度;(d) 不同处理下溶液中GSH的含量;(e) Fe 2p的XPS图谱;(f) ·OH检测探针对苯二甲酸的荧光光谱图。
构建Hepa1-6荷瘤小鼠模型,将用ICG标记后的FTP或FTP@RBCM通过尾静脉注射入小鼠体内,不同时间点收集血清,分析血药浓度,测定出药代动力学参数,如图3a所示,红细胞膜的包覆可以将纳米材料的血液半衰期(t₁)从14.8 h延长至24.1 h。同时观察纳米材料在小鼠体内的分布情况,红细胞膜的包覆可以增加纳米材料在肿瘤部位的富集,并在注射5 h后达到峰值(图3b)。在肿瘤富集达到峰值时,对荷瘤小鼠施加670 nm激光照射(100 mW/cm²,10 min),在FTP@RBCM的多种类酶活性和PDT/CDT治疗作用下,能够显著抑制小鼠肿瘤的生长(图3c, d)。
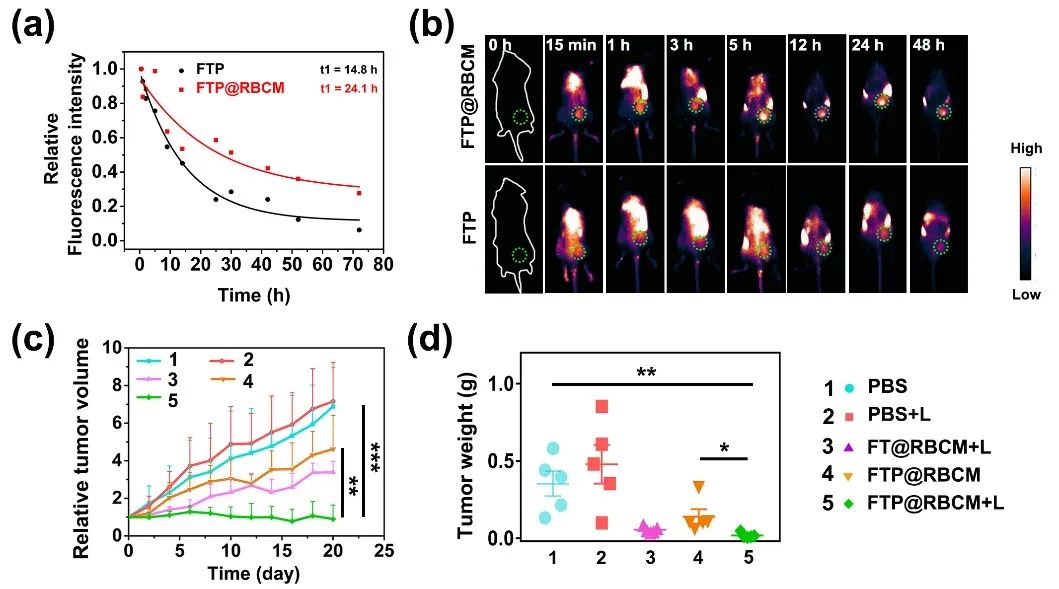
图3. (a) 尾静脉注射ICG标记的FTP或FTP@RBCM后,不同时间点血清中归一化的荧光强度图;(b) 小鼠体内的荧光分布图;(c) 肿瘤生长曲线;(d) 平均肿瘤质量。
IV 自由基风暴引发的免疫学效应
人工红细胞FTP@RBCM不仅能够在670 nm激光照射下生成并积累大量的ROS,形成自由基风暴,杀伤肿瘤细胞,而且可以引起肿瘤细胞的免疫原性死亡(ICD)。通过对ICD分子标志物(HMGB1和CRT)的免疫荧光染色可以看出,经FTP@RBCM孵育并施加激光照射的Hepa1-6细胞,其核内的红色荧光强度显著下降(HMGB1从细胞核内释放),而细胞膜上的绿色荧光明显增强(CRT表达上调),表明FTP@RBCM引发的自由基风暴可造成肿瘤细胞的免疫原性死亡,释放“危险信号分子”(图4a, b)。治疗3天后,取荷瘤小鼠的引流淋巴结进行流式分析,DCs细胞成熟(CD80⁺CD86⁺)的比例明显增加(图4c, d)。与此同时,分析肿瘤组织中的细胞因子,发现γ-IFN和IL-12的水平显著升高(图4e, f),证明FTP@RBCM治疗后可引起小鼠体内的免疫反应。
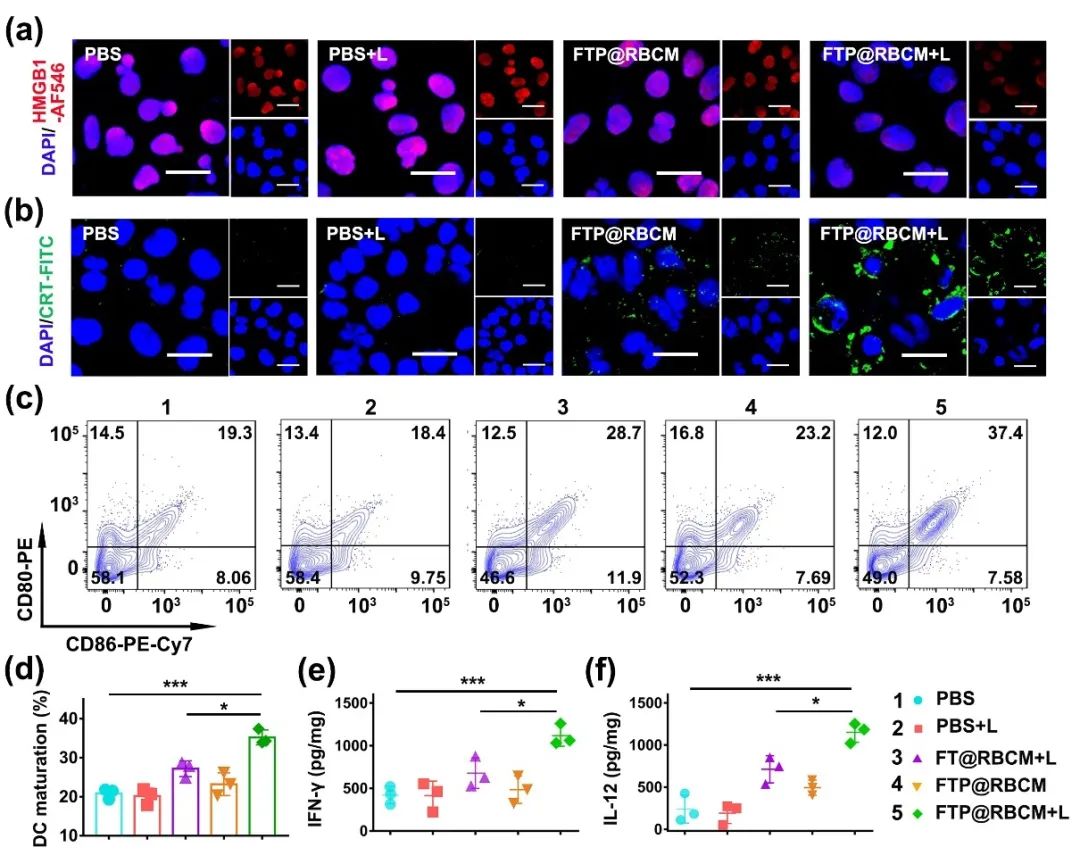
图4. (a) HMGB1的免疫荧光染色图像;(b) CRT的免疫荧光染色图像;(c) 小鼠引流淋巴结内DCs的成熟分析;(d) DCs成熟占比的统计分析;(e) γ-IFN和(f) IL-12在肿瘤组织内的分泌表达水平。
V FTP@RBCM协同增强Tim-3检查点阻断疗法
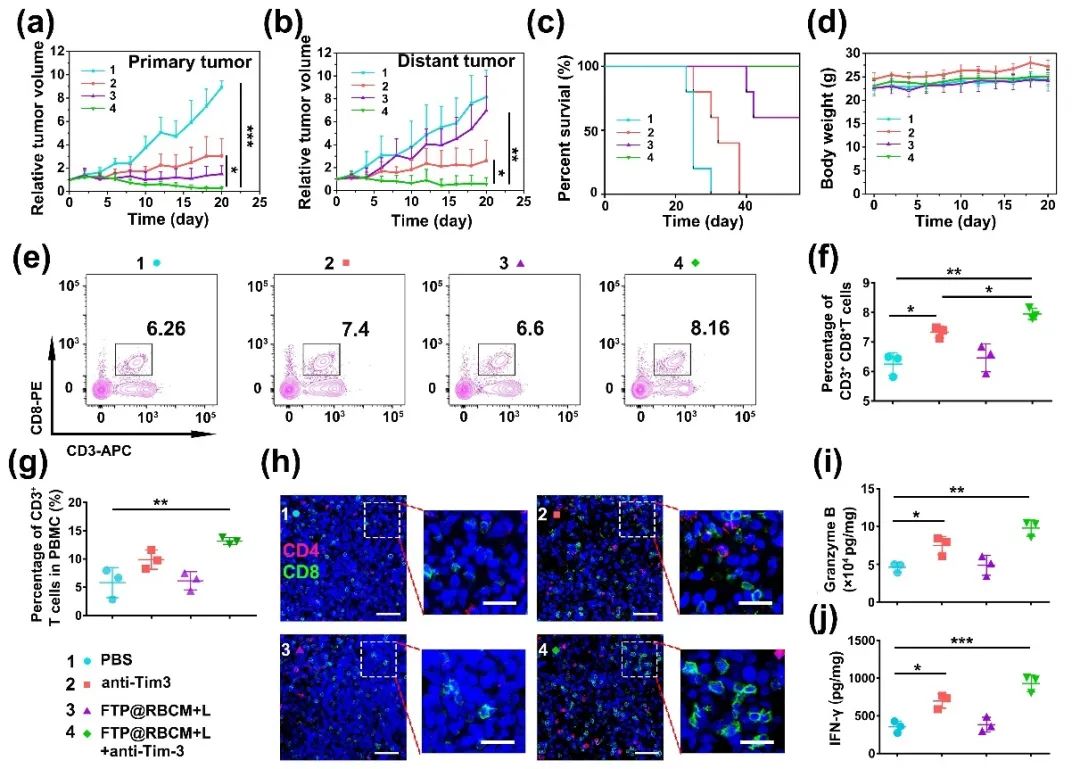
人工红细胞FTP@RBCM能够造成肿瘤细胞的ICD,引起机体的免疫反应,进一步结合Tim-3检查点阻断抗体,可激发系统性的抗肿瘤免疫响应,达到抑制远端瘤的目的。构建Hepa1-6双侧荷瘤小鼠模型,在原发瘤内注射FTP@RBCM进行治疗,隔天腹腔注射Tim-3抗体(100 µg/只),此后每间隔3天,注射1次抗体,共给药3次,期间持续记录小鼠肿瘤体积变化和生存状况。FTP@RBCM协同Tim-3抗体治疗不仅可以有效抑制原发瘤的生长,还具有“远端效应”,并且大大延长了小鼠的生存期(图5a-c)。整个治疗过程中小鼠的体重无明显变化,说明治疗方案对小鼠的系统毒性较低(图5d)。抗体给药结束3天后,通过流式分析小鼠脾脏和外周血中的T淋巴细胞(图5e-g),协同治疗组能够提高脾脏中CD3⁺CD8⁺ T细胞和PBMC中CD3⁺ T细胞的比例,表明协同人工红细胞FTP@RBCM和Tim-3抗体治疗可以激发小鼠系统性的免疫响应。同时,取小鼠的远端瘤分别进行CD4⁺CD8⁺ T细胞免疫荧光染色和瘤内细胞因子表达分析(图5h-j),证明协同治疗组不仅可以促进CD4⁺CD8⁺ T细胞在远端瘤内的浸润,而且可以提高颗粒酶B和γ-IFN在瘤内的分泌表达水平。
图5. (a) 原发瘤生长曲线;(b) 远端瘤生长曲线;(c) 小鼠的生存曲线;(d) 小鼠的平均体重;(e) 脾脏内CD3⁺CD8⁺ T细胞的流式分析;(f) 脾脏内CD3⁺CD8⁺ T细胞占比的统计分析;(g) PBMC内CD3⁺ T细胞占比的统计分析;(h) 远端瘤内CD4⁺CD8⁺ T细胞的免疫荧光染色;(i) 颗粒酶B和(j) γ-IFN在远端瘤内的分泌表达水平。
 吴名
吴名
本文通讯作者
福建医科大学孟超肝胆医院 研究员
多模态分子影像、药物输送纳米载体和“诊疗一体化”纳米探针。
▍主要研究成果
福建医科大学孟超肝胆医院研究员,主持国家自然科学基金、中国博士后面上项目、福建省卫生-教育联合攻关项目等科研项目;以第一/通讯作者身份在iScience, Advanced Science, Theranostics, ACS Applied Materials & Interfaces, Advanced Healthcare Materials, Chemical Communications等杂志发表论文20多篇;入选福建省青年拔尖人才计划,荣获2015年度英国物理学会“China Top Cited Author Award”、第十三届福建省自然科学优秀学术论文奖。
▍Email: wmmj0419@163.com
 姚翠萍
姚翠萍
本文通讯作者
西安交通大学 教授
光学诊疗方法及应用,光学手术导航技术及仪器,体外诊断新技术与仪器。
▍主要研究成果
西安交通大学生命学院生物光子与传感研究所副所长(主持工作),生物医学信息工程教育部重点实验室教授、博士生导师,中国光学学会生物医学光子学专业委员会常委,陕西省医学会激光医学分会委员,陕西省光学学会理事会理事。《激光生物学报》常务编委。主持国家自然科学基金项目5项。作为主要人员参与国际合作重点项目两项,重大仪器专项两项。在OpticsLetters, Nature Communications, Optics Express, Journal of Biomedical Optics, Journal of Biophotonics, Advanced Healthcare Materials, ACS Applied Materials & Interfaces, Drug Delivery,IEEE Transaction on Nanobioscience, Nanotechnology, 中国激光、光学学报等学术杂志发表SCI/EI收录科技论文60余篇,以第一发明人获授权国家发明专利5项。参与译著三本,参编教材三部。
▍Email: zsycp@xjtu.edu.cn

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2020JCR影响因子达16.419,学科排名Q1区前10%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 仿生红细胞:引发自由基风暴杀伤肿瘤细胞&增强免疫效应



 吴名
吴名 姚翠萍
姚翠萍
 Nano-Micro Letters
Nano-Micro Letters NML2024.5封面文章:3D打印碳基共形电磁屏蔽模块用于集成电子电磁辐射防护
NML2024.5封面文章:3D打印碳基共形电磁屏蔽模块用于集成电子电磁辐射防护 北交大邓涛团队:超贴合性皮肤式集成无线充电微型超级电容器
北交大邓涛团队:超贴合性皮肤式集成无线充电微型超级电容器 浙江大学胡宁等综述:用于先进电生理记录的有源微纳生物电子器件
浙江大学胡宁等综述:用于先进电生理记录的有源微纳生物电子器件 武汉理工大学麦立强综述:水系钠/钾离子电池中普鲁士蓝类似物过渡金属离子溶解抑制策略
武汉理工大学麦立强综述:水系钠/钾离子电池中普鲁士蓝类似物过渡金属离子溶解抑制策略